Perossido di zinco
| Perossido di zinco | |
|---|---|
 | |
| Nomi alternativi | |
| Diossido di zinco | |
| Caratteristiche generali | |
| Formula bruta o molecolare | ZnO2 |
| Aspetto | polvere binco-giallognola |
| Numero CAS | |
| Numero EINECS | 215-226-7 |
| PubChem | 10129902 |
| SMILES | [Zn+2].[O-][O-] |
| Proprietà chimico-fisiche | |
| Densità (g/l, in c.s.) | 1570 |
| Costante di dissociazione acida (pKa) a K | ~7 (soluzione al 3%) |
| Temperatura di fusione | 212 °C |
| Indicazioni di sicurezza | |
Il perossido di zinco (ZnO2) si presenta a temperatura ambiente come una polvere giallo brillante. Storicamente era usato come antisettico chirurgico; più recentemente il perossido di zinco è stato utilizzato anche come ossidante in esplosivi e miscele pirotecniche. Le sue proprietà sono state descritte come una transizione tra perossidi ionici e covalenti[1]. Il perossido di zinco può essere sintetizzato attraverso la reazione di cloruro di zinco e perossido di idrogeno[2]
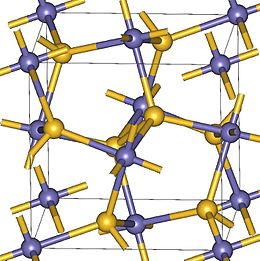
Struttura cristallina
[modifica | modifica wikitesto]Il perossido di zinco possiede struttura cubica; il suo gruppo spaziale è Pa3 (gruppo n°205) ed è caratterizzato da una banda proibita indiretta di 3,8 eV[3].
Preparazione
[modifica | modifica wikitesto]L'idrossido di zinco viene fatto reagire con una miscela di acido cloridrico e acqua ossigenata, e precipitato con idrossido di sodio contenente anche perossido di idrogeno per garantire una maggiore resa di perossido di zinco. A differenza della preparazione del perossido di rame, lo ione zinco non provoca la decomposizione del perossido.
Applicazioni
[modifica | modifica wikitesto]Dagli anni '30 il perossido di zinco è stato applicato in una varietà di ambiti, dalla medicina all'estetica e persino ai fuochi d'artificio[2].
Uso medico
[modifica | modifica wikitesto]Il trattamento delle ulcere scavatrici nella parete addominale con perossido di zinco è stato registrato per la prima volta nel 1933 e per tutti gli anni '40 lo ZnO2 è stato utilizzato come disinfettante per le infezioni chirurgiche[4]. Il perossido di zinco è stato, tuttavia, ritenuto inefficace contro alcuni ceppi batterici, come Streptococcus viridans, Staphylococcus aureus, E. coli, B. proteus e B. pyocyoneus. Un aspetto della tossicità dei microrganismi del composto è il conseguente ristagno delle popolazioni microbiche al momento della somministrazione. Si è ipotizzato che questo effetto dipendesse dalla propensione del composto per la donazione di ossigeno. È stato suggerito[da chi?] che l'aumento della concentrazione di ossigeno associato alla presenza di perossido di zinco interferisce con i processi replicativi di organismi anaerobi e microaerofili, entrambi i quali richiedono ambienti a basso contenuto di ossigeno per la loro sopravvivenza[5]. Sebbene questo meccanismo fosse sufficiente per spiegare la stagnazione delle popolazioni di microbi, non ha tenuto conto della riduzione attiva delle dimensioni delle colonie. Per quanto riguarda la funzione microbicida, è stato ipotizzato che lo stesso ione zinco abbia proprietà antibatteriche, facilitate dal legame dello ione zinco alla parete cellulare batterica, che consente l'esercizio di effetti citotossici. È stato osservato che lo zinco è più efficace nell'eliminazione dei batteri Gram-positivi rispetto ai batteri Gram-negativi. Questa differenza è stata attribuita a una diversità nella composizione proteica delle rispettive pareti cellulari, con la parete gram-positiva che fornisce una composizione più favorevole al legame[6].
Macchia minerale
[modifica | modifica wikitesto]Recentemente il composto ha trovato impiego come colorante minerale per legno e altre sostanze. Il meccanismo di questa azione prevede l'applicazione di un sale metallico (come il cloruro ferroso) e il perossido di zinco al materiale di substrato (legno o materiale simile al legno, ad esempio bambù, carta, tessuti e prodotti di cellulosa). Il sale metallico viene applicato in soluzione e lasciato asciugare per un massimo di 30 minuti. Successivamente viene applicato il perossido di zinco, anch'esso in soluzione. Il cambiamento di colore è immediatamente visibile; le due soluzioni impregnano il materiale e reagiscono, radicandosi così nella matrice del substrato. Sebbene queste macchie possano produrre una varietà di colori che vanno da un marrone rossastro a una tonalità gialla, sono generalmente utilizzate per imitare l'aspetto delle specie di legno in via di estinzione in stock più economici e più comunemente disponibili[7]
Pirotecnica
[modifica | modifica wikitesto]Negli anni '80 è stata scoperta la capacità del perossido di zinco di integrare le miscele pirotecniche. È stato notato che lo ZnO2 era preferibile all'uso di composti del bario, poiché era ritenuto meno tossico. Il perossido di zinco si dimostra un componente efficace negli esplosivi a causa delle sue proprietà ossidanti. Molti esplosivi chimici si basano su reazioni di ossidazione rapida, per questo motivo il perossido di zinco è un candidato ideale per l'uso in pirotecnica. Un altro vantaggio del perossido di zinco è stato che, rispetto ai piroingredienti come bario e stronzio, provoca una minore corrosione nei materiali metallici che contengono i composti nello strumento pirotecnico. In una modalità è necessario che il perossido di zinco agisca in combinazione con un riduttore come il siliciuro di calcio, per creare la necessaria reazione redox. In un'altra modalità, un esplosivo "secondario" viene miscelato con perossido di zinco. Gli esplosivi secondari includono nitrocellulosa, pentaeritritolo tetranitrato (PETN), così come una varietà di composti, come il trinitrobenzene, che forniscono un potente bilancio di carica negativa[8]. Questi esplosivi secondari sono relativamente insensibili a stimoli quali impatto fisico, calore o carica.
Sicurezza
[modifica | modifica wikitesto]Il perossido di zinco è molto pericoloso in caso di contatto con la pelle, con gli occhi, ingestione o inalazione. È stato dimostrato che è corrosivo per la pelle e l'esposizione prolungata può provocare ustioni e ulcerazioni della pelle. La sovraesposizione per inalazione può causare irritazione delle vie respiratorie. L'infiammazione della pelle è caratterizzata da prurito, desquamazione, arrossamento o, occasionalmente, formazione di vesciche. Il perossido di zinco è tossico per i polmoni e le mucose. L'esposizione ripetuta o prolungata può produrre danni agli organi; l'inalazione ripetuta o prolungata dei vapori può causare irritazione cronica delle vie respiratorie[9].
Note
[modifica | modifica wikitesto]- ^ (EN) R.D. Ayengar, ESR Studies on Zinc Peroxide and Zinc Oxide Obtained from a Decomposition of Zinc Peroxide, in J. Phys. Chem., vol. 75, n. 20, 1971, pp. 3089–3092, DOI:10.1021/j100689a009.
- ^ a b (EN) W. Chen, Synthesis, Thermal Stability and Properties of Zinc Peroxide Nanoparticles (PDF), in J. Phys. Chem., vol. 113, n. 4, 2009, pp. 1320–1324, DOI:10.1021/jp808714v.
- ^ (EN) A.L. Companion, The diffuse reflectance spectra of zinc oxide and zinc peroxide, in Journal of Physics and Chemistry of Solids, vol. 23, n. 12, 1962, pp. 1685–1688, DOI:10.1016/0022-3697(62)90205-6.
- ^ (EN) F. Meleney, Zinc Peroxide in Surgical Infections, in The American Journal of Nursing, vol. 41, n. 6, 1941, pp. 645–649, DOI:10.1097/00000446-194106000-00004.
- ^ (EN) B. Johnson, The Antiseptic and Detoxifying Actions of Zinc Peroxide on Certain Aerobic, Anaerobic and Micro-aerophilic Bacteria, in Annals of Surgery, vol. 109, n. 6, 1939, pp. 881–911, DOI:10.1097/00000658-193906000-00001.
- ^ (EN) S. Atmaca, The Effect of Zinc on Microbial Growth, in Turkish Journal of Medical Science, vol. 28, 1998, p. 595.
- ^ (EN) Mineral stains for wood and other substrates, 6.905.520, USPTO Patent, Stati Uniti.
- ^ (EN) Zinc Peroxide Pyrotechnic Patent, su ip.com, 14 dicembre 1982. URL consultato il 21 luglio 2016.
- ^ (EN) Zinc Peroxide Material Safety Sheet, su sciencelab.com. URL consultato il 27 maggio 2012 (archiviato dall'url originale il 3 marzo 2016).