Neurotensina
| Neurotensina | |
|---|---|
 | |
| Nomi alternativi | |
| Neurotensina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C78H121N21O20 |
| Massa molecolare (u) | 1672,92 |
| Numero CAS | |
| PubChem | 25077406 |
| SMILES | CCC(C)C(C(=O)NC(CC(C)C)C(=O)O)NC(=O)C(CC1=CC=C(C=C1)O)NC(=O)C2CCCN2C(=O)C(CCCN=C(N)N)NC(=O)C(CCCN=C(N)N)NC(=O)C3CCCN3C(=O)C(CCCCN)NC(=O)C(CC(=O)N)NC(=O)C(CCC(=O)O)NC(=O)C(CC4=CC=C(C=C4)O)NC(=O)C(CC(C)C)NC(=O)C5CCC(=O)N5 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | --- [1] |
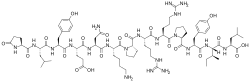
La Neurotensina (NT) è un peptide di 13 aminoacidi (N-ter-Glu-Leu- Tyr-Glu-Asn- Lys-Pro-Arg- Arg-Pro-Tyr- Ile-Leu-C-ter) isolato per la prima volta da Carraway e Leeman nel 1973. Come molti altri neuropeptidi, la NT svolge il doppio ruolo di neurotrasmettitore e neuromodulatore nel sistema nervoso centrale, e di ormone locale a livello periferico. Nel sistema nervoso centrale, la NT funge da neuromodulatore soprattutto della trasmissione dopaminergica ed in misura minore di quella serotoninergica e noradrenergica, ed influenza anche la secrezione ormonale. A livello periferico la neurotensina è un modulatore paracrino ed endocrino del tratto digestivo, e del sistema cardiovascolare dei mammiferi e può agire anche come fattore di crescita di cellule normali e tumorali.
Farmacologia della neurotensina
[modifica | modifica wikitesto]La NT, in quanto neuromodulatore, ha potenti effetti centrali, tra cui ipotermia, antinocicezione e induzione della secrezione di ormoni da parte della ghiandola pituitaria anteriore. A livello periferico, invece, agisce come ormone peptidico paracrino o endocrino per il sistema cardiovascolare e digestivo. Uno dei primi effetti centrali della NT osservati sperimentalmente fu proprio l'ipotermia, indotta dalla sua iniezione per via intracerebrale. Successivamente, sempre per somministrazione per via intra cerebro ventricolare (i.c.v) è stato evidenziato il suo effetto antinocicettivo. Cosa molto interessante, l'effetto antinocicettivo della NT non è mediato dal sistema oppioide. Infatti, il trattamento con naloxone (antagonista oppioide aspecifico), non previene l'insorgenza di questo effetto. Da un punto di vista strettamente neurochimico, il principale bersaglio della modulazione da parte della NT è la dopamina (DA). La NT, infatti, interagisce con il sistema dopaminergico ai livelli anatomico, fisiologico e comportamentale. Attraverso dosaggi radioimmunologici e immunoistochimica si è dimostrato che i neuroni contenenti NT sono distribuiti principalmente nelle aree del cervello dove il sistema dopaminergico è più importante. La vasta maggioranza degli studi sugli effetti della NT nella funzione nervosa riportano la sua stretta associazione con il sistema dopaminergico mesocorticolimbico, la cui disfunzione è ipotizzata essere alla base di diversi disturbi psichiatrici come la schizofrenia e la tossicodipendenza. Per tanto il sistema mesocorticolimbico, e i circuiti neurali convergenti in esso, sono considerati come i maggiori substrati neurali per gli effetti terapeutici degli antipsicotici, oltre che per le proprietà gratificanti e psicostimolanti di diverse sostanze psicotrope. Esiste al giorno d'oggi una considerevole mole di dati che indica la NT come un mediatore essenziale degli effetti di antipsicotici (APDs) e psicostimolanti. Ricordiamo che tutti gli psicostimolanti usati in terapia hanno elevata affinità con il recettore D2 della DA. Questa evidenza è alla base della teoria dopaminergica, che vede nella schizofrenia essenzialmente un disordine dovuto ad una iperattività del sistema dopaninergico. Ricordiamo inoltre per ampliare il quadro che molti APDs producono degli effetti psicomotori parkinson-simili dovuti all'inibizione della via dopaminergica nigrostriatale la cui degenerazione è alla base del Parkinson. In contrasto con gli APDs gli psicostimolanti (cocaina, anfetamina, MDMA etc.) potenziano la funzione dopaminergica, direttamente o indirettamente, in varie aree del cervello. Sembrerebbe apparentemente paradossale, allora, che la neurotensina medi effetti simili agli APDs e agli psicostimolanti nello stesso tempo, se non si tenesse in considerazione che l'esito funzionale della modulazione dipende criticamente dall'area cerebrale interessata. Per esempio è stato dimostrato che l'iniezione di neurotensina nel nucleo accumbens (NAc) attenua l'iperlocomozione indotta da anfetamina, come anche altre fenotipi comportamentali legati alla schizofrenia. Al contrario la somministrazione di NT nell'area ventrale tegmentale (VTA) causa iperlocomozione che può andare addirittura incontro a sentitizzazione in caso di somministrazioni ripetute.
L'espressione e il processing della neurotensina
[modifica | modifica wikitesto]Il clonaggio del gene della NT ha segnato una tappa fondamentale nello studio di questo peptide. Questa conquista ha portato all'ulteriore scoperta che la NT, come tutti i neuropeptidi, è sintetizzata da un precursore comune (pro-NT/NN) più grande, che contiene anche la neuromedina N (NN), un peptide di sei aminoacidi simile alla NT. NT e NN sono localizzate al c-terminale del precursore peptidico pro-NT/NN, e sono affiancate e separate da una sequenza aminoacidica dibasica: Lys-Arg (KR). Questa sequenza dipeptidica è il consenso riconosciuto e tagliato dalle endopeptidasi responsabili del processamento, le quali appartengono ad una famiglia di enzimi da poco identificata, quella delle convertasi delle proproteine (proprotein convertases: PCs). Il processing del precursore è tessuto specifico; per esempio nel sistema nervoso centrale (SNC) il processing dà luogo principalmente a NT ed NN. Nell'intestino si produce NT ed un grande peptide terminante con la NN: large-NN. Nelle ghiandole surrenali si evidenzia la sintesi di NT, large-NN ed un grande peptide terminante con NT: large-NT. Nel SNC NT e NN vengono secrete entrambe nello spazio intersinaptico, in seguito a depolarizzazione della membrana. Nell'intestino NT e large NN vengono secreti nel circolo sanguigno. Ci sono evidenze farmacologiche del fatto che NN e NT leghino con equivalente affinità i recettori; cosa dimostrata dal fatto che la NN presenta un profilo di effetti biologici simile a quello della NT. I meccanismi con i quali NT e NN vengono degradati a inattivati sono stati studiati ampiamente. NN è rapidamente inattivato dalle aminopeptidasi, mentre la NT è inattivata più lentamente dalle metalloendopeptidasi. Large-NN, sebbene ancora molto resti da studiare sui suoi meccanismi di degradazione, sembra essere più stabile della NT stessa. Si potrebbe, dunque, ipotizzare che NN, localizzato principalmente nel SNC, funzioni come un neuropeptide, analogamente alle enkefaline, ad azione rapida; mentre al contrario large-NN, che è prodotto dall'intestino e rilasciato nel sangue, funzioni piuttosto come un ormone. Per quanto riguarda la regolazione genica dell'espressione della NT, diverse linee di ricerca hanno evidenziato che tra i fattori di trascrizione che potrebbero attivare la trascrizione del RNA messaggero (RNAm) codificante per il precursore della NT, vi è c-Fos. Evidenze di questo fatto si hanno dall'osservazione diretta sul promotore di un sito AP-1, che è la sequenza consenso per c-Fos.
I recettori della neurotensina
[modifica | modifica wikitesto]Un'altra importante tappa nello studio della NT fu compiuta con il clonaggio del primo recettore della NT (NTS-1), recettore appartenente alla classe dei recettori accoppiati a proteine G. Più recentemente altri due recettori sono stati clonati. Il secondo, nts-2, appartenente anch'esso alla famiglia dei recettori accoppiati alle proteine G, che presenta diverse analogie con NTS1, e infine nts-3, che presenta una molto ridotta omologia di sequenza con i primi due, e la cui struttura resta da chiarire.
Il recettore NTS-1
[modifica | modifica wikitesto]Il recettore è stato clonato per la prima volta da una libreria di cDNA di geni di ratto. La più lunga open reading frame codificava per 424aa con sette putativi domini transmembrana, indicandone l'appartenenza alla famiglia dei recettori accoppiati alle proteine G. Successivamente anche il gene umano venne clonato, e si mostrò essere costituito da 418aa con l'84% d'omologia con quello di ratto. Il gene umano si trova nel braccio lungo del cromosoma 20 (20q13), è presente in copia singola, e la porzione codificante contiene tre esoni. Tra gli effetti cellulari conseguenti all'esposizione a NT si è osservato a livello bioelettrico una corrente di Cl- dipendente dal calcio. Ed è stato inoltre trovato, in cellule trasfettate con il NTS-1 di ratto, che la stimolazione del recettore da parte di neurotensina è efficacemente accoppiata con un aumento della concentrazione di Ca2+ e IP3 intracellulari, e la conseguente attivazione della PLC. Altri esperimenti hanno in seguito evidenziato l'attivazione dell'adenilato ciclasi e della via delle MAP chinasi. Un altro evento conseguente al legame con la NT sembrerebbe l'internalizzazione del recettore. Un altro studio su cellule transfettate, infatti, ha dimostrato che in seguito a stimolazione da parte della NT il 60-70% dei recettori viene internalizzato secondo un processo temperatura dipendente, ed evidenze biochimiche suggeriscono che il recettore non venga riciclato dopo l'internalizzazione. Per quanto riguarda la localizzazione di NTS-1 nel SNC, esperimenti di ibridizzazione in situ hanno rilevato la presenza del suo RNAm in diverse aree tra cui la VTA, e la substantia nigra (SN). Interessante è notare che sebbene la presenza del RNAm non sia stata evidenziata nello striato, studi di immunoistochimica e autoradiografia hanno rivelato la presenza della proteina. Questa evidenza apparentemente contraddittoria potrebbe essere spiegata con l'ipotesi che il recettore venga trascritto e tradotto nei neuroni dopaminergici della SN e che solo dopo per migrazione assonale, si localizzi nello striato.
Il recettore nts2
[modifica | modifica wikitesto]Il secondo recettore della NT (nts-2) è stato trovato nel topo, nel ratto (416aa) e nell'uomo (401aa) grazie a strategie basate sull'omologia di sequenza. Anche lui presenta la struttura dei recettori accoppiati a proteine-G. La sequenza del nts-2 di ratto presenta il 43% di identità e il 64% di omologia con il corrispondente NTS-1. Ciò nonostante esistono differenze strutturali significative tra i due recettori. Da un punto di vista meccanicistico nts2 sembra essere per certi aspetti un antagonista funzionale di NTS-1. Infatti in cellule transfettate con nts-2, il legame del recettore con un antagonista selettivi della NT (SR142948A) è in grado di indurre attivazione delle MAP chinasi, un aumento della concentrazione intracellulare di Ca2+, IP3 e cAMP, effetti che in queste cellule la NT non è in grado di produrre. Sicuramente questi dati vanno presi con le dovute precauzioni, trattandosi di modelli eterologhi d'espressione, comunque è certo che esistano differenze meccanicistiche importanti tra i due recettori, e che studi ulteriori sono necessari per poterle chiarire. Nel SNC l'RNAm che codifica per nts-2 è localizzato principalmente nella corteccia, nel sistema olfattorio, nell'ippocampo e nell'ipotalamo. A differenza di NTS-1, questo recettore nel SNC sembra essere selettivo per i neuroni, e, almeno nel topo, non è stato possibile evidenziarlo nelle cellule gliali. In ogni caso NTS-1 sembra essere il maggior responsabile degli effetti centrali della NT, a parte quelli analgesici, che invece sembrerebbero dovuti a nts-2.
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 24.10.2012
Bibliografia
[modifica | modifica wikitesto]- Chalon P., Vita N., Kaghad M., et al., Molecular cloning of a levocabastine-sensitive neurotensin binding site. FEBS Lett (1996) 386: 91-4.
- Carraway R. and Leeman S. E., The isolation of a new hypotensive peptide, neurotensin, from bovine hypothalami. J Biol Chem (1973) 248: 6854-61.
- Dobner P. R., Barber D. L., Villa-Komaroff L., McKiernan C., Cloning and sequence analysis of cDNA for the canine neurotensin/neuromedin N precursor. Proc Natl Acad Sci U S A (1987) 84: 3516-20.
- Le F., Groshan K., Zeng X.P., Richelson E., Characterization of the genomic structure, promoter region, and a tetranucleotide repeat polymorphism of the human neurotensin receptor gene. J Biol Chem (1997) 272: 1315-22
- Rovere C., Barbero P., Kitabgi P., Evidence that PC2 is the endogenous pro-neurotensin convertase in rMTC 6-23 cells and that PC1- and PC2-transfected PC12 cells differentially process pro-neurotensin. J Biol Chem (1996) 271: 11368-75.
- Tanaka K., Masu M., Nakanishi S., Structure and functional expression of the cloned rat neurotensin receptor. Neuron (1990) 4: 847-54.
- Yamada M., Yamada M., Watson M.A., et al., Deletion mutation in the putative third intracellular loop of the rat neurotensin receptor abolishes polyphosphoinositide hydrolysis but not cyclic AMP formation in CHO-K1 cells. Mol Pharmacol (1994) 46: 470-6.
Collegamenti esterni
[modifica | modifica wikitesto]- neurotensina, in Enciclopedia della scienza e della tecnica, Istituto dell'Enciclopedia Italiana, 2007-2008.
- neurotensina, su sapere.it, De Agostini.