Dipeptide

Un dipeptide è un composto organico formato da due aminoacidi legati da un legame peptidico. Diversi dipeptidi sono fisiologicamente importanti e alcuni sono sia fisiologicamente che commercialmente significativi.
Struttura
[modifica | modifica wikitesto]Lineare
[modifica | modifica wikitesto]Come tutte le strutture proteiche, un dipeptide ha un'estremità da cui sporge il gruppo carbossilico chiamata estremità C-terminale, e un'altra estremità da cui sporge il gruppo amminico chiamata estremità N-terminale. Queste due porzioni sono quelle che generalmente reagiscono con le altre molecole.
A temperatura ambiente, i dipeptidi sono quasi tutti dei solidi bianchi, molto più solubili in acqua degli aminoacidi progenitori.[1] Ad esempio, il dipeptide alanilglutammina ha una solubilità di 586 g/L, circa 10 volte la solubilità della glutammina che è 35 g/L. Poiché i dipeptidi sono inclini all'idrolisi, l'elevata solubilità viene sfruttata nell'alimentazione umana e non.[2]
Ciclica
[modifica | modifica wikitesto]La ciclizzazione di un dipeptide porta alla formazione di dichetopiperazine. Spesso questa classe di molecole è formata da amminoacidi non proteinogenici.[3]
Esempi rilevanti
[modifica | modifica wikitesto]| Nome | Struttura | Funzioni | Amminoacidi di cui è composto |
|---|---|---|---|
| Aspartame | 
|
Dolcificante | L-fenilalanina e acido L-aspartico, con esterificazione. |
| Carnosina | 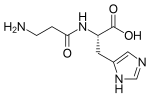
|
Tampone di acidità[4] Antiossidante Chelante[5] Antiglicante[5] Aumenta prestazioni fisiche[6][7] |
β-alanina e L-istidina |
| Acetilcarnosina | 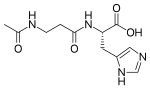
|
Antiossidante[8] | β-alanina e D-istidina, con acetilazione |
| Alanilglutammina | 
|
Integratore alimentare | L-alanina e L-glutammina |
Voci correlate
[modifica | modifica wikitesto]- ^ (EN) Makoto Yagasaki e Shin-ichi Hashimoto, Synthesis and application of dipeptides; current status and perspectives, in Applied Microbiology and Biotechnology, vol. 81, n. 1, 1º novembre 2008, pp. 13–22, DOI:10.1007/s00253-008-1590-3. URL consultato il 19 marzo 2022.
- ^ (EN) Peter Fürst, Karin Pogan e Peter Stehle, Glutamine dipeptides in clinical nutrition, in Nutrition, vol. 13, n. 7, 1º luglio 1997, pp. 731–737, DOI:10.1016/S0899-9007(97)83035-3. URL consultato il 19 marzo 2022.
- ^ Alan D. Borthwick, 2,5-Diketopiperazines: Synthesis, Reactions, Medicinal Chemistry, and Bioactive Natural Products, in Chemical Reviews, vol. 112, n. 7, 11 luglio 2012, pp. 3641–3716, DOI:10.1021/cr200398y. URL consultato il 19 marzo 2022.
- ^ E. C. Bate Smith, The buffering of muscle in rigor; protein, phosphate and carnosine, in The Journal of Physiology, vol. 92, n. 3, 14 aprile 1938, pp. 336–343, DOI:10.1113/jphysiol.1938.sp003605. URL consultato il 19 marzo 2022.
- ^ a b V. Prakash Reddy, Matthew R. Garrett e George Perry, Carnosine: A Versatile Antioxidant and Antiglycating Agent, in Science of Aging Knowledge Environment, vol. 2005, n. 18, 4 maggio 2005, DOI:10.1126/sageke.2005.18.pe12. URL consultato il 19 marzo 2022.
- ^ (EN) Julie Y. Culbertson, Richard B. Kreider e Mike Greenwood, Effects of Beta-Alanine on Muscle Carnosine and Exercise Performance: A Review of the Current Literature, in Nutrients, vol. 2, n. 1, 2010-01, pp. 75–98, DOI:10.3390/nu2010075. URL consultato il 19 marzo 2022.
- ^ Audrey Baguet, Jan Bourgois e Lander Vanhee, Important role of muscle carnosine in rowing performance, in Journal of Applied Physiology, vol. 109, n. 4, 1º ottobre 2010, pp. 1096–1101, DOI:10.1152/japplphysiol.00141.2010. URL consultato il 19 marzo 2022.
- ^ A. Boldyrev e H. Abe, Metabolic transformation of neuropeptide carnosine modifies its biological activity, in Cellular and Molecular Neurobiology, vol. 19, n. 1, 1999-02, pp. 163–175, DOI:10.1023/a:1006933028389. URL consultato il 19 marzo 2022.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su dipeptide
Wikimedia Commons contiene immagini o altri file su dipeptide
| Controllo di autorità | Thesaurus BNCF 67152 · BNF (FR) cb16723328j (data) |
|---|