Chetile
In chimica organica, i chetili sono specie chimiche note fin dal 1891 derivanti da chetoni per aggiunta di un elettrone.[1] Il nome chetile è stato ricavato da "chet-", la radice di "chetone", + "ile", il suffisso che designa un radicale.[2]
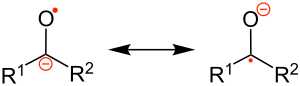
Un chetile è un particolare tipo di anione radicale distonico, la cui struttura è un ibrido, rappresentabile (teoria del legame di valenza) tramite le due forme di risonanza seguenti:[3]
- R1R2C•−O− ↔ R1R2C−−O•
dove si può notare che la carica (negativa), che lo caratterizza come anione, e l'elettrone spaiato, che lo caratterizza come radicale, sono collocati in ogni caso su atomi diversi: questo è il senso dell'aggettivo "distonico".[4][5][6]
Proprietà
[modifica | modifica wikitesto]Riguardo a tale aspetto, la teoria del legame di valenza e calcoli teorici basati sul funzionale densità (DFT) indicano che la "densità di spin" (presenza dell'elettrone spaiato delocalizzato) risiede principalmente sull'atomo di carbonio, invece che sull'ossigeno, il che comporta che la carica negativa risiede principalmente sull'atomo più elettronegativo, cioè qui l'ossigeno.[7][8]
Dal punto di vista della teoria degli orbitali molecolari, l'elettrone spaiato è in un orbitale di antilegame di tipo π del carbonile,[9] per cui il chetile può essere rappresentato come:[10]
- [R1R2C•=O]−
dove però, essendo l'elettrone singolo di antilegame, l'ordine di legame complessivo tra C e O è (4-1)/2 = 3/2. In accordo con questo, si trova che nei chetili la lunghezza del legame C-O è intermedia tra quella tipica del legame doppio nei chetoni e quella tipica del legame semplice negli alcoli.[1]
La contemporanea presenza nei chetili della carica e dell'elettrone spaiato fa sì che essi siano generalmente poco stabili e che si incontrino per lo più come intermedi di reazione;[11] tuttavia, godono comunque della stabilizzazione per risonanza vista sopra, che delocalizza sia il radicale che la carica e che li rende un po' più stabili dei radicali del tipo R1R2C•−OH, derivanti dalla loro protonazione;[12] inoltre, la reazione di dimerizzazione tipica dei radicali non carichi:
R• + R• → R−R
nel caso dei chetili risulta parzialmente inibita dato che comporta l'avvicinamento di due specie cariche dello stesso segno e difficimente potrebbe avvenire senza la presenza di ioni metallici positivi vicini all'ossigeno o senza previa protonazione.
Basicità
[modifica | modifica wikitesto]Un chetile, in quanto anione, è basico ed è la base coniugata del radicale neutro R1R2C•−OH. Per il chetile dell'acetofenone (C6H5)(CH3)C•−O−, che ad esempio è un substrato tipico, si trova un pKb pari 3,5, che corrisponde a un pKa di 10,5 per l'acido coniugato, ossia per il radicale (C6H5)(CH3)C•−OH; più in generale, l'acido coniugato è un radicale α-idrossialchilico >C•−OH che generalmente è ben più acido di un alcool (pKa 16―18).[13]
Formazione
[modifica | modifica wikitesto]I chetili, infatti, derivano formalmente, ma in molti casi anche praticamente, da composti carbonilici (chetoni o aldeidi) per aggiunta di un elettrone;[3] questa reazione, che consiste in un trasferimento monoelettronico a un chetone (SET[14]), ne costituisce una riduzione.[15] In molti casi l'elettrone viene ceduto da un metallo alcalino (Li, Na, K), in alcuni da un reattivo di Grignard e in alcuni altri da un atomo di magnesio, che cede complessivamente due elettroni, ma uno a un carbonile e uno ad un altro.[9][16] È anche possibile ottenere i chetili per riduzione elettrochimica dei rispettivi chetoni (riduzione catodica).[1][17]
Dato che i radicali α-idrossialchilici sono acidi, un altro modo di formazione dei chetili consiste nella loro generazione e deprotonazione in ambiente basico.[18]
Altre proprietà
[modifica | modifica wikitesto]Tale specie chimica generalmente è particolarmente instabile e funge dunque da intermedio di reazione.
Un esempio di reazione chimica in cui partecipano i chetili è la reazione di McMurry.
Note
[modifica | modifica wikitesto]- ^ a b c (EN) Áron Péter, Soumitra Agasti e Oliver Knowles, Recent advances in the chemistry of ketyl radicals, in Chemical Society Reviews, vol. 50, n. 9, 11 maggio 2021, pp. 5349–5365, DOI:10.1039/D0CS00358A. URL consultato il 27 maggio 2024 (archiviato dall'url originale il 15 luglio 2021).
- ^ (EN) Definition of KETYL, su merriam-webster.com. URL consultato il 26 maggio 2024.
- ^ a b The International Union of Pure and Applied Chemistry (IUPAC), IUPAC - ketyls (K03389), su goldbook.iupac.org. URL consultato il 26 maggio 2024.
- ^ (EN) Krista M. Stirk, L. K. Marjatta Kiminkinen e Hilkka I. Kenttamaa, Ion-molecule reactions of distonic radical cations, in Chemical Reviews, vol. 92, n. 7, 1992-11, pp. 1649–1665, DOI:10.1021/cr00015a008. URL consultato il 4 giugno 2024.
- ^ (EN) Daniela Maria Tomazela, Adão A. Sabino e Regina Sparrapan, Distonoid ions, in Journal of the American Society for Mass Spectrometry, vol. 17, n. 7, 1º luglio 2006, pp. 1014–1022, DOI:10.1016/j.jasms.2006.03.008. URL consultato il 4 giugno 2024.
- ^ The International Union of Pure and Applied Chemistry (IUPAC), IUPAC - distonic radical cation (D01809), su goldbook.iupac.org. URL consultato il 27 maggio 2024.
- ^ Noboru Hirota, Spin Distribution in Ketyl Radicals, in The Journal of Chemical Physics, vol. 37, n. 8, 15 ottobre 1962, pp. 1884–1885, DOI:10.1063/1.1733386. URL consultato il 4 giugno 2024.
- ^ (EN) Yosi Kratish, Daniel Pinchuk e Alexander Kaushansky, The Reactions of Carbon Monoxide with Silyl and Silenyl Lithium – Synthesis and Isolation of the First Stable Tetra‐Silyl Di‐Ketyl Biradical and 1‐Silaallenolate Lithium, in Angewandte Chemie International Edition, vol. 58, n. 52, 19 dicembre 2019, pp. 18849–18853, DOI:10.1002/anie.201910336. URL consultato il 27 maggio 2024.
- ^ a b Jonathan Clayden, Nick Greeves e Stuart G. Warren, Organic chemistry, 2nd ed, Oxford University Press, 2012, pp. 980-981, ISBN 978-0-19-927029-3.
- ^ (EN) Alwyn G. Davies e Anthony G. Neville, Electron paramagnetic resonance spectra of aliphatic ketyl radical anions in fluid solution, in Journal of the Chemical Society, Perkin Transactions 2, n. 2, 1º gennaio 1992, pp. 163–169, DOI:10.1039/P29920000163. URL consultato il 27 maggio 2024.
- ^ (DE) Otto-Albrecht Neumüller (a cura di), Römpps Chemie-Lexikon, collana Römpps Chemie-Lexikon / Otto-Albrecht Neumüller, vol. 3, 8ª ed., Stuttgart, Franckh'sche Verlagshandlung, 1983, p. 2104, ISBN 978-3-440-04513-8.
- ^ Eric V. Anslyn e Dennis A. Dougherty, Modern physical organic chemistry, University science, 2006, p. 921, ISBN 978-1-891389-31-3.
- ^ Eric V. Anslyn e Dennis A. Dougherty, Modern physical organic chemistry, University Science, 2006, p. 402, ISBN 978-1-891389-31-3.
- ^ SET: single electron transfer
- ^ Francis A. Carey e Richard J. Sundberg, Advanced organic chemistry, 5th ed, Springer, 2007, pp. 991-992, ISBN 978-0-387-44897-8.
- ^ Michael B. Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, Wiley, 2020, pp. 1133-1134, ISBN 978-1-119-37180-9.
- ^ (EN) Wiktor Kemula, Zbigniew Ryszard Grabowski e Marek Krzysztof Kalinowski, Electrochemical method of studying the reactions of free ketyl radicals, in Die Naturwissenschaften, vol. 47, n. 22, 1960, pp. 514–514, DOI:10.1007/BF00641119. URL consultato il 27 maggio 2024.
- ^ (EN) Gary P. Laroff e Richard W. Fessenden, Equilibrium and kinetics of the acid dissociation of several hydroxyalkyl radicals, in The Journal of Physical Chemistry, vol. 77, n. 10, 1973-05, pp. 1283–1288, DOI:10.1021/j100629a021. URL consultato il 27 maggio 2024.