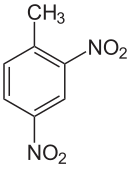
2,4-Dinitrotoluene
| 2,4-Dinitrotoluene | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 1-metil-2,4-dinitro benzene | |
| Abbreviazioni | |
| 2,4-DNT | |
| Nomi alternativi | |
| dinitrotoluolo | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C7H6N2O4 |
| Massa molecolare (u) | 182,134 |
| Aspetto | Solido cristallino giallo pallido |
| Numero CAS | |
| Numero EINECS | 204-450-0 |
| PubChem | 8461 |
| SMILES | CC1=C(C=C(C=C1)[N+](=O)[O-])[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 1520 |
| Solubilità in acqua | 270 mg/L a 22 °C |
| Coefficiente di ripartizione 1-ottanolo/acqua | 2,0 |
| Temperatura di fusione | 54-71°C |
| Temperatura di ebollizione | si decompone a 300 °C |
| Tensione di vapore (Pa) a 20 K | 2,4 |
| Viscosità dinamica (mPa·s a 69,5°C °C) | 3,4553 |
| Dati farmacocinetici | |
| Emivita | 6 ore |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | LD50 orale (ratto): tra 177 e 650 mg/kg
LD50 orale (topo): tra 390 e1.954 mg/kg |
| Indicazioni di sicurezza | |
| Punto di fiamma | 207°C |
| Temperatura di autoignizione | 400°C |
| TLV (ppm) | 0.2 mg/m3 |
| Simboli di rischio chimico | |
| Frasi R | 45-23/24/25-48/22-62-68-51/53 |
| Frasi S | 53-45-61 |
Il 2,4-dinitrotoluene è un composto chimico organico di formula C7H6N2O4 che in condizioni normali si presenta come un solido cristallino di colore giallo pallido con un leggero odore caratteristico.[1]
Caratteristiche strutturali e fisiche[modifica | modifica wikitesto]
La massa monoisotopica del 2,4-dinitrooluene è pari a 182,03275668 Da. Contiene 13 atomi pesanti e la sua area superficiale accessibile è pari a 91,6Ų.[1] Se riscaldato emana fumi e gas irritanti o tossici. Particelle finemente disperse possono formare miscele esplosive. Esiste il rischio di esplosione a contatto con diverse sostanze.[2]
I cristalli sono aghiformi o in un sistema monoclino.[1] Il 2,4-DNT è un composto fotocromatico[3] e il suo indice di rifrazione è pari a 1.442.[4]
Se rilasciato nell'aria ad una temperatura di 22°C, il valore della tensione di vapore (1,47x10-4 mmHg) indica che il 2,4-DNT sarà presente come vapore. Nel caso la temperatura scenda a 15 °C la tensione di vapore raggiunge il valore di 6x10-5 mmHg e dunque il composto sarà presente sia sotto forma di vapore che come particolato.[1]
Sintesi del composto[modifica | modifica wikitesto]
Il composto viene sintetizzato in due modi:[5][6]
- denitrazione del toluene da cui si ottiene un 75% di 2,4-DNT per peso
- nitrazione del 4-nitrotoluene in condizioni controllate da cui si ottiene un 96% di 2,4-DNT
Reattività e caratteristiche chimiche[modifica | modifica wikitesto]
Il composto risulta scarsamente solubile e più denso dell'acqua,[1][2] ovvero incompatibile con agenti ossidanti, agenti riducenti e basi forti.[7] Durante la combustione produce ossidi tossici di azoto.[1] Il composto è inoltre solubile in etanolo (30.46 g/L a 15 °C), cloroformio, benzene, solfuro di carbonio (21.9 g/L a 17 °C) ed etere dietilico (94 g/L a 22 °C), ovvero moto solubile in acetone e piridina.[1][8]
Biochimica[modifica | modifica wikitesto]
Assorbimento, distribuzione ed escrezione[modifica | modifica wikitesto]
Nei ratti, a seguito di una singola somministrazione orale di 3H 2,4-DNT la radioattività del sangue ha raggiunto i livelli massimi dopo 6 ore dalla somministrazione con un'emivita di circa 22 ore. I massimi livelli epatici si sono raggiunti dopo 6 ore con circa il 10% del composto escreto nella bile entro 24 ore. L'escrezione a livello fecale avviene dopo circa 6-9 ore e con le urine massimo dopo 6 ore.[9] Uno studio dimostra che l'assorbimento in contesti industriali è significativo.[10]
Metabolismo[modifica | modifica wikitesto]
Studi mediante cromatografia su strato sottile hanno dimostrato la presenza di nove metaboliti del 2,4-DNT nell'urina dei ratti dopo somministrazione orale: 2-ammino-4-nitrotoluene, 4-ammino-2-nitrotoluene, 2,4-diamminotoluene, 2,4-dinitrobenzil alcoli, 2-ammino-4-nitrobezil alcoli, 4-ammino-2-nitrobenzil alcoli, 2-nitro-4-acetilamminotoluene, 2-ammino-4-acetilamminotoluene e acido 2-ammino-4-acetilamminobenzoico.[11]
Studi sugli effetti del 2,4-DNT sull'attività di alcuni enzimi per il metabolismo epatico di xenobiotici nei ratti dimostrano che il composto ha pochi effetti e viene facilmente metabolizzato. Studi in vitro sulle vie metaboliche del 2,4-DNT dimostrano che queste sono dipendenti dagli scambi gassosi e determinano principalmente la produzione di metaboliti polari che non si legano alle macromolecole microsomiali.[12]
Si crede che la bioattivazione del DNT avvenga mediante il seguente processo:[1]
- il gruppo metilico viene ossidato ad alcol attraverso la via metabolica che dipende dal citocromo P450
- l'alcol benzilico viene coniugato con l'acido glucoronico e secreto nella bile
- la microflora intestinale idrolizza il glucuronide e riduce il gruppo 1-nitro formando l'alcol amminonitrobenzilico che viene riassrobito dall'intestino
- il gruppo amminico viene ossidato a idrossilammina dagli enzimi epatici e coniugato con il solfato
- la decomposizione dell'estere di solfato produce uno ione nitronio o carbonio altamente elettrofilo che reagisce con il DNA e altri nucleofili
Sono inoltre stati condotti studi al fine di analizzare le vie metaboliche del 2,4-DNT nella microflora fecale dei ratti che hanno messo in evidenza come il composto non venga metabolizzato in presenza di ossigeno. Tuttavia in condizioni anaerobiche, il 2,4-DNT viene ridotto a 2-ammino-4-nitrotoluene e 4-ammino-2-nitrotoluene passando attraverso il 2-idrossilammino-4-nitrotoluene e il 4-idrossilammino-2-nitrotoluene che vengono a loro volta completamente ridotti in 2,4-diamminotoluene.[13]
Studi sui ratti dimostrano che il 2,6-DNT è l'isomero che più si lega covalentemente all'RNA, al DNA e alle proteine epatiche, 5 volte di più del 2,4-DNT, dopo somministrazione orale.[14]
Studi sull'E.coli dimostrano che questo organismo è in grado di ridurre 5 isomeri del DNT (2,3-, 2,4-, 2,5-, 2,6- e 3,4-DNT) in monoamminonitrotolueni attraverso idrossilamminonitrotolueni.[15]
L'analisi dell'urina idrolizzata di lavoratori esposti a 2,4 e 2,6-DNT dimostrano che i metaboliti di questi due composti sono presenti in quantità variabili tra il 79% e il 93%.[16]
Effetto del composto sugli organismi viventi[modifica | modifica wikitesto]
La sostanza può avere effetti a livello ematico arrivando alla comparsa di cianosi dovuta all'ossidazione del ferro(II) a ferro(III). Quando i livelli di metaemoglobina nel sangue superano il 15% non vi sono sintomi, se i livelli superano il 40% si ha la comparsa di affaticamento e vertigini, mentre se si supera il 70% si presentano atassia, dispnea, tachicardia, nausea, vomito e sonnolenza.[2][17]
L'esposizione a varie concentrazioni del composto può inoltre causare: irritazione delle mucose, mal di testa, atralgia, insonnia, tremori, paralisi, perdita dei sensi, anemia, dolori al torace, fiato corto, palpitazioni, anoressia, perdita di peso.[18][19][20]
Tossicologia[modifica | modifica wikitesto]
La sostanza può essere assorbita dall'organismo per inalazione, attraverso la cute e per ingestione. L'esposizione al composto avviene principalmente nei luoghi di lavoro.[1] Non esistono dati sulla tossicità acuta del composto negli esseri umani.[21] Test su animali indicano la possibilità che questa sostanza possa essere teratogena. Questa sostanza è un possibile cancerogeno per l'uomo.[2] Studi sui lavoratori esposti al 2,4-DNT evidenziano un aumento del rischio di morte per malattie ischemiche cardiache.[22] I soggetti affetti da malattie cardiache ed epatiche sono a maggior rischio.[10]
Genotossicità[modifica | modifica wikitesto]
Sono stati condotti studi sulla genotossicità dei 6 isomeri del composto su Salmonella typhimurium. Gli studi sono stati fatti utilizzando il test di Ames impiegando miscele e isomeri singoli. Il 3,5-DNT si è dimostrato l'isomero più efficace nell'invertire la fototrofia dell'istidina nei ceppi TA98 e TA1538 di S. typhimurium. Il 3,5-DNT è risultato inoltre essere l'agente mutageno principale tra quelli esaminati.[23]
Test alternativi e in vitro[modifica | modifica wikitesto]
È stato condotto uno studio per lo studio delle risposte cellulari e molecolari di cellule del carcinoma epatico a seguito di esposizione al 2,4-DNT e 2,6-DNT con la valutazione della citotossicità mediante l'utilizzo di saggi MTT. L'LC50 dopo 48 ore dall'esposizione è risultato pari a 245 +/- 14.724 ug/mL per il 2,6-DNT e 300 +/- 5.92 ug/mL per il 2,4-DNT. Tali valori indicano che entrambi i composti sono moderatamente tossici. È stato inoltre possibile evidenziare un rapporto dose/risposta per quanto riguarda la citotossicità di entrambi gli isomeri.[24]
Misure di protezione[modifica | modifica wikitesto]
Si consiglia di:[2]
- evitare l'esposizione a fiamme libere
- evitare che si depositino polveri
- utilizzare l'aspirazione localizzata o dispositivi di protezione delle vie respiratorie
- utilizzare guanti e vestiario protettivi
- indossare occhiali protettivi a mascherina
- indossare tute di protezione da composti chimici munita di autorespiratore
- conservare in luogo ben ventilato
- conservare in contenitori ben chiusi
- conservare lontano da basi forti, alimenti e mangimi, ossidanti e agenti fortemente riducenti
- in caso d'incendio usare getti d'acqua, polvere, schiuma o biossido di carbonio
- in caso d'incendio mantenere i contenitori freddi
- combattere il fuoco da una posizione protetta
A seconda del grado di esposizione si consigliano esami clinici periodici.[2]
Trattamento medico[modifica | modifica wikitesto]
In caso d'ingestione si sconsiglia l'emesi per la possibile depressione del sistema nervoso centrale. Il lavaggio gastrico e la somministrazione di carbone attivo possono essere efficaci subito dopo l'ingestione e solo in sé si proteggono le vie aeree.[25]
La metaemoglobinemia può essere trattata con blu di metilene in pazienti sintomatici, livelli di metaemoglobina tra il 20-30% o inferiori in pazienti affetti da anemia, problemi respiratori e cardiaci. Qualora non si possa somministrare il blu di metilene e in pazienti refrattari si può pensare di fare delle trasfusioni.[25]
Misure di primo soccorso includono:[26]
- decontaminazione
- ventilazione artificiale
- rianimazione cardiopolmonare
- sciacquare gli occhi sotto acqua corrente
- sciacquare la bocca e somministrare da 5 mL/kg a 200 mL di acqua
- mantenere il paziente calmo
- mantenere stabile la temperatura del paziente
Nei casi più gravi si può dover ricorrere all'intubazione qualora il paziente sia incosciente, presenti edema polmonare o sia in sofferenza respiratoria. Si dovrà monitorare il ritmo cardiaco e trattare l'eventuale aritmia. Si può somministrare flebo di destrosio/acqua. In presenza di sintomi di ipovolemimici si può usare soluzione salina allo 0,9% o Ringer lattato.[26]
Interazioni[modifica | modifica wikitesto]
L'assunzione di alcool può avere effetti sinergici con la tossicità del 2,4-DNT.[17]
Effetti sull'ambiente[modifica | modifica wikitesto]
È possibile il rilascio nell'ambiente attraverso gli scarichi liquidi industriali.[27] È stato calcolato un fattore di bioconcentrazione negli organismi acquatici contenenti il 7,6% di lipidi pari a 3,8 che rende la sostanza nociva per gli organismi acquatici.[2][17]
Atmosfera[modifica | modifica wikitesto]
Il 2,4-DNT in fase di vapore è stato identificato nel particolato atmosferico. In fase di vapore viene degradato in atmosfera mediante reazioni fotochimiche che producono radicali idrossilici con un'emivita stimata di 75 giorni. Sotto forma di particolato, il 2,4-DNT viene rimosso dall'atmosfera per deposizione secca o umida.[1] Il composto risulta inoltre suscettibile a fotolisi diretta della luce. La caratteristica fotocromatica del 2,4-DNT fa presupporre che in presenza di luce solare il composto riduca il gruppo nitrilico a gruppo idrossi-amminico, nitroso o amminico con concomitante ossidazione del gruppo metilico a gruppo alcolico, aldeidico o carbossilico.[3]
Suolo[modifica | modifica wikitesto]
Il 2,4-DNT può subire fotolisi diretta sia sulla superficie del suolo che dell'acqua. Sulla base della costante della legge di Henry pari a 5,4x10-8 atm-cu m/mole a 25 °C, non ci si aspetta la vaporizzazione a livello del suolo. In acqua il 2,4-DNT viene assorbito dai solidi sospesi e dai sedimenti. Vari studi dimostrano che la biodegradazione del 2,4-DNT avviene principalmente nel suolo e in acqua.[1]
Uno studio dimostra che, in condizioni aerobiche, il 2,4-DNT viene degradato per l'80%, di cui:[1]
- il 22% viene trasformato in 4-ammino-2-nitrotoluene
- il 6% viene trasformato in 2-ammino-4-nitrotoluene
- il 28% viene mineralizzato in anidride carbonica entro 28 giorni
Se rilasciato nel suolo la mobilità del 2,4-DNT dipenderà dalla composizione del suolo (Koc 57 - 2.000). In suoli argillosi contenti una frazione organica pari a 8,5 g/kg, il 2,4-DNT ha Kd variabili tra 0,28 e 1,11 cu cm/g che corrisponde a un Koc compreso tra 57 e 225.[28]
Acqua[modifica | modifica wikitesto]
Uno studio dimostra che, in condizioni aerobiche, microrganismi naturalmente presenti sulla superficie dell'acqua sono in grado di utilizzare 10 ppm di 2,4-DNT come sola fonte di carbonio.[29]
Studi dimostrano inoltre che il composto può raggiungere la falda freatica.[1] Il 2,4-DNT è stato inoltre rilevato anche nell'acqua potabile[30], in acque superficiali[31] e nelle acque reflue industriali.[32]
Animali[modifica | modifica wikitesto]
Uno studio ha determinato la presenza di 2,4-DNT in uova di uccelli nella regione del lago Baikal in Russia, in particolare nelle uova di Anas platyrhynchos, Anas acuta, Anas clypeata, Aythya fuligula, Aythya ferina, Anser anser, Gallus gallus, Ardea cinerea, Larus argentatus, Larus canus, Sterna hirundo, Larus ridibundus, Vanellus vanellus, Podiceps auritus e Tringa stagnatilis.[33]
Degradazione batterica[modifica | modifica wikitesto]
Uno studio è stato in grado di identificare due geni presenti in una regione di 27 kb del ceppo batterico Burkholderia cepacia R34 che regolano il metabolismo del 2,4-DNT. I geni che codificano gli enzimi per il lower pathway metabolico si trovano a valle del gene dntD che codifica l'enzima responsabile per l'apertura dell'anello aromatico dell'estradiolo. Nella stessa regione si trovano i geni che codificano la metilmalonato-semialdeide deidrogenasi CoA-dipendente (dntE), la NADH-dipendente deidrogenasi putativa (ORF13) e un enzima bifunzionale isomerasi/idrolasi (dntG). Questi geni formano un operone.[34]
Sono inoltre stati identificati altri geni che codificano:[34]
- 2,4-DNT diossigenasi (dntAaAbAcAd)
- mononitrocatechil monoossigenasi (dntB)
- regolatore trascrizionale di tipo Lys putativo (ORF12)
- enzima per l'apertura dell'anello dell'intradiolo (ORF3)
- maleilacetato reduttasi (ORF10)
- complesso completo di trasportatori ABC (da ORF5 a ORF8)
- proteina recettore putativa per la chemiotassi che accetta il metile - MCP (ORF11)
Sono inoltre presenti tracce di trasposoni e geni vestigiali che indicherebbero come le vie metaboliche del 2,4-DNT si siano evolute solo recentemente.[34] La via metabolica per la degradazione del 2,4-DNT in B. cepacia coinvolge le seguenti reazioni:[35]
- (in presenza di ossigeno)
- (in presenza di ossigeno)
Smaltimento[modifica | modifica wikitesto]
Le acque reflue contenenti il composto devono essere contenute e valutate per stabilire la concentrazione della sostanza che deve essere inferiore ai limiti di legge. Particolari autorizzazioni possono essere rilasciate dal governo americano sulla base dell'EPA 40 CFR Parte 261.[36] Il composto è un candidato per lo smaltimento mediante incenerimento in forno rotativo a 820-1600 °C e mediante combustore a letto fluido a temperature comprese tra 450 e 980 °C.[37]
Trattamenti delle acque reflue adatti per questo composto sono:[38][38][38]
- trattamento biologico
- estrazione con solvente
- trattamento con carbone attivo
Applicazioni[modifica | modifica wikitesto]
2,4-DNT è utilizzato:[21][27][39][40][41][42][43]
- modificatore per polveri senza fumo e nella nitrazione del TNT nell'industria degli esplosivi, ovvero, in minima parte, come agente gelatinizzante e impermeabilizzante in composti esplosivi per usi militari e commerciali
- nella produzione di propellenti
- intermedio nella produzione di di-isocianati del toluene e schiume poliuretaniche
- reagente nella sintesi organica delle toluidine
- nella produzione di rivestimenti
- nella produzione di elastomeri
- nella produzione di plastiche
- nella produzione di coloranti
Classificazione[modifica | modifica wikitesto]
Il composto è così classificato:[2][44]
- UN Classe di rischio: 6.1
- UN Gruppo di imballaggio: II
- Carcinogeno di cat. 2
- potenzialmente mutageno
- potenzialmente teratogeno
Altri identificativi[modifica | modifica wikitesto]
Il composto viene anche identificato:[1]
- UNII: 6741D310ED
- ILO: 3454
- ChEBI:920
- CHEMBL259865
- DTXSID0020529
- HMDB0245464
- ICSC: 0727
- KEGG: C11006
- J2.922J
Legislazione[modifica | modifica wikitesto]
La sostanza è regolamentata in base a:[1][44][45][46][47]
- Europa:
- Reg (CE) 1907/2006
- Reg (CE) 552/2009
- Reg (UE) 109/2012
- Reg (UE) 125/2012
- Reg (UE) 126/2013
- Reg (UE) 2017/1510
- Reg (UE) 2018/675
- Reg (UE) 2023/1132
- Direttiva 98/24/CE
- Direttiva 2004/37/CE
- Stati Uniti:
- CERCLA Reportable Quantities
- RCRA
- internazionali:
- risoluzioni IATA 618 e 619
- codice IMDG
Note[modifica | modifica wikitesto]
- ^ a b c d e f g h i j k l m n o (EN) PubChem, 2,4-Dinitrotoluene, su pubchem.ncbi.nlm.nih.gov. URL consultato il 1º giugno 2024.
- ^ a b c d e f g h ICSC 0465 - DINITROTOLUENE (MISCELA DI ISOMERI), su chemicalsafety.ilo.org. URL consultato il 1º giugno 2024.
- ^ a b ENVIRONMENTAL PROTECTION AGENCY WASHINGTON DC, Synopses of Federal Demonstrations of Innovative Site Remediation Technologies. Third Edition., Defense Technical Information Center, 1º ottobre 1993. URL consultato il 1º giugno 2024.
- ^ Rosa Sierra-Amor, CRC Handbook of Laboratory Safety, 5th ed. A. Keith Furr, ed. Boca Raton, FL: CRC Press LCC, 2000, 774 pp., $149.99. ISBN 0-8493-2523-4., in Clinical Chemistry, vol. 47, n. 11, 1º novembre 2001, pp. 2075–2075, DOI:10.1093/clinchem/47.11.2075a. URL consultato il 1º giugno 2024.
- ^ Markus Dugal, Nitrobenzene and Nitrotoluenes, in Kirk-Othmer Encyclopedia of Chemical Technology, 14 ottobre 2005, DOI:10.1002/0471238961.1409201801041109.a01.pub2. URL consultato il 1º giugno 2024.
- ^ Gerald Booth, Nitro Compounds, Aromatic, in Ullmann's Encyclopedia of Industrial Chemistry, 15 giugno 2000, DOI:10.1002/14356007.a17_411. URL consultato il 1º giugno 2024.
- ^ 2,4-Dinitrotoluene | C7H6N2O4 | ChemSpider, su chemspider.com. URL consultato il 1º giugno 2024.
- ^ George Charles Fonger, Pertti Hakkinen e Shannon Jordan, The National Library of Medicine’s (NLM) Hazardous Substances Data Bank (HSDB): Background, recent enhancements and future plans, in Toxicology, vol. 325, 2014-11, pp. 209–216, DOI:10.1016/j.tox.2014.09.003. URL consultato il 1º giugno 2024.
- ^ Masaaki Mori, Yoshifumi Naruse e Hiroshi Kozuka, Studies on the Metabolism and Toxicity of Dinitrotoluenes, in RADIOISOTOPES, vol. 27, n. 12, 1978, pp. 715–719, DOI:10.3769/radioisotopes.27.12_715. URL consultato il 1º giugno 2024.
- ^ a b Occupational health guidelines for chemical hazards., U.S. Department of Health and Human Services, Public Health Service, Centers for Disease Control, National Institute for Occupational Safety and Health, 1º gennaio 1981. URL consultato il 1º giugno 2024.
- ^ (EN) Masaaki Mori, Yoshifumi Naruse e Hiroshi Kozuka, Identification of urinary metabolites of 2,4-dinitrotoluene (2,4-DNT) in rats., in Chemical and Pharmaceutical Bulletin, vol. 29, n. 4, 1981, pp. 1147–1150, DOI:10.1248/cpb.29.1147. URL consultato il 1º giugno 2024.
- ^ (EN) G Decad, Hepatic microsomal metabolism and covalent binding of 2,4-dinitrotoluene, in Toxicology and Applied Pharmacology, vol. 62, n. 2, 1982-02, pp. 325–334, DOI:10.1016/0041-008X(82)90131-4. URL consultato il 1º giugno 2024.
- ^ (EN) Masaaki Mori, Tatsuro Miyahara e Kiyomi Motoo, Mutagenicity of urinary metabolites of 2,4-dinitrotoluene to Salmonella typhimurium., in Chemical and Pharmaceutical Bulletin, vol. 33, n. 10, 1985, pp. 4556–4563, DOI:10.1248/cpb.33.4556. URL consultato il 1º giugno 2024.
- ^ (EN) Douglas E. Rickert, Stephanie R. Schnell e Rochelle M. Long, Hepatic macromolecular covalent binding and intestinal disposition of [ 14 C]dinitrotoluenes, in Journal of Toxicology and Environmental Health, vol. 11, n. 4-6, 1983-04, pp. 555–567, DOI:10.1080/15287398309530367. URL consultato il 1º giugno 2024.
- ^ (EN) Masa-Aki Mori, Tatsuro Miyahara e Yukiyo Hasegawa, Metabolism of dinitrotoluene isomers by Escherichia coli isolated from human intestine., in Chemical and Pharmaceutical Bulletin, vol. 32, n. 10, 1984, pp. 4070–4075, DOI:10.1248/cpb.32.4070. URL consultato il 1º giugno 2024.
- ^ Clinical Immunology and Immunotherapy, Herald Scholarly Open Access. URL consultato il 1º giugno 2024.
- ^ a b c Elizabeth L. Etnier, Water Quality Criteria for 2,4-Dinitrotoluene and 2,6-Dinitrotoluene, Defense Technical Information Center, 1º agosto 1987. URL consultato il 1º giugno 2024.
- ^ (EN) PubChem, Hazardous Substances Data Bank (HSDB) : 1144, su pubchem.ncbi.nlm.nih.gov. URL consultato il 1º giugno 2024.
- ^ Lemuel C. McGee, Alexander McCausland e C. A. Plume, Metabolic disturbances in workers exposed to dinitrotoluene, in American Journal of Digestive Diseases, vol. 9, n. 10, 1942-10, pp. 329–332, DOI:10.1007/bf02998020. URL consultato il 1º giugno 2024.
- ^ James P. Kehrer, Hazardous materials toxicology, clinical principles of environmental health, in Toxicology Letters, vol. 61, n. 2-3, 1992-07, pp. 319–320, DOI:10.1016/0378-4274(92)90160-l. URL consultato il 1º giugno 2024.
- ^ a b EPA, 2,4-Dinitrotoluene (PDF). URL consultato il 1º giugno 2024.
- ^ Thomas G Rosano, Ellenhorn’s Medical Toxicology: Diagnosis and Treatment of Human Poisoning, 2nd ed. Matthew J. Ellenhorn, Seth Schonwald, Gary Ordog, and Jonathan Wasserberger. Baltimore, MD: Williams and Wilkins, 1997, 2047 pp., $199, ISBN 0-683-30031–8., in Clinical Chemistry, vol. 44, n. 2, 1º febbraio 1998, pp. 366–366, DOI:10.1093/clinchem/44.2.366. URL consultato il 1º giugno 2024.
- ^ (EN) David B. Couch, Paula F. Allen e Diane J. Abernethy, The mutagenicity of dinitrotoluenes in Salmonella typhimurium, in Mutation Research/Genetic Toxicology, vol. 90, n. 4, 1981-12, pp. 373–383, DOI:10.1016/0165-1218(81)90060-4. URL consultato il 1º giugno 2024.
- ^ (EN) Konsuela Glass, Cecilia Newsome e Paul Tchounwou, Cytotoxicity and Expression of c-fos, HSP70, and GADD45/153 Proteins in Human Liver Carcinoma (HepG2) Cells Exposed to Dinitrotoluenes, in International Journal of Environmental Research and Public Health, vol. 2, n. 2, 14 agosto 2005, pp. 355–361, DOI:10.3390/ijerph2005020022. URL consultato il 1º giugno 2024.
- ^ a b P. Axelrod e G. P. Wormser, Hospital Epidemiology and Infection Control, Third Edition Edited by C. Glen Mayhall Philadelphia, PA: Lippincott Williams & Wilkins, 2004 1600 pp., illustrated. $189.95 (cloth), in Clinical Infectious Diseases, vol. 41, n. 1, 1º luglio 2005, pp. 133–134, DOI:10.1086/430718. URL consultato il 1º giugno 2024.
- ^ a b Garik Misenar, A Review of: “The Field Guide to Wilderness Medicine”, in Prehospital Emergency Care, vol. 9, n. 3, 2005-01, pp. 368–369, DOI:10.1080/10903120500336295. URL consultato il 1º giugno 2024.
- ^ a b Hawley's Condensed Chemical Dictionary, 15th ed By Richard J. Lewis, Sr. John Wiley & Sons, Inc.: Hoboken, NJ. 2007. x + 1380 pp. $150.00. ISBN 978-0-471-76865-4., in Journal of the American Chemical Society, vol. 129, n. 16, 20 marzo 2007, pp. 5296–5296, DOI:10.1021/ja0769144. URL consultato il 1º giugno 2024.
- ^ Katerina M. Dontsova, Judith C. Pennington e Charolett Hayes, Dissolution and transport of 2,4-DNT and 2,6-DNT from M1 propellant in soil, in Chemosphere, vol. 77, n. 4, 2009-10, pp. 597–603, DOI:10.1016/j.chemosphere.2009.05.039. URL consultato il 1º giugno 2024.
- ^ Ronald J. Spanggord, William R. Mabey e Theodore Mill, Environmental Fate Studies on Certain Munition Wastewater Constituents. Phase 3, Part 2. Laboratory Studies, Defense Technical Information Center, 1º settembre 1981. URL consultato il 1º giugno 2024.
- ^ DCK Lin, RL Foltz e SV Lucas, Glass Capillary Gas Chromatographic-Mass Spectrometric Analysis of Organics in Drinking Water Concentrates and Advanced Waste Treatment Water Concentrates-II, ASTM International100 Barr Harbor Drive, PO Box C700, West Conshohocken, PA 19428-2959, 1º gennaio 1979, pp. 68–84, ISBN 0-8031-0508-8. URL consultato il 1º giugno 2024.
- ^ Draft 2020 Canada-Ontario Agreement on Great Lakes Water Quality and Ecosystem Health (ERO Number: 019-0198), su Climate Change and Law Collection. URL consultato il 1º giugno 2024.
- ^ Environmental Restoration Program waste minimization and pollution prevention self-assessment, Office of Scientific and Technical Information (OSTI), 1º ottobre 1994. URL consultato il 1º giugno 2024.
- ^ A LEBEDEV, O POLIAKOVA e N KARAKHANOVA, The contamination of birds with organic pollutants in the Lake Baikal region, in The Science of The Total Environment, vol. 212, n. 2-3, 8 aprile 1998, pp. 153–162, DOI:10.1016/s0048-9697(97)00338-0. URL consultato il 1º giugno 2024.
- ^ a b c (EN) Glenn R. Johnson, Rakesh K. Jain e Jim C. Spain, Origins of the 2,4-Dinitrotoluene Pathway, in Journal of Bacteriology, vol. 184, n. 15, 2002-08, pp. 4219–4232, DOI:10.1128/JB.184.15.4219-4232.2002. URL consultato il 2 giugno 2024.
- ^ R J Spanggord, J C Spain e S F Nishino, Biodegradation of 2,4-dinitrotoluene by a Pseudomonas sp, in Applied and Environmental Microbiology, vol. 57, n. 11, 1991-11, pp. 3200–3205, DOI:10.1128/aem.57.11.3200-3205.1991. URL consultato il 2 giugno 2024.
- ^ Federal Register :: Request Access, su unblock.federalregister.gov. URL consultato il 1º giugno 2024.
- ^ (EN) Robert W. Ross, Frank C. Whitmore e Richard A. Carnes, Evaluation of the USEPA CRF Incinerator as Determined by Hexachlorobenzene Incineration, in Hazardous Waste, vol. 1, n. 4, 1984-01, pp. 581–591, DOI:10.1089/hzw.1984.1.581. URL consultato il 1º giugno 2024.
- ^ a b c (EN) Book Review: REQUIREMENTS FOR HAZARDOUS WASTE LANDFILL DESIGN, CONSTRUCTION, AND CLOSURE. By Eastern Research Group, Inc. EPA Publication EPA/625/4-89/022. pp. 133. Available from CERI, USEPA, Cincinnati, Ohio 45268, U.S.A. Reviewed by Robert Landreth, EPA Cincinnati, in Waste Management & Research: The Journal for a Sustainable Circular Economy, vol. 8, n. 1, 1990-01, pp. 316–317, DOI:10.1177/0734242X9000800152. URL consultato il 1º giugno 2024.
- ^ (EN) National Toxicology Program, su ntp.niehs.nih.gov. URL consultato il 1º giugno 2024.
- ^ Allan R. Isensee, Handbook of Environmental Data on Organic Chemicals, Second Edition, in Journal of Environmental Quality, vol. 13, n. 2, 1984-04, pp. 330–330, DOI:10.2134/jeq1984.00472425001300020034x. URL consultato il 1º giugno 2024.
- ^ (EN) R.A. Young, Dinitrotoluene, Elsevier, 2014, pp. 179–182, DOI:10.1016/b978-0-12-386454-3.00671-0), ISBN 978-0-12-386455-0. URL consultato il 2 giugno 2024.
- ^ (EN) Barbara Saunders-Price e Laura E. Peitersen, Military toxicology, Elsevier, 2024, pp. 405–412, DOI:10.1016/b978-0-12-824315-2.00837-x), ISBN 978-0-323-85434-4. URL consultato il 2 giugno 2024.
- ^ (EN) EPA, [https://www.epa.gov/sites/default/files/2015-05/documents/9530566.pdf Technical Fact Sheet�Dinitrotoluene (DNT)] (PDF), Dicembre 2012. URL consultato il 2 giugno 2024.
- ^ a b Substance Information - ECHA, su echa.europa.eu. URL consultato il 1º giugno 2024.
- ^ 2,4-dinitrotoluene | sostanze nocive, su bancasostanze.mase.gov.it. URL consultato il 1º giugno 2024.
- ^ The United States Code of Federal Regulations 21 CFR, Part 11, Electronic Records/Electronic Signatures, CRC Press, 30 dicembre 2004, pp. 1–5, ISBN 978-0-8493-1847-4. URL consultato il 1º giugno 2024.
- ^ D.B. Inglis, The International Maritime Dangerous Goods (Imdg) Code, Routledge, 21 febbraio 2024, pp. 83–107, ISBN 978-1-003-47626-9. URL consultato il 1º giugno 2024.
Bibliografia[modifica | modifica wikitesto]
- Leonard TB, Graichen ME, Popp JA. Dinitrotoluene isomer-specific hepatocarcinogenesis in F344 rats. J Natl Cancer Inst. 1987 Dec;79(6):1313-9. PMID 3480382.
- Dugal M; Kirk-Othmer Encyclopedia of Chemical Technology. (1999-2012). New York, NY: John Wiley & Sons; Nitrobenzenes and Nitrotoluenes. Online Posting Date: Oct 14, 2005
- Akkaya Ö, Nikel PI, Pérez-Pantoja D, de Lorenzo V. Evolving metabolism of 2,4-dinitrotoluene triggers SOS-independent diversification of host cells. Environ Microbiol. 2019 Jan;21(1):314-326. doi: 10.1111/1462-2920.14459. Epub 2018 Dec 3. PMID 30362300.
- Swann RL et al; Res Rev 85: 17-28 (1983) (2) Dontsova KM et al; Chemosphere 77: 597-603 (2009)
- American Conference of Governmental Industrial Hygienists; 2011 Threshold Limit Values for Chemical Substances and Physical Agents and Biological Exposure Indices. Cincinnati, OH 2011, p. 27
- Rickett DE et al; CRC Crit Rev Toxicol 13 (3): 217-34 (1984). A review with 86 references on toxicity, mutagenicity, carcinogenicity, and metabolism of 2,3-, 2,4-, 2,5-, 2,6-, 3,4-, and 3,5-dinitrotoluene in man and lab animals.
- Zhang D et al; Environ Toxicol Chem 28: 1447-1454 (2009)
- Fortner JD et al; Environ Sci Technol 37: 3382-3391 (2003)
- Spalding RF, Fulton JW; J Contam Hydroxyl 2: 139-53 (1988)
- Johnson GR, Jain RK, Spain JC. Origins of the 2,4-dinitrotoluene pathway. J Bacteriol. 2002 Aug;184(15):4219-32. doi: 10.1128/JB.184.15.4219-4232.2002. Erratum in: J Bacteriol 2002 Nov;184(21):6084. PMID 12107140; PMCID: PMC135200.
- Best EPH et al; Chemosphere 38: 3393-96 (1999)
- Altschuh J et al; Chemosphere 39: 1871-87 (1999)
- Layton D et al; Conventional Weapons Demilitarization: A Health and Environmental Effects Data Base Assessment. Phase 2. Explosives and Their Co-contaminants; Lawrence Livermore National Lab, CA. Environmental Sciences Div; NTIS/AD-A220 588/8, 427 p.
- Pella PA; J Chem Thermodyn 9: 301-5 (1977)
- Simmons MS, Zepp RH; Watt Res 20: 899-904 (1986)
- Patrick C. Cirino, Shuai Qian, Chapter 2 - Protein Engineering as an Enabling Tool for Synthetic Biology, Editor(s): Huimin Zhao, Synthetic Biology, Academic Press, 2013, Pages 23-42, ISBN 9780123944306, https://doi.org/10.1016/B978-0-12-394430-6.00002-9
- Tabak HH et al; J Water Pollut Cont Fed 53: 1503-18 (1981)
- T. Tamiri, S. Zitrin, Explosives: Analysis, Editor(s): Jay A. Siegel, Pekka J. Saukko, Max M. Houck, Encyclopedia of Forensic Sciences (Second Edition), Academic Press, 2013, Pages 64-84, ISBN 9780123821669, https://doi.org/10.1016/B978-0-12-382165-2.00083-0. (https://www.sciencedirect.com/science/article/pii/B9780123821652000830)
- Bradley PM et al; Ground Water 35: 12-17 (1997)
- Fortner JD et al; Environ Sci Technol 37: 3382-3391 (2003)
- Spanggord RJ et al; Environmental fate studies on certain munition wastewater constituents. Menlo Park, CA: SRI Int DAMD17-78-C-8081. NTIS AD-A133 987 (1981)
- Toze S, Zappia L; Water Res 33: 3040-3045 (1999)
- Bidleman TF; Environ Sci Technol 22: 361-367 (1988)
- Pella PA; J Chem Thermodyn 9:301-5 (1977)
- Edward J. Perkins, Natàlia Garcia-Reyero, Chapter 7 - Computational Translation of Nonmammalian Species Data to Mammalian Species to Meet REACH and Next Generation Risk Assessment Needs, Editor(s): Bruce A. Fowler, Computational Toxicology, Academic Press, 2013, Pages 113-136, ISBN 9780123964618, https://doi.org/10.1016/B978-0-12-396461-8.00009-9
- Rittfeldt L; Anal Chem 73: 2405-2411 (2001)
- Gao H et al; Bull Environ Contam Toxicol 72: 923-930 (2004)
- US EPA; Estimation Program Interface (EPI) Suite. Ver. 4.1. Jan, 2011. Available from, as of Feb 1, 2012: https://www.epa.gov/oppt/exposure/pubs/episuitedl.htm
- Mill T, Mabey W; in Environmental Exposure from Chemicals. Volume I. Neely WB, Blau GE, eds., Boca Raton, FL: CRC Press, p. 198 (1985)
- Chemicals Inspection and Testing Institute; Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Japan Chemical Industry Ecology - Toxicology and Information Center. Available from, as of Feb 1, 2012: https://www.safe.nite.go.jp/english/kizon/KIZON_start_hazkizon.html
- Franke C et al; Chemosphere 29: 1501-14 (1994) (5) Deneer JW et al; Aquatic Tox 10: 115-29 (1987)
- Montesano, R., H. Bartsch, E.Boyland, G. Della Porta, L. Fishbein, R. A. Griesemer, A.B. Swan, L. Tomatis, and W. Davis (eds.). Handling Chemical Carcinogens in the Laboratory: Problems of Safety. IARC Scientific Publications No. 33. Lyon, France: International Agency for Research on Cancer, 1979., p. 9
- National Fire Protection Association; Fire Protection Guide to Hazardous Materials. 14TH Edition, Quincy, MA 2010, p. 49-69
- B.B. Barnes, N.H. Snow, 3.44 - Recent Advances in Sample Preparation for Explosives, Editor(s): Janusz Pawliszyn, Comprehensive Sampling and Sample Preparation, Academic Press, 2012, Pages 893-926, ISBN 9780123813749, https://doi.org/10.1016/B978-0-12-381373-2.00119-8. (https://www.sciencedirect.com/science/article/pii/B9780123813732001198)
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file sul dinitrotoluene
Wikimedia Commons contiene immagini o altri file sul dinitrotoluene
Collegamenti esterni[modifica | modifica wikitesto]
| Controllo di autorità | NDL (EN, JA) 01116482 |
|---|
![{\displaystyle {\ce {2,4-DNT A ->[{dntAaAbAcAd}][{NADH}] 4-metil-5-nitrocresolo + NO2- + NAD+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/235bfcbe940bb75652234464f7ba1ab719d51065)
![{\displaystyle {\ce {4-metil-5-nitrocresolo A ->[{dntB}][{NADPH}] 2-idrossi-5-metilchinone + NO2- + NADP+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/6049e36b0d883a87cb05fa27aebbe1704e23582c)
![{\displaystyle {\ce {2-idrossi-5-metilchinonne ->[NADH] 2,4,5-triidrossitoluene + NAD+}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/3d92966cfd1afe14d0a14fbcf97a5d8c4a193c68)
![{\displaystyle {\ce {2,4,5-triidrossi toluene A ->[{dntD}][{O2}] 2,4-diidrossi-5-metil-6-oso-2,4-eicosadienoico acido}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f1beb18fe51cfc0c145bc1b01c7f44ad2f57b8d7)