Ossicloruro di fosforo
| Ossicloruro di fosforo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Ossido tricloruro di fosforo(V) | |
| Caratteristiche generali | |
| Formula bruta o molecolare | POCl3 |
| Massa molecolare (u) | 153,33 g/mol |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 233-046-7 |
| PubChem | 24813 |
| SMILES | O=P(Cl)(Cl)Cl |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,67 (20 °C) |
| Indice di rifrazione | 1,460 |
| Solubilità in acqua | (20 °C) (energica reazione) |
| Temperatura di fusione | 2 °C (275 K) |
| Temperatura di ebollizione | 105 °C (378 K) (1013 hPa) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | -568,4 |
| C0p,m(J·K−1mol−1) | 84,35 |
| Proprietà tossicologiche | |
| DL50 (mg/kg) | 36 mg/kg (topi) |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 302 - 330 - 314 - 372 - EUH014 - EUH029 |
| Consigli P | 280 - 301+330+331 - 304+340 - 305+351+338 - 308+310 [1] |


L'ossicloruro di fosforo (o cloruro di fosforile) è un ossicloruro; è un liquido incolore con formula POCl3. Si idrolizza in aria umida liberando acido fosforico e fumi di acido cloridrico. Viene prodotto industrialmente su larga scala da tricloruro di fosforo (PCl3) e ossigeno o anidride fosforica (P4O10)[3]. Viene utilizzato principalmente per produrre esteri fosforici come il trimetil fosfato [(CH3-O)3P=O], il più semplice,[4] o anche il fosfato di tricresile [(C7H7-O)3P=O].
Struttura
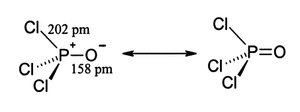
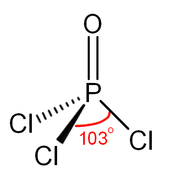
[modifica | modifica wikitesto]Come il fosfato, l'ossicloruro di fosforo ha una forma tetraedrica,[5] simmetria C3v. Presenta tre legami semplici P-Cl e un forte doppio legame P=O, quest'ultimo con un'energia di dissociazione di legame stimata di 533,5 kJ/mol. Sulla base della lunghezza del legame e dell'elettronegatività, la regola di Schomaker-Stevenson suggerisce che la forma del doppio legame è dominante, in contrasto con il caso del trifluoruro di fosforile (POF3). Il legame P=O comporta la donazione degli elettroni della coppia solitaria sugli orbitali dell'ossigeno alle combinazioni di antilegame associate ai legami fosforo-cloro, costituendo così il legame π[6].
L'ossicloruro di fosforo esiste come molecole POCl3 neutre negli stati solido, liquido e gassoso. Questo non accade nel pentacloruro di fosforo, altro composto clorurato di P(V), che esiste come molecole neutre PCl5 negli stati gassoso e liquido, ma adotta la forma ionica [PCl4]+[PCl6]− allo stato solido. Le lunghezze medie dei legami nella struttura cristallina dell'ossicloruro di fosforo, molto simile a quella ddell'analogo ossibromuro di fosforo (POBr3), sono 197,6 pm per P–Cl e 1,456 pm per P=O e l'angolo medio Cl-P-Cl è di 104,9°,[2] leggermente inferiore all'angolo tetraedrico (109,5°).
Proprietà fisiche
[modifica | modifica wikitesto]Con un punto di congelamento di 1 °C e un punto di ebollizione di 106 °C, l'intervallo liquido dell'ossicloruro di fosforo è piuttosto simile a quello dell'acqua. Anche come l'acqua, l'ossicloruro di fosforo si autoionizza, a causa della formazione reversibile di POCl2+ e Cl−.
Proprietà chimiche
[modifica | modifica wikitesto]L'ossicloruro di fosforo reagisce con l'acqua per dare acido cloridrico e acido fosforico:
Sono stati isolati intermedi nella conversione, compreso il cloruro di pirofosforile [O=P(Cl2)-O-(Cl2)P=O)][7].
Dopo il trattamento con alcoli o fenoli in eccesso, l'ossicloruro di fosforo fornisce i corrispondenti esteri fosforici:
Tali reazioni vengono spesso eseguite in presenza di una base che neutralizza l'acido cloridrico formato come la piridina o altra ammina terziaria.
L'ossicloruro di fosforo può anche fungere da base di Lewis, formando addotti con una varietà di acidi di Lewis come il tetracloruro di titanio (TiCl4):
L'addotto del cloruro di alluminio (POCl3·AlCl3) è abbastanza stabile, quindi l'ossicloruro di fosforo può essere utilizzato per rimuovere il cloruro di alluminio dalle miscele di reazione, ad esempio al termine di una reazione di Friedel-Crafts.
L'ossicloruro di fosforo reagisce con acido bromidrico in presenza di catalizzatori acidi di Lewis per produrre bromuro di fosforile (POBr3).
Preparazione
[modifica | modifica wikitesto]L'ossicloruro di fosforo può essere preparato con molti metodi; fu segnalato per la prima volta nel 1847 dal chimico francese Charles-Adolphe Wurtz facendo reagire il pentacloruro di fosforo con l'acqua[8][9].
Per ossidazione
[modifica | modifica wikitesto]Il metodo commerciale prevede l'ossidazione del tricloruro di fosforo con ossigeno:[10]
Un metodo alternativo prevede l'ossidazione del tricloruro di fosforo con clorato di potassio:[11]
Per ossigenazioni
[modifica | modifica wikitesto]Una reazione è quella del pentacloruro di fosforo (PCl5) con l'anidride fosforica (P4O10):
La reazione può essere semplificata clorurando una miscela di tricloruro di fosforo (PCl3) e anidride fosforica, generando il pentacloruro di fosforo in situ. La reazione è quella del pentacloruro di fosforo con acido borico (B(OH)3) o acido ossalico ((COOH)2):[11]
Altri metodi
[modifica | modifica wikitesto]Riduzione del fosfato di calcio (Ca3(PO4)2) con carbonio in presenza di cloro gassoso:[12]
Viene anche riportata la reazione dell'anidride fosforica con il cloruro di sodio:[12]
Usi
[modifica | modifica wikitesto]In un'applicazione commerciale, l'ossicloruro di fosforo viene utilizzato nella produzione di esteri fosfatici. I triarilfosfati come il trifenil fosfato e il fosfato di tricresile sono usati come ritardanti di fiamma e plastificanti per il PVC. I trialchilfosfati come il tributilfosfato sono usati come solventi di estrazione liquido-liquido nel riprocessamento nucleare e altrove[10].
Nell'industria dei semiconduttori, l'ossicloruro di fosforo viene utilizzato come fonte sicura di fosforo liquido nei processi di diffusione. Il fosforo agisce come drogante utilizzato per creare strati di tipo n su un wafer di silicio.[senza fonte]
Come reagente
[modifica | modifica wikitesto]In laboratorio, l'ossicloruro di fosforo è un reagente nelle disidratazioni. Un esempio riguarda la conversione di formammidi in isonitrili [13] e ammidi primarie in nitrili:[14]
In una reazione correlata, alcune ammidi aril-sostituite possono essere ciclizzate usando la reazione di Bischler-Napieralski.

Si ritiene che tali reazioni procedano attraverso un immidoil-cloruro. In alcuni casi, l'immidoil-cloruro è il prodotto finale. Ad esempio, piridoni e pirimidoni possono essere convertiti in cloroderivati come 2-cloropiridine e 2-cloropirimidine, che sono intermedi nell'industria farmaceutica[15].
Nella reazione di Vilsmeier-Haack, l'ossicloruro di fosforo reagisce con le ammidi per produrre un "reagente di Vilsmeier", un sale di cloro-imminio, che successivamente reagisce con composti aromatici ricchi di elettroni per produrre aldeidi aromatiche su processo acquoso[16].
Note
[modifica | modifica wikitesto]- ^ Scheda del composto su GESTIS [1] consultata il 29.08.2023.
- ^ a b (EN) K. Olie, The crystal structure of POCl3, in Acta Crystallographica, vol. 27, n. 7, 1971, pp. 1459–1460, DOI:10.1107/S0567740871004138.
- ^ (EN) Arthur D. F. Toy, The Chemistry of Phosphorus, Oxford, Pergamon Press, 1973, ISBN 978-00-80-18780-8.
- ^ D. E. C. Corbridge "Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology" 5th Edition Elsevier: Amsterdam 1995. ISBN 0-444-89307-5.
- ^ (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the Elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997.
- ^ (EN) D.B. Chesnut e A. Savin, The Electron Localization Function (ELF) Description of the PO Bond in Phosphine Oxide, in Journal of the American Chemical Society, vol. 121, n. 10, 1999, pp. 2335–2336, DOI:10.1021/ja984314m.
- ^ (DE) Grunze, Herbert, Über die Hydratationsprodukte des Phosphoroxychlorides. III. Darstellung von Pyrophosphorylchlorid aus partiell hydrolysiertem Phosphoroxychlorid, in Zeitschrift fuer Anorganische und Allgemeine Chemie, vol. 324, 1963, pp. 1–14, DOI:10.1002/zaac.19633240102.
- ^ (FR) Adolphe Wurtz, Sur l'acide sulfophosphorique et le chloroxyde de phosphore, in Annales de Chimie et de Physique, vol. 20, 1847, pp. 472–481.
- ^ (EN) Roscoe, Henry E., Schorlemmer, Carl e Cannell, John, A Treatise on Chemistry, vol. 1, 5ª ed., Londra, Macmillan & Co., 1920, p. 676.
- ^ a b (EN) Phosphorus Compounds, Inorganic, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2000, DOI:10.1002/14356007.a19_527.
- ^ a b (EN) Patnaik Pradyot, Handbook of Inorganic Chemicals, New York, McGraw-Hill, 2003, p. 709, ISBN 0070494398.
- ^ a b (EN) Leonid Lerner, Small-Scale Synthesis of Laboratory Reagents with Reaction Modeling, Boca Raton, CRC Press, 2011, pp. 169–177, ISBN 978-14-39-81312-6.
- ^ (EN) Pravin Patil, Maryam Ahmadian-Moghaddam e Alexander Dömling, Isocyanide 2.0, in Green Chemistry, vol. 22, n. 20, 29 settembre 2020, pp. 6902–6911, DOI:10.1039/D0GC02722G.
- ^ (EN) J. March, Advanced Organic Chemistry, 4ª ed., New York, Wiley, 1992, p. 723, ISBN 978-04-71-60180-7.
- ^ (EN) R.C. Elderfield, Heterocyclic Compound, vol. 6, New York, John Wiley & Sons, 1950, p. 265.
- ^ (EN) Charles D. Hurd e Carl N. Webb, p-Dimethylaminobenzophenone, in Organic Syntheses, vol. 7, 1925, pp. 24, DOI:10.15227/orgsyn.007.0024.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Ossicloruro di fosforo
Wikimedia Commons contiene immagini o altri file su Ossicloruro di fosforo