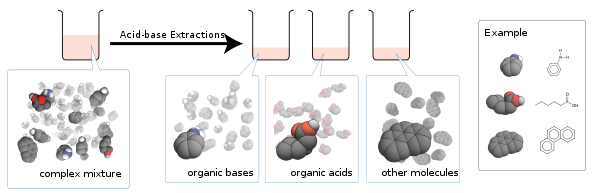
Estrazione acido-base
L'estrazione acido-base è un processo progressivo, in cui si utilizza l'estrazione liquido-liquido per purificare acidi o basi presenti in soluzioni, a seconda delle loro proprietà chimiche.[1]
Questo processo viene normalmente effettuato in seguito alla sintesi chimica e per isolare composti e prodotti naturali come gli alcaloidi dagli estratti grezzi.
Teoria
[modifica | modifica wikitesto]La teoria fondamentale sulla quale si base questa tecnica è che i sali, che sono ionici, tendono a essere solubili in acqua, mentre le molecole neutre tendono a non esserlo.
- L'aggiunta di un acido a una soluzione di una base organica e un acido comporta la protonazione della base, mentre l'acido non ionizza. Se l'acido organico, come potrebbe essere l'acido carbossilico, è abbastanza forte, la sua ionizzazione può essere repressa dall'aggiunta dell'acido.
- L'aggiunta di una base, invece, comporta la deprotonazione dell'acido con la conseguente formazione del sale corrispondente all'acido, mentre la base non ionizza. Anche in questo caso, la ionizzazione di una base forte è repressa dall'aggiunta della base.
Il processo di estrazione acido-base può essere utilizzato anche per separare acidi (o basi) molto deboli da acidi (o basi) forti, purché la differenza tra le loro costanti di dissociazione (acida o basica) sia sufficientemente grande. Alcuni esempi sono:
- Acidi molto deboli con gruppo OH fenolico come fenolo, 2-naftolo(pKa circa 10) da acidi più forti come l'acido benzoico o l'acido sorbico (pKa circa 4-5)
- Basi molto deboli come caffeina o 4-nitroanilina (pKb circa 13-14) da basi forti come la mescalina o la dimetiltriptamina (pKb circa 3-4)
Solitamente il pH viene regolato dal valore approssimativo tra le due costanti di dissociazione dei composti da separare. Acidi deboli come l'acido citrico, l'acido fosforico o l'acido solforico diluito sono utilizzati per valori del pH moderatamente acidi, mentre l'acido cloridrico e l'acido solforico più concentrato vengono utilizzati per valori del pH fortemente acidi. Lo stesso accade per la basi: basi deboli come l'ammoniaca o il bicarbonato di sodio sono usate per valori del pH moderatamente basici, mentre basi forti come il carbonato di potassio o l'idrossido di sodio sono utilizzate in condizioni fortemente alcaline.
Tecnica
[modifica | modifica wikitesto]Solitamente il composto viene disciolto con un solvente adeguato come il diclorometano o l'dietil etere e viene versato in un imbuto separatore. Si aggiunge una soluzione acquosa di acido o base e si regola il pH della fase acquosa per portare il composto nella forma desiderata. Dopo aver agitato per permettere la separazione delle fasi, viene raccolta la fase che contiene il composto d'interesse. Questo procedimento viene ripetuto con un valore del pH opposto. La sequenza non è importante e il processo si può ripetere per aumentare e migliorare la separazione; tuttavia è spesso conveniente che il composto sia disciolto nella fase organica dopo l'ultimo passaggio in modo che dall'evaporazione del solvente si ottenga il prodotto desiderato.
Limitazioni
[modifica | modifica wikitesto]Il processo funziona solo per acidi e basi con una grande differenza di solubilità tra le loro forme ionizzate e non ionizzate. Di conseguenza, questo processo non può funzionare in questi casi:
- Zwitterione con gruppi funzionali acidi o basici nella stessa molecola (per esempio la glicerina che tende a essere solubile a livelli alti di pH)
- Ammine o acidi liposolubili che non si dissolvono facilmente in fase acquosa nella loro forma ionizzata (trifenilammina o acidi grassi)
- Ammine deboli come l'ammoniaca, la metilammina o la trietanolammina che sono significativamente solubili in acqua ad alti livelli di pH
- Acidi idrofili come l'acido acetico, l'acido citrico o la maggior parte degli acidi inorganici (acido solforico, acido fosforico)
Alternative
[modifica | modifica wikitesto]Alcune alternative per l'estrazione acido-base possono essere:
- filtraggio del composto attraverso gel di silice o ossido di alluminio che assorbono i sali
- cromatografia a scambio ionico
Note
[modifica | modifica wikitesto]- ^ pubblicazione: 13 Jun 1989 Laurence M. Harwood, Christopher J. Moody, Experimental organic chemistry: Principles and Practice, Illustrated edition, pp. 118–122, ISBN 0-632-02017-2.
Voci correlate
[modifica | modifica wikitesto]Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Acid base extraction, su web.centre.edu. URL consultato il 28 aprile 2012 (archiviato dall'url originale il 3 marzo 2016).