Criptando
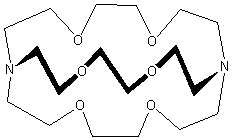
I criptandi sono composti analoghi, ma a struttura tridimensionale, agli eteri corona. Sono stati scoperti da Donald J. Cram, Jean-Marie Lehn, e Charles J. Pedersen, che per questo lavoro furono insigniti del premio Nobel per la chimica nel 1987. Il termine "criptando" deriva dal fatto che questi leganti incorporano (o meglio relegano) il substrato in una cripta, seppellendolo come in una tomba.
Struttura
[modifica | modifica wikitesto]Il primo, e più importante, dei criptandi è quello mostrato nell'immagine, il cui nome IUPAC è 1,10-diaza-4,7,13,16,21,24-esaoxabiciclo[8.8.8]esacosano. Si preferisce utilizzare il nome pratico Criptando[2.2.2], dove i numeri indicano il numero di ossigeni (e quindi di siti leganti) in ognuna delle tre braccia tra gli azoti a testa di ponte. Molti criptandi sono in vendita con il nome commerciale di "Kriptofix". Tutti i criptandi amminici mostrano particolare affinità per i metalli alcalini, caratteristica che ha permesso di isolare gli anioni alcaluri Na- e K-.[1] J. M. Lehn si rese conto che la presenza di una cavità macrociclica tridimensionale, in una molecola, permetteva al catione, non solo di essere complessato, ma di essere “incapsulato” all'interno della cavità stessa. Deriva proprio da questo aspetto, il termine “criptando” per sistemi macrociclici contenenti una cavità tridimensionale. Quindi, da un punto di vista strutturale, la maggiore differenza tra un macrociclo ed un criptando è la presenza di almeno una terza catena, che converte un sistema bidimensionale in un legante tridimensionale. In una maniera piuttosto semplificata è lecito visualizzare il criptando come una molecola macrociclica, contenente più unità cicliche condensate. La caratteristica fondamentale di questi composti è quella di possedere una cavità tridimensionale, all'interno della quale possono essere inglobate delle molecole o degli ioni, con conseguente formazione di composti di inclusione. Le reazioni di coordinazione sono guidate dalla natura della cavità, dalla sua forma e dimensione, dal tipo di atomi donatori e dalla loro disposizione relativa.
Proprietà
[modifica | modifica wikitesto]
La cavità interna dei criptandi funziona da sito legante - o nicchia - per gli ioni "ospitati". Il complesso del catione ospitato e del criptando ospite è chiamato criptato. I criptati formano complessi coi cationi duri, compresi NH4+, lantanoidi, metalli alcalini e alcalino terrosi. Al contrario dei tipici eteri a corona, i criptandi legano sia con gli azoti che con gli ossigeni. Le dimensioni della nicchia, inoltre, gli danno una selettività dimensionale, permettendo la distinzione tra i cationi dei metalli alcalini.
L'incremento di stabilità termodinamica dei complessi metallici, che si manifesta con il passaggio dei leganti da monodentati a chelanti e, successivamente, ai leganti macrociclici ed ai criptandi è legato alla progressiva strutturazione dei leganti, ed è dovuto ad una serie di concause.
Vanno presi in considerazione sia fattori topologici, che tengono conto della disposizione nello spazio dello ione metallico e degli atomi donatori, sia fattori dimensionali, che riguardano l'adattamento dello ione alla cavità macrociclica. Parametri importanti sono anche la rigidità del legante e la complementarità tra gli atomi donatori e lo ione metallico in termini di teoria hard-soft.
Esaminare più in dettaglio le proprietà di un complesso, formato da un macrociclo e da un metallo, impone di soffermarsi su un parametro strutturale di primaria importanza: la cavità macrociclica. Per cavità di un macrociclo si intende, generalmente, quella porzione di spazio definita dagli atomi donatori quando la molecola del legante è disposta in conformazione idonea per la coordinazione (atomi donatori convergenti), ma, in assenza dello ione metallico. In generale le dimensioni dipendono dal numero di atomi che costituiscono l'anello macrociclico e la stabilità dei complessi dipende dal rapporto tra le dimensioni della cavità e dello ione metallico.
In maniera semplice e molto schematica, si può affermare che la stabilità di una particolare classe di complessi diventa sempre maggiore all'aumentare del numero degli anelli chelati dei leganti presi in considerazione: si parla di effetto chelato. Del resto, numerosi studi confermano un ulteriore aumento di stabilità dei complessi, quando si passa da un legante a catena aperta, ad un legante macrociclico: in questo caso si parla di effetto macrociclico.
Modello ospite-ospitante
[modifica | modifica wikitesto]Come in natura Enzimi, anticorpi, ionofori e altri sistemi biologici sono capaci di legare selettivamente con legami intermolecolari non covalenti specifiche sostanze, includendole al loro interno, lo stesso tipo di selezione può essere replicato anche da molecole più piccole come i criptandi. Questa speciale caratteristica è studiata nella chimica ospite/ospitante.
Usi
[modifica | modifica wikitesto]I criptandi, nonostante il loro costo e la difficoltà di sintesi, offrono migliore selettività e stabilità di legame rispetto ad altri complessanti per gli ioni alcalini, come gli eteri a corona. Rendono possibile estrarre sali altrimenti insolubili in solventi organici; aumentano la reattività degli anioni dei sali perché riescono a spezzare le coppie ioniche; possono anche essere utilizzati come catalizzatori di trasferimento di fase, trasferendo ioni da una fase all'altra. I criptandi hanno consentito la sintesi di alcalidi (contenenti gli anioni Na- e K-) e elettridi (in cui l'anione è un elettrone). Sono stati usati per cristallizzare ioni cluster come Sn92-. Inoltre, la loro capacità di isolare lo ione ospite dal blocco del solvente (tutte le molecole d'acqua al di fuori della sfera di coordinazione) e di impedire la coordinazione diretta di molecole d'acqua, hanno permesso di sfruttare le caratteristiche di emettitore dell'europio (si usa un criptando-antenna chiamato trisbipy).
Note
[modifica | modifica wikitesto]- ^ Kim, J.; Ichimura, A. S.; Huang, R. H.; Redko, M.; Phillips, R. C.; Jackson, J. E. and Dye, J. L., "Crystalline Salts of Na- and K- (Alkalides) that Are Stable at Room Temperature", Journal of the American Chemical Society, 1999, volume 121, pagine 10666-10667.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Criptando
Wikimedia Commons contiene immagini o altri file su Criptando
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) IUPAC Gold Book, "cryptand", su goldbook.iupac.org.