Nitroglicerina
| Nitroglicerina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 1,2,3-trinitrossipropano | |
| Nomi alternativi | |
| trinitrina trinitrato di glicerina trinitroglicerina trinitroglicerolo piroglicerina | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H5(ONO2)3 |
| Massa molecolare (u) | 227,0872 u |
| Aspetto | liquido oleoso incolore o giallo chiaro |
| Numero CAS | |
| Numero EINECS | 200-240-8 |
| PubChem | 4510 |
| DrugBank | DBDB00727 |
| SMILES | C(C(CO[N+](=O)[O-])O[N+](=O)[O-])O[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,6 (a 15 °C) |
| Temperatura di fusione | 13,2 °C (286,4 K) |
| Temperatura di ebollizione | ~50 °C (~323 K) con detonazione |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −370,9 |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 200 - 301 - 311 - 331 - 370 - 411 |
| Consigli P | 201 - 202 - 260 - 262 - 264 - 270 - 271 - 273 - 280 - 281 - 284 - 301+310 - 302+350 - 304+340 |
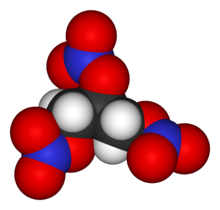
La nitroglicerina è un composto chimico esplosivo estremamente sensibile al calore e agli urti.
La nitroglicerina a temperatura ambiente è un liquido oleoso da incolore a giallo (quando è poco pura) che si decompone facilmente detonando raggiungendo i 200 °C. Alla temperatura di 13 °C congela, diventando estremamente pericolosa: i cristalli al suo interno diventano sottili come aghi e si spezzano facilmente (anche toccando la provetta) dando così il via all'esplosione; quindi è consigliabile lasciare che si scongeli da sola senza avvicinarsi.
I legami delle sue molecole sono molto deboli, quindi esse tendono a scindersi anche a temperatura ambiente, per formare composti più stabili, come anidride carbonica e ossidi di azoto. Con la prova della berta si è dimostrato che la nitroglicerina è molto sensibile: un peso di 2 kg che cade da 4–5 cm di altezza su un campione di quest'esplosivo provoca la detonazione. È uno degli esplosivi più veloci con una velocità di detonazione di circa 7000–7400 m/s.
È assai instabile: quindi per motivi di sicurezza non è mai usata pura, né trasportata, ma sempre mescolata con sostanze stabilizzanti che la assorbono e costituisce la base delle varie dinamiti.
La nitroglicerina, a piccolissime dosi (dell'ordine del milligrammo), è usata nella terapia dell'angina pectoris in virtù dell'effetto coronarodilatatore e venodilatatore dei suoi metaboliti.
Storia
[modifica | modifica wikitesto]La nitroglicerina fu sintetizzata per la prima volta nel 1847 da Ascanio Sobrero, che lavorava all'Università di Torino con Théophile-Jules Pelouze.[1] Era il primo esplosivo prodotto che era più efficace della polvere da sparo. Sobrero chiamò inizialmente il prodotto piroglicerina e mise in rilievo il rischio nell'utilizzo come esplosivo.[2]
L'esperimento della sintesi di nitrocellulosa era già stato effettuato, senza successo, nel 1845 dal chimico tedesco Christian Friedrich Schönbein: mise due gocce, questa volta di glicerina, in una provetta e la riscaldò, ma la piccola esplosione che ne scaturì durante l'esperimento danneggiò il laboratorio, così decise di interrompere gli esperimenti. Successivamente Sobrero riprese gli studi degli acidi e nel 1847 riuscì nella sintesi. Sobrero, per esibire agli altri scienziati la consistenza della nitroglicerina, ne poneva una goccia su di un'incudine e la batteva con un martello, mostrando che questo, per lo scoppio, veniva lanciato via.
Alfred Nobel ne iniziò lo studio nel 1859 e, dopo la scoperta che l'esplosione poteva essere innescata con polvere da sparo, ne iniziò la commercializzazione sotto il nome di "olio esplodente". Un'esplosione distrusse la prima fabbrica svedese, uccidendo il fratello di Alfred.[3] Il commercio di nitroglicerina continuò fino al 1867, anno in cui Nobel adottò il fulminato di mercurio come detonatore e stabilizzò la nitroglicerina, facendola assorbire da farina fossile (una diatomite), ottenendo una pasta morbida più stabile della nitroglicerina e che poteva essere plasmata in canne di dimensioni e forma idonea per l'inserimento nei fori di perforazione che chiamò dinamite, utile nelle cave, demolizioni ed agli usi bellici. Il tecnico-imprenditore svedese brevettò nel 1875 la cosiddetta "gelatina esplosiva", a base di cotone collodio e nitroglicerina, con un potere esplosivo maggiore della dinamite.
Stechiometria di sintesi
[modifica | modifica wikitesto]La nitroglicerina è sintetizzata attraverso la nitrazione della glicerina, in cui si introducono 3 gruppi nitronio (NO2+), derivanti dall'acido nitrico (HNO3):
- HNO3 + H2SO4 → H2NO3+ + HSO4-
- H2NO3+ → NO2+ + H2O
- HSO4- + H+ → H2SO4
- 3HNO3 + C3H5(OH)3 → C3H5(ONO2)3 + 3H2O
Sintesi
[modifica | modifica wikitesto]La nitroglicerina si ottiene industrialmente per gocciolazione della glicerina in una miscela nitrante, ossia una miscela di acido nitrico concentrato e acido solforico concentrato nella proporzione 44/56, (in parti di volume acido nitrico/acido solforico) dove l'acido solforico serve non solo come disidratante, ma anche per formare lo ione nitronio, che è il vero agente nitrante. Il tutto è svolto a 15 °C circa in rigorose condizioni di sicurezza; in effetti, negli impianti di produzione della nitroglicerina il processo di reazione è eseguito da apparecchiature automatiche, telecomandate da debita distanza.
Oltre al pericolo insito nella reazione stessa, che in condizioni non controllate può causare incidenti gravi, si ricorda che in Italia la produzione e la sintesi di esplosivi sono soggette a rigorose disposizioni di legge[4][5].
Uso farmacologico
[modifica | modifica wikitesto]La nitroglicerina è utilizzata in medicina come antianginoso. Possiede attività vasodilatante a livello venoso (basse concentrazioni) e a livello arterioso (elevate concentrazioni).
Agisce liberando NO mediante degradazione enzimatica, grazie all'enzima glutatione-nitrato-reduttasi, attraverso l'aldeide deidrogenasi mitocondriale (ALDH2), scoperta nel 2002.[6]
Essendo questo enzima molto abbondante nel fegato, se il farmaco viene assunto per via orale, avviene degradazione e liberazione di NO al livello del fegato, dove non risulterebbe molto utile; al contrario con la somministrazione sub-linguale o percutanea gli effetti cardiovascolari risultano essere più marcati in quei distretti dove l'enzima è più presente, in ordine decrescente: grossi vasi venosi, arterie ed arteriole.[7]
La nitroglicerina possiede un'azione dose dipendente:
- Basse dosi: dilatazione delle grosse vene;
- Dosi intermedie: dilatazione delle arterie;
- Alte dosi: dilatazione degli sfinteri precapillari e riduzione significativa delle resistenze periferiche.
Indicazioni
[modifica | modifica wikitesto]
- Trattamento e profilassi dell'angina pectoris da sforzo, stabile, instabile; secondaria a insufficienza coronarica o infarto miocardico.
- Scompenso cardiaco anche in associazione a farmaci inotropi positivi e diuretici.
- Controllo pressorio dell'ipertensione associata a intubazione intratracheale, anestesia, sternotomia, by-pass coronarico; periodo post-operatorio.
- Trattamento dell'edema polmonare acuto e pre-edema polmonare.
- Trattamento delle emergenze ipertensive in caso di sindromi coronariche acute e nell'edema polmonare (la nitroglicerina è controindicata in caso di danno miocardico destro).
- Trattamento del dolore associato a ragade anale cronica.
- Stravaso da chemioterapici.
Nei pazienti che presentano angina pectoris e ipertensione la nitroglicerina è preferita ai nitrati, beta-bloccanti o calcio-antagonisti[8].
In caso di somministrazione via bocca occorre assumere il farmaco dopo i pasti ed eliminare eventuali tracce di compressa prima di coricarsi. A contatto della mucosa la forma farmaceutica forma un gel che favorisce l'assorbimento del farmaco[9]. I movimenti della lingua possono spostare la compressa o aumentare la velocità di dissoluzione; la xerostomia può ridurre l'assorbimento del farmaco.
La somministrazione endovena consente il trattamento in caso di urgenza del vasospasmo coronarico, dell'angina instabile, della sindrome ischemica acuta. L'infusione deve essere effettuata in ambiente ospedaliero utilizzando sistemi infusionali muniti di pompa (per la regolazione della velocità)[10].
Si raccomanda di non somministrare nitroglicerina durante la gravidanza o l'allattamento a fini precauzionali. La nitroglicerina è stata impiegata, nella formulazione transdermica a rilascio controllato, come farmaco tocolitico, in caso di parto prematuro per i suoi effetti miorilassanti sulla muscolatura uterina (il farmaco è risultato efficace nel ridurre morbilità e mortalità nei nati pretermine e nel ritardare di 4 settimane il parto)[11].
Note
[modifica | modifica wikitesto]- ^ Ascanio Sobrero, Sur plusieur composés détonants produits avec l'acide nitrique et le sucre, la dextrine, la lactine, la mannite et la glycérine, in Comptes Rendus, vol. 24, 1847, pp. 247–248.
- ^ Ascanio Sobrero, Sopra alcuni nuovi composti fulminanti ottenuti col mezzo dell'azione dell'acido nitrico sulle sostante organiche vegetali, in Memorie della Reale Accademia delle Scienze di Torino, 2 Serie, vol. 10, 1849, pp. 195–201. A p. 197, Sobrero descrive il nuovo prodotto: Quelle gocciole costituiscono il corpo nuovo di cui descriverò ora le proprietà, e che chiamerò "Piroglicerina".
- ^ Emil Nobel, su NobelPrize.org. URL consultato il 6 ottobre 2008 (archiviato dall'url originale il 15 gennaio 2009).
- ^ Dlgs 7/97, su www.parlamento.it. URL consultato il 7 novembre 2023.
- ^ Allegato II al D.M. 19 settembre 2002, n.272 come disposto art. 18
- ^ Z. Chen, M. W. Foster, J. Zhang, L. Mao, H. A. Rockman, T. Kawamoto, K. Kitagawa, K. I. Nakayama, D. T. Hess e J. S. Stamler, An essential role for mitochondrial aldehyde dehydrogenase in nitroglycerin bioactivation, in Proceedings of the National Academy of Sciences, vol. 102, n. 34, 2005, pp. 12159–12164, Bibcode:2005PNAS..10212159C, DOI:10.1073/pnas.0503723102, PMC 1189320, PMID 16103363.
- ^ Unknown, behind paywall, archived, su web.ebscohost.com. URL consultato il 14 aprile 2018 (archiviato dall'url originale il 10 maggio 2017).
- ^ Chesi G., Reverzani A., Inf. sui Farm., 1989, XIII (2), 133
- ^ Med. Lett., 1987, 13, 65
- ^ Drug Ther. Bull., 1990, 3 (3), 9
- ^ Smith G.N. et al., Am. J. Obstet Gynecol., 2007, 196 (1), 37
Altri progetti
[modifica | modifica wikitesto] Wikiquote contiene citazioni di o su nitroglicerina
Wikiquote contiene citazioni di o su nitroglicerina Wikizionario contiene il lemma di dizionario «nitroglicerina»
Wikizionario contiene il lemma di dizionario «nitroglicerina» Wikimedia Commons contiene immagini o altri file su nitroglicerina
Wikimedia Commons contiene immagini o altri file su nitroglicerina
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) nitroglycerin, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 37660 · LCCN (EN) sh85092085 · GND (DE) 4042391-8 · BNF (FR) cb11968823w (data) · J9U (EN, HE) 987007531390805171 · NDL (EN, JA) 00568571 |
|---|