n-butillitio
| N-butillitio | |
|---|---|
 | |
| Nome IUPAC | |
| 1-litiobutano | |
| Nomi alternativi | |
| butil litio n-BuLi | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C4H9Li |
| Massa molecolare (u) | 64,05 |
| Aspetto | solido cristallino incolore e instabile |
| Numero CAS | |
| Numero EINECS | 203-698-7 |
| PubChem | 61028 e 53627823 |
| SMILES | CCCC[Li] e [Li+].CCC[CH2-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,68 (in solvente esano) |
| Costante di dissociazione basica a 298,15 K | >1021 |
| Solubilità in acqua | reagisce violentemente, solubile in solventi organici apolari |
| Temperatura di fusione | −76 °C (197,15 K) |
| Temperatura di ebollizione | 60-80 °C (333,15 - 353,15 con decomposizione K) |
| Tensione di vapore (Pa) a 293,15 K | 17,3 kPa (in solvente esano) |
| Indicazioni di sicurezza | |
| Punto di fiamma | −21 °C (252,15 K) |
| Temperatura di autoignizione | 240 °C (513,15 K) |
| Simboli di rischio chimico | |
    
| |
| Frasi H | 225 - 250 - 260 - 304 - 314 - 336 - 361f - 373 - 411 - EUH014 |
| Consigli P | 210 - 222 - 223 - 231+232 - 370+378 - 422 [1][2] |
Il composto chimico n-butillitio (o n-butil litio) rappresenta il più importante reagente dei composti organometallici del litio. Viene ampiamente utilizzato come iniziatore della polimerizzazione di elastomeri quali il polibutadiene o il copolimero stirene-butadiene (SBR). La sua caratteristica basicità molto forte viene sfruttata in sintesi organica. La produzione mondiale annua di butil litio e altri organolitio è stimata in 1 800 tonnellate. A causa della sua instabilità all'aria, il butil litio viene normalmente commercializzato in soluzione organica, solitamente in esano, a diversa concentrazione oppure allo stato solido in atmosfera inerte protettiva.
Proprietà chimico-fisiche
[modifica | modifica wikitesto]A causa del carattere piroforico del butil litio e delle sue soluzioni, la determinazione delle proprietà chimico-fisiche richiede grande cura nella protezione dall'aria. Reagisce violentemente con l'acqua formando idrossido di litio fortemente corrosivo:
n-BuLi reagisce anche con CO2 per dare pentanoato di litio:
A causa della forte differenza di elettronegatività fra gli atomi di carbonio e litio il legame C-Li è fortemente polarizzato, sebbene non sia ionico. La separazione di carica è stata stimata essere del 55-95 %. Nella descrizione pratica di alcune sintesi organiche spesso si usa indicare il composto come n-Bu-Li+.
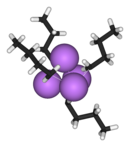
Allo stato solido e in soluzione il butil litio, come molti organolitio, esiste come cluster formato da legami covalenti Li-Li e Li-C. La forma principale è quella tetramera Li4 che descrive un tetraedro con ai vertici atomi di litio legati al gruppo n-butilico. Il legame formatosi, a 4 centri/2 elettroni, rende la configurazione elettronica del litio più stabile. Tali strutture, allo stato solido, rendono conto della solubilità in solventi apolari di questi composti.
La stessa proprietà del litio di coordinare catene idrocarburiche multiple, usando i suoi orbitali non occupati, consente al butil litio di coordinare altri donatori σ in soluzione.
Sintesi
[modifica | modifica wikitesto]La classica reazione di sintesi sfrutta n-butil bromuro (o n-butil cloruro) e litio metallico:[3]
- 2 Li + C4H9Br → C4H9Li + LiBr
La reazione è catalizzata dalla presenza di una impurezza di sodio (1%) presente nel litio. I solventi utilizzati per effettuare questa sintesi sono principalmente benzene, cicloesano, esano ed etere dietilico. Quando si utilizza BuBr il prodotto consiste in una soluzione omogenea contenente un cluster misto di BuLi e LiBr. Con LiCl si ottiene invece un precipitato di LiCl.
Reattività
[modifica | modifica wikitesto]BuLi dà reazioni di doppio scambio con alogenuri alchilici, tipicamente con i bromuri, producendo nuovi organolitio:
- C4H9Li + RBr → C4H9Br + RLi
Queste reazioni sono solitamente condotte in etere dietilico a -78 °C.
Una categoria simile di reazioni comprende la transmetallazione, dove due organometalli scambiano i loro componenti metallici. Molti esempi di tali reazioni implicano scambio del litio con lo stagno:
- C4H9Li + (CH3)3Sn(C6H5) → C4H9Sn(CH3)3 + C6H5Li
Una delle proprietà del butil litio più sfruttate è la sua basicità: può deprotonare ogni idrocarburo la cui base coniugata è in qualche modo stabilizzata per delocalizzazione elettronica. Esempi includono alchil(o fenil)-acetileni, metil-fosfine e ferrocene. La stabilità termodinamica e la volatilità del butano spostano l'equilibrio verso i prodotti. La cinetica della basicità di BuLi dipende dal solvente utilizzato. Genericamente, la reazione acido-base viene così indicata:
- C4H9Li + RH C4H10 + R-Li
I ligandi che complessano Li+, come la tetrametilenediammina (TMEDA) e 1,4-diazobiciclo[2.2.2]ottano (DABCO), polarizzano il legame C-Li e accelerano la litiazione. Alcuni additivi favoriscono l'isolamento del derivato del litio, un noto esempio è rappresentato dal dilitioferrocene:
- Fe(C5H5)2 + 2 C4H9Li + 2 TMEDA → C4H10 + Fe(C5H4Li)2(TMEDA)2
Gli organolitio, incluso n-BuLi, possono essere utilizzati nella sintesi di aldeidi e chetoni. Un esempio è rappresentato dalla reazione con una ammide bisostituita:
- RLi + R'CON(CH3)2 → (CH3)2NLi + R'C(=O)R
Gli organolitio sono utilizzati anche nella sintesi degli alcheni. Quando riscaldati, i composti litiorganici subiscono eliminazione del β-idrogeno producendo un alchene e idruro di litio:
- C4H9Li + Δ → LiH + CH3CH2CH=CH2
Note
[modifica | modifica wikitesto]- ^ Sigma Aldrich; rev. del 17.01.2012 riferita alla soluzione 10M di n-butillitio in n-esano
- ^ Usare sabbia secca, prodotto chimico secco oppure schiuma resistente all'alcool per l'estinzione.
- ^ Brandsma, L.; Verkraijsse, H. D., Preparative Polar Organometallic Chemistry I, Berlin, Springer-Verlag, 1987, ISBN 3-540-16916-4.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su N-butillitio
Wikimedia Commons contiene immagini o altri file su N-butillitio
Collegamenti esterni
[modifica | modifica wikitesto]- butillìtio, su sapere.it, De Agostini.
- (EN) butyllithium, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.


