Acido glutammico
| Acido glutammico | |
|---|---|
 | |
 | |
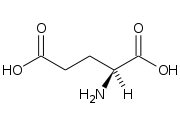
| Nome IUPAC | |
| acido 2(S)-ammino-1,5-pentandioico | |
| Abbreviazioni | |
| E GLU | |
| Nomi alternativi | |
| acido L-glutammico acido L-α-amminoglutarico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C5H9NO4 |
| Massa molecolare (u) | 147,13 |
| Aspetto | solido cristallino biancastro |
| Numero CAS | |
| Numero EINECS | 210-522-2 |
| PubChem | 611 e 57397101 |
| SMILES | C(CC(=O)O)C(C(=O)O)N |
| Proprietà chimico-fisiche | |
| Costante di dissociazione acida a 293 K | pK1: 2,10 pK2: 9,47 |
| Punto isoelettrico | 3,15 |
| Solubilità in acqua | 11,1 g/l a 298 K |
| Temperatura di fusione | 160 °C (433 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −1009,7 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[1] |
L'acido glutammico è un amminoacido utilizzato dagli esseri viventi per la sintesi delle proteine. Viene indicato comunemente con le sigle E o Glu ed è codificato sull’RNA messaggero dai codoni GAA e GAG.
Storia
[modifica | modifica wikitesto]L'acido glutammico fu scoperto nell'anno 1866 dal chimico tedesco Karl Heinrich Ritthausen, che trattò il glutine di frumento (da cui prese il nome) con acido solforico.[2]
Nel 1908, il ricercatore giapponese Kikunae Ikeda dell'Università Imperiale di Tokyo identificò i cristalli marroni lasciati dopo l'evaporazione di una grande quantità di brodo di kombu come acido glutammico. Questi cristalli, all'assaggio, riproducevano l'ineffabile ma innegabile sapore che rilevava in molti cibi, soprattutto nelle alghe. Il professor Ikeda ha definito questo sapore umami. Ha quindi brevettato un metodo per la produzione in serie di un sale cristallino di acido glutammico, il glutammato monosodico.[3][4]
Struttura
[modifica | modifica wikitesto]L'amminoacido è composto da un gruppo amminico, uno carbossilico e una catena laterale acida () che rende la molecola polare. In condizioni fisiologiche l'amminoacido si presenta in forma di anione, in quanto il gruppo α-carbossilico e α-amminico sono carichi negativamente e positivamente, mentre la catena laterale è carica negativamente (), di conseguenza la carica globale della molecola è negativa. In questa forma, l'acido glutammico prende il nome di glutammato, ed è in grado di interagire elettricamente con altre molecole cariche. La forma zwitterionica viene raggiunta a pH acidi, quando il gruppo amminico è protonato e solo uno dei due gruppi carbossilici è deprotonato. Siccome i due gruppi carbossilici hanno costanti di dissociazione acida differenti, è possibile identificare il punto isoelettrico a pH pari a 3,15.[5]
L'acido glutammico, come la maggior parte degli amminoacidi, è soggetto a stereoisomeria. Il carbonio 2, chiamato anche carbonio α, è uno stereocentro che porta legati 4 sostituenti differenti (, , e ). A seconda di come sono orientati tridimensionalmente questi sostituenti, possono identificarsi due enantiomeri: l'acido 2(S)-ammino-1,5-pentandioico e l'acido 2(R)-ammino-1,5-pentandioico. Queste due molecole hanno attività ottica e di conseguenza si possono distinguere l'acido L-glutammico e l'acido D-glutammico. Anche la loro forma anionica possiede attività ottica e dunque si riconoscono: l'L-glutammato e il D-glutammato.
Con il nome “acido glutammico” e "glutammato" si intendono comunemente le miscele racemiche. Il radicale corrispondente al glutammato è chiamato glutamil.
-
Struttura dell'acido L-glutammico
-
Struttura dell'acido D-glutammico
Acido L-glutammico
[modifica | modifica wikitesto]L'enantiomero L dell'acido glutammico è, tra i due, quello usato dagli esseri viventi come mattoncino per costruire le proteine. In condizioni fisiologiche, il glutammato è il neurotrasmettitore eccitatorio più abbondante del sistema nervoso dei vertebrati e serve anche come precursore per la sintesi dell'acido γ-amminobutirrico (GABA), un altro neurotrasmettitore. Viene naturalmente sintetizzato nel nostro organismo, per cui rientra in quella categoria di amminoacidi non essenziali, che possono essere evitati dall'alimentazione.[5]
Biosintesi
[modifica | modifica wikitesto]Molte vie metaboliche dell'organismo umano producono come intermedio o come prodotto finale l'acido glutammico, di seguito ne sono indicate alcune.
| Reagenti | Prodotti | Enzimi |
|---|---|---|
| Glutammina + H2O | Glu + NH3 | GLS, GLS2 |
| Acido N-acetilglutammico + H2O | Glu + Acetato | N-acetilglutamato sintasi |
| α-chetoglutarato + NADPH + NH4+ | Glu + NADP+ + H2O | GLUD1, GLUD2 |
| α-chetoglutarato + α-amminoacido | Glu + α-chetoacido | Transaminasi |
| Acido spaglumico | Glu + acido N-acetilaspartico | GCPII |
| 1-pirrolina-5-carbossilato + NAD+ + H2O | Glu + NADH | 1-pirrolina-5-carbossilato deidrogenasi |
Produzione industriale
[modifica | modifica wikitesto]Con una produzione annua stimata di circa 1,5 milioni di tonnellate nel 2006,[6] l'acido glutammico è l'amminoacido più abbondantemente sintetizzato di tutti. La sua sintesi chimica è stata soppiantata agli inizi degli anni '50 dalla fermentazione aerobica compiuta dall'organismo Corynebacterium glutamicum su ammoniaca e zuccheri.[7]
Viene anche prodotto come sale cloridrato.[8]
Metabolismo
[modifica | modifica wikitesto]Il glutammato è un composto chiave nel metabolismo cellulare. Negli esseri umani, le proteine alimentari vengono prima scomposte dalla digestione in aminoacidi, i quali poi fungono da carburante metabolico per altri ruoli funzionali nel corpo. Un processo chiave nella degradazione degli amminoacidi è la transaminazione, in cui il gruppo amminico di un amminoacido, in questo caso dell'acido glutammico, viene trasferito a un α-chetoacido, reazione tipicamente catalizzata da una transaminasi.
Il glutammato svolge anche un ruolo importante nello smaltimento dell'azoto in eccesso o di scarto da parte dell'organismo. Il glutammato subisce la deaminazione, una reazione ossidativa catalizzata dalla glutammato deidrogenasi.[9] L'ammoniaca prodotta sotto forma di ione ammonio, viene quindi convertita in urea dal fegato ed escreta. La transaminazione può quindi essere collegata alla deaminazione, consentendo efficacemente la rimozione dell'azoto dai gruppi amminici degli amminoacidi, tramite il glutammato come intermedio, e infine escreto dal corpo sotto forma di urea.
| Reagenti | Prodotti | Enzimi |
|---|---|---|
| Glu + α-chetoacido | α-chetoglutarato + α-amminoacido | Transaminasi |
| Glu + H2O + NADP+ | α-chetoglutarato + NADPH + NH4+ | GLUD1, GLUD2 |
| Glu | GABA + CO2 | GAD |
Utilizzi
[modifica | modifica wikitesto]Neurotrasmettitore
[modifica | modifica wikitesto]L'acido L-glutammico è il neurotrasmettitore più abbondante che si trova nel cervello. Come tale non è capace di attraversare la barriera ematoencefalica: per raggiungere il cervello, dove viene usato per la sintesi proteica, viene prima convertito in glutammina e poi riconvertito in acido glutammico. I tumori cerebrali maligni noti come gliomi o glioblastomi sfruttano il glutammato come fonte di energia. Alcuni di questi tumori diventano più dipendenti dal glutammato a causa di mutazioni nel gene IDH1.[10][11]
Si ipotizza che l'acido glutammico sia coinvolto nel cervello in funzioni cognitive quali l'apprendimento e la memoria, benché l'accumulo nel lungo termine o molto più raramente l'assunzione in quantità eccessive possano causare danni neuronali da eccitotossicità tipici di sclerosi progressive (come la sclerosi laterale amiotrofica) e della malattia di Alzheimer.[12]
Alimentazione umana
[modifica | modifica wikitesto]Il sale sodico dell'acido glutammico, il glutammato monosodico o glutammato di sodio, è ampiamente usato nell'industria alimentare come esaltatore di sapidità. Nell'Unione europea, il glutammato monosodico viene classificato come additivo alimentare (identificato con il codice E621) ed esistono delle direttive che ne regolamentano l'utilizzo negli alimenti.
Acido D-glutammico
[modifica | modifica wikitesto]L'enantiomero D dell'acido glutammico è un metabolita dei procarioti, di alcune piante e di alcuni animali. Non viene sintetizzato da alcun mammifero, ma si trova nei nostri tessuti a livelli sorprendentemente alti.[13][14][15]
Biosintesi
[modifica | modifica wikitesto]La sua biosintesi è stata studiata nell'organismo di E. Coli, ma è plausibile avvenga anche nelle piante e negli animali che sembrano utilizzarlo.
| Reagenti | Prodotti | Enzimi |
|---|---|---|
| L-glu | D-glu | Glutammato racemasi |
Metabolismo
[modifica | modifica wikitesto]La via metabolica principale che utilizza il D-glutammato è la sintesi del peptidoglicano, che lo lega al peptide nascente come secondo amminoacido, dopo aver legato L-alanina al NAM. Anche la reazione di racemizzazione è altrettanto abbondante, soprattutto negli eucarioti.
| Reagenti | Prodotti | Enzimi |
|---|---|---|
| D-glu + UDP-NAM-L-ala + ATP | UDP-NAM-L-ala-D-glu + ADP | Ligasi |
| D-glu | L-glu | Glutammato racemasi |
Utilizzi
[modifica | modifica wikitesto]Nei procarioti l'acido D-glutammico è un componente del peptidoglicano ed è quindi utilizzato nella sua sintesi.
Negli eucarioti sembra essere un potente inibitore della sintesi del glutatione.[16] L'assunzione orale di D-glu sembra aumentare la concentrazione ematica di acido D-pirrolidoncarbossilico.[16] È noto che alcune anguille usano l'acido D-glutammico come feromone per la comunicazione chimica.[15]
Abbondanza negli alimenti
[modifica | modifica wikitesto]Le principali fonti alimentari di acido glutammico sono il glutine (25% di acido glutammico in peso) e la caseina del latte animale (20-23%), legato agli altri amminoacidi o libero a seguito di pasteurizzazione del latte, raffinazione e cottura del grano, fermentazione naturale dei formaggi.[17] Anche l'alga konbu ne è ricca[18].
Le proteine animali o vegetali idrolizzate possono contenere glutammato libero se questo era presente in forma legata: l'idrolisi comporta la separazione delle catene di aminoacidi presenti, incluso l'eventuale glutammato legato.
Note
[modifica | modifica wikitesto]- ^ scheda dell'acido glutammico su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ (EN) Robert Henry Aders Plimmer, The Chemical Constitution of the Proteins: Analysis, Longmans, Green & Company, 1912. URL consultato il 16 luglio 2022.
- ^ (EN) If MSG is so bad for you, why doesn't everyone in Asia have a headache?, su the Guardian, 10 luglio 2005. URL consultato il 16 luglio 2022.
- ^ Kikunae Ikeda Sodium Glutamate, su web.archive.org, 28 ottobre 2007. URL consultato il 16 luglio 2022 (archiviato dall'url originale il 28 ottobre 2007).
- ^ a b (EN) PubChem, Glutamic acid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 16 luglio 2022.
- ^ (EN) Alvise Perosa e Fulvio Zecchini, Methods and Reagents for Green Chemistry: An Introduction, John Wiley & Sons, 25 maggio 2007, ISBN 978-0-470-12407-9. URL consultato il 17 luglio 2022.
- ^ (EN) Michael C. Flickinger, Encyclopedia of Industrial Biotechnology, 7 Volume Set: Bioprocess, Bioseparation, and Cell Technology, Wiley, 5 aprile 2010, ISBN 978-0-471-79930-6. URL consultato il 17 luglio 2022.
- ^ (EN) Patrick Foley, Azadeh Kermanshahi Pour e Evan S. Beach, Derivation and synthesis of renewable surfactants, in Chemical Society Reviews, vol. 41, n. 4, 30 gennaio 2012, pp. 1499–1518, DOI:10.1039/C1CS15217C. URL consultato il 17 luglio 2022.
- ^ (EN) Agnieszka Grabowska, Marcin Nowicki e Joanna Kwinta, Glutamate dehydrogenase of the germinating triticale seeds: gene expression, activity distribution and kinetic characteristics, in Acta Physiologiae Plantarum, vol. 33, n. 5, 25 giugno 2011, pp. 1981, DOI:10.1007/s11738-011-0801-1. URL consultato il 17 luglio 2022.
- ^ (EN) Sanne A. M. van Lith, Anna C. Navis e Kiek Verrijp, Glutamate as chemotactic fuel for diffuse glioma cells: Are they glutamate suckers?, in Biochimica et Biophysica Acta (BBA) - Reviews on Cancer, vol. 1846, n. 1, 1º agosto 2014, pp. 66–74, DOI:10.1016/j.bbcan.2014.04.004. URL consultato il 17 luglio 2022.
- ^ Sanne A.M. van Lith, Remco Molenaar e Cornelis J.F. van Noorden, Tumor cells in search for glutamate: an alternative explanation for increased invasiveness of IDH1 mutant gliomas, in Neuro-Oncology, vol. 16, n. 12, 1º dicembre 2014, pp. 1669–1670, DOI:10.1093/neuonc/nou152. URL consultato il 17 luglio 2022.
- ^ Robert Sapolsky, Biology and Human Behavior: The Neurological Origins of Individuality, 2nd Edition, su PsycEXTRA Dataset. URL consultato il 17 luglio 2022.
- ^ ECMDB: D-Glutamic acid (ECMDB03339) (M2MDB000491), su ecmdb.ca. URL consultato il 17 luglio 2022.
- ^ (EN) PubChem, D-glutamic acid, su pubchem.ncbi.nlm.nih.gov. URL consultato il 17 luglio 2022.
- ^ a b Human Metabolome Database: Showing metabocard for D-Glutamic acid (HMDB0003339), su hmdb.ca. URL consultato il 17 luglio 2022.
- ^ a b Dominic Raj, Maryln Langford e Stephan Krueger, Regulatory responses to an oral d-glutamate load: formation of d-pyrrolidone carboxylic acid in humans, in American Journal of Physiology-Endocrinology and Metabolism, vol. 280, n. 2, 1º febbraio 2001, pp. E214–E220, DOI:10.1152/ajpendo.2001.280.2.E214. URL consultato il 17 luglio 2022.
- ^ Dario Bressanini, Pomodori Umami al glutammato, su bressanini-lescienze.blogautore.espresso.repubblica.it. URL consultato il 19 gennaio 2018.
- ^ Umami, il quinto gusto fondamentale nella cucina giapponese, su mikeleerose.com.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su acido glutammico
Wikimedia Commons contiene immagini o altri file su acido glutammico
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) glutamate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 48 · LCCN (EN) sh85055379 · GND (DE) 4113764-4 · BNF (FR) cb12267307z (data) · J9U (EN, HE) 987007531218405171 · NDL (EN, JA) 00562658 |
|---|






