Diagramma di Davenport
Il diagramma di Davenport è un grafico che mette in relazione il pH sanguigno e la concentrazione di ioni bicarbonato presenti nel sangue e permette di analizzarne le variazioni dovute a mutamenti dell'equilibrio acido-base dell'organismo. Concettualmente non è altro che una rappresentazione grafica della equazione di Henderson-Hasselbach.
Descrizione[modifica | modifica wikitesto]
Concetti di base[modifica | modifica wikitesto]
Si considerino fisiologici un pH=7.4, una PCO2 pari a 40mmHg e una concentrazione di ioni HCO3- pari a 24meq/L.
Immaginiamo di effettuare un prelievo di sangue a queste condizioni. Dopo aver riportato sul grafico tali valori, supponiamo di esporre tale campione a composti acidi o basici: seguendo le variazioni di pH del campione potremo ottenerne la curva di titolazione (ricordando sempre che tali modificazioni avvengono in maniera isobara, costantemente alla pressione parziale di CO2 di 40mmHg).
A questo punto, supponiamo di variare la pressione parziale di CO2, ad esempio alzandola o abbassandola, e di effettuare per ogni variazione un prelievo sanguigno e un'esposizione ad acidi e basi, riportando poi sul grafico i valori ottenuti. In questo modo, sul nostro grafico otterremmo varie curve di titolazione.
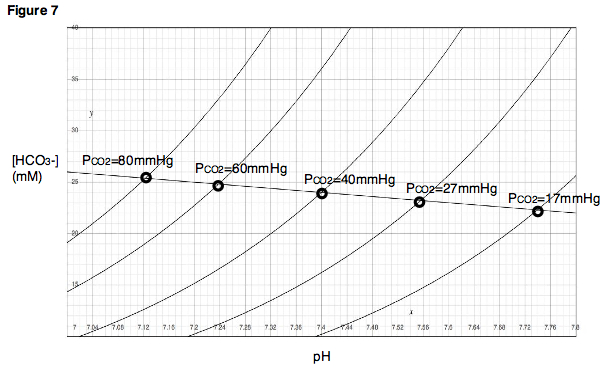
Si noti come ad ogni aumento della pressione parziale di anidride carbonica corrisponda un lieve aumento della concentrazione di ioni bicarbonato ed un calo del pH (dato che gli ioni bicarbonato rilasciano idrogenioni liberi), mentre ad una riduzione della pressione parziale corrisponde un calo degli ioni bicarbonato ed un aumento del pH: tali variazioni seguono una linea retta pressoché perfetta. Da ciò si evince lo stretto rapporto tra pressione di CO2 e concentrazione di ioni bicarbonato, che sono in equilibrio tra loro, e i cui parametri si modificano in maniera lineare.
Applicazione[modifica | modifica wikitesto]
Dal punto di vista pratico, prendiamo in considerazione le quattro principali alterazioni dell'equilibrio acido-base: acidosi respiratoria, acidosi metabolica, alcalosi respiratoria ed alcalosi metabolica.
Nel caso aumenti la PCO2 alveolare (ad esempio per ipoventilazione e una difficoltà negli scambi gassosi, come può avvenire in caso di edema polmonare) assisteremo inizialmente anche ad un calo del pH mentre gli ioni bicarbonato resteranno a livelli normali: avremo quindi una acidosi respiratoria scompensata. Nel momento in cui i reni si attiveranno (cosa che in genere richiede tempo) iniziando a ritenere gli ioni bicarbonato passeremo ad una acidosi respiratoria compensata, con pressione parziale di CO2 alta, pH normalizzato e ioni bicarbonato aumentati.
In alcune situazioni (diabete, insufficienza renale, diarrea, insufficienza cardiaca) la concentrazione di ioni bicarbonato può ridursi -generalmente per aumentata escrezione nelle urine- portando ad un calo del pH e causando una acidosi metabolica scompensata: a ciò l'organismo reagisce aumentando la ventilazione polmonare, riducendo conseguentemente la PCO2 la quale eleva il pH normalizzandolo e dando una acidosi metabolica compensata (i valori degli ioni bicarbonato resteranno comunque bassi).
L'iperventilazione determina un calo della PCO2 e conseguente un aumento del pH mentre inizialmente gli ioni bicarbonato resteranno normali (alcalosi respiratoria scompensata): a ciò l'organismo reagisce aumentando l'escrezione di ioni bicarbonato per via renale riducendone pertanto la concentrazione e normalizzando il pH (la PCO2 resterà tuttavia ridotta), e avremo quindi una alcalosi respiratoria compensata.
Una perdita considerevole di ioni H+ (ad esempio tramite un vomito profuso) porterà ad un aumento della concentrazione di ioni bicarbonato e conseguentemente ad un aumento del pH (alcalosi metabolica scompensata): l'organismo reagisce ipoventilando (cosa che aumenta la PCO2), meccanismo che normalizza il pH (in questo caso comunque gli ioni bicarbonato resteranno elevati) e porta ad una alcalosi metabolica compensata.
Bibliografia[modifica | modifica wikitesto]
- Davenport, Horace W. (1974). The ABC of Acid-Base Chemistry: The Elements of Physiological Blood-Gas Chemistry for Medical Students and Physicians (Sixth ed.). Chicago: The University of Chicago Press.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Diagramma di Davenport
Wikimedia Commons contiene immagini o altri file su Diagramma di Davenport