Simmetria molecolare

In chimica, la simmetria molecolare descrive la simmetria presente nelle molecole e la classificazione delle molecole in base alla loro stessa simmetria applicando la teoria dei gruppi. Oltre che trovare applicazione in strutturistica chimica, viene comunemente impiegata per prevedere proprietà chimiche come la chiralità o quelle derivanti dalla presenza di un momento di dipolo molecolare, e per prevedere le transizioni spettroscopiche permesse. Applicando gli stessi concetti di simmetria agli orbitali molecolari è possibile elaborare un approccio integrato con la trattazione quantomeccanica del legame chimico.
Concetti di simmetria
[modifica | modifica wikitesto]
Elementi di simmetria
[modifica | modifica wikitesto]Un elemento di simmetria è un punto, una retta, o un piano che descrivono una data simmetria di una molecola. Esistono 4 elementi di simmetria:[1]
- Asse di simmetria n-ario o asse di rotazione n-ario: asse, simboleggiato Cn, intorno al quale viene effettuata una rotazione di 360°/n che lascia apparentemente inalterata la molecola. Una molecola può possedere più assi di simmetria n-ari: in questo caso l'asse principale rappresenta quello con n maggiore. Ad esempio l'ammoniaca possiede un asse C3 (rotazione di 120°) mentre l'acqua ha un asse C2 (rotazione di 180°); inoltre l'ammoniaca ha anche un asse C23 (rotazione di 240°).
- Piano speculare o piano di simmetria o piano mirror: piano, simboleggiato σ, attraverso il quale una riflessione mantiene inalterata una molecola. Esistono piani verticali (σv, che contengono l’asse di rotazione principale, ad esempio l'acqua ne possiede due), piani orizzontali (σh, perpendicolari all'asse di rotazione principale, ad esempio il benzene ne possiede uno), e piani diedrici (σd, bisecano gli angoli diedri tra due piani verticali).
- Centro di simmetria o centro di inversione: simboleggiato i, indica un punto intorno al quale la proiezione della molecola mantiene quest'ultima inalterata. N2 e SF6 possiedono un centro di simmetria, al contrario della molecola dell'acqua.
- Asse n-ario di rotazione impropria: simboleggiato Sn, rappresenta la combinazione di un asse di rotazione n-ario e di un piano di simmetria perpendicolare. Da notare che S1 corrisponde all'elemento σh, mentre S2 equivale a i.
Operazioni di simmetria
[modifica | modifica wikitesto]Un'operazione di simmetria è un'azione che lascia immutata una molecola.[1] A un'operazione di simmetria è associato uno o più elementi di simmetria. Le principali sono:
- Identità: indicata con E, corrisponde a un'operazione unitaria. L'elemento di simmetria può essere considerato la molecola stessa; questa operazione è caratteristica di tutte le molecole.
- Rotazione n-aria: è l'operazione associata all'asse di rotazione n-ario.
- Riflessione: è l'operazione associata al piano di simmetria.
- Inversione: è l'operazione prodotta proiettando ciascun punto della molecola nella direzione opposta equidistante dal centro di inversione.
- Rotazione impropria: operazione composta ottenuta in seguito a una rotazione n-aria seguita da una riflessione perpendicolare all'asse di rotazione.
Soventemente le operazioni di simmetria sono indicate utilizzando simboli identici a quelli dei rispettivi elementi di simmetria.
Gruppi puntuali
[modifica | modifica wikitesto]Sulla base degli elementi di simmetria posseduti è possibile ascrivere una molecola a un particolare gruppo puntuale; in chimica la notazione comunemente utilizzata consiste nel sistema Schoenflies. Ad esempio un composto quale CHBrClF, caratterizzato dalla sola identità, appartiene al gruppo puntuale C1. Il perossido di idrogeno, oltre all'identità, possiede anche un asse di rotazione binario e pertanto si colloca nel gruppo puntuale C2. La molecola dell'acqua, con un asse di rotazione binario e due piani speculari verticali, appartiene al gruppo C2v, mentre l'ammoniaca possiede un asse C3 e 3σv per cui si colloca nel gruppo C3v. Le molecole lineari come il monossido di carbonio o l'acido cloridrico appartengono invece al gruppo puntuale C∞v; aumentando gli elementi di simmetria si passa a gruppi quali D2h, D3h, D4h... fino a giungere al gruppo tetraedrico Td (del quale fa parte ad esempio il metano), a quello ottaedrico Oh (vi appartengono molecole quali l'esafluoruro di zolfo) e a quello icosaedrico Ih caratteristico del fullerene C60 e di una serie di composti del boro.
In generale, si procede alla determinazione di un gruppo puntuale ricorrendo a un diagramma di flusso in cui il primo passo consiste nel determinare se una molecola è lineare oppure no.
La seguente tabella contiene una lista dei gruppi puntuali con le molecole rappresentative. La descrizione della struttura comprende anche le forme comuni delle molecole basate sulla teoria VSEPR.
| Gruppo puntuale | Operazioni di simmetria | Semplice descrizione di una tipica geometria | Esempio 1 | Esempio 2 | Esempio 3 |
| C1 | E | nessuna simmetria, chirale | 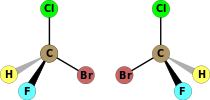 Bromoclorofluorometano |
 Serina |
 D-glucopiranosio |
| Cs | E σh | piano di simmetria, nessun'altra simmetria |  Cloruro di tionile |
 Acido ipocloroso |
 Fluoroiodometano |
| Ci | E i | centro di inversione | (R,R) 1,2-dicloro-1,2-dibromoetano (conformero anti) | ||
| C∞v | E 2C∞ ∞σv | lineare |  Acido fluoridrico |
 Ossido di diazoto |
|
| D∞h | E 2C∞ ∞σi i 2S∞ ∞C2 | lineare con centro di inversione |  Ossigeno |
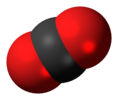 Anidride carbonica |
|
| C2 | E C2 | "geometria a libro aperto", chirale |  Perossido di idrogeno |
 Idrazina |
|
| C3 | E C3 | elica, chirale |  Trifenilfosfina |
||
| C2h | E C2 i σh | planare con centro di inversione |  trans-1,2-dicloroetilene |
||
| C3h | E C3 C32 σh S3 S35 | elica |  Acido borico |
||
| C2v | E C2 σv(xz) σv'(yz) | angolare (H2O) o "ad altalena" (SF4) |  Acqua |
 Tetrafluoruro di zolfo |
 Fluoruro di solforile |
| C3v | E 2C3 3σv | piramidale trigonale |  Ammoniaca |
 Ossicloruro di fosforo |
|
| C4v | E 2C4 C2 2σv 2σd | piramidale quadrata |  Ossitetrafluoruro di xeno |
 Pentafluoruro di bromo |
|
| C6v | E 2C6 2C3 C2 3σv 3σd | piramidale esagonale |  Benzene(esametilbenzene)cromo |
||
| D2 | E C2(x) C2(y) C2(z) | "twist", chirale | Cicloesano (conformazione "twist") | ||
| D3 | E C3(z) 3C2 | tripla elica, chirale |  Catione tris(etilendiammina)cobalto(III) |
||
| D2h | E C2(z) C2(y) C2(x) i σ(xy) σ(xz) σ(yz) | planare con centro di inversione |  Etilene |
 Tetraossido di diazoto |
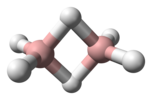 Diborano |
| D3h | E 2C3 3C2 σh 2S3 3σv | planare trigonale o bipiramidale trigonale |  Trifluoruro di boro |
 Pentacloruro di fosforo |
|
| D4h | E 2C4 C2 2C22C2 i 2S4 σh 2σv 2σd | planare quadrata |  Tetrafluoruro di xeno |
 Anione octacloromolibdeno(III) |
|
| D5h | E 2C5 2C52 5C2 σh 2S5 2S53 5σv | pentagonale | 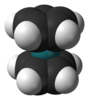 Rutenocene |
 C70 |
|
| D6h | E 2C6 2C3 C2 3C2' 3C2‘' i 2S3 2S6 σh 3σd 3σv | esagonale | 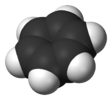 Benzene |
 Dibenzenecromo |
|
| D8h | E 2C8 2C4 2C83 C2 4C2' 4C2‘' i 2S83 2S4 2S8 σh 4σd 4σv | ottagonale |  Uranocene |
||
| D2d | E 2S4 C2 2C2' 2σd | "90° twist" | 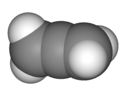 Propadiene |
 Tetranitruro di tetrazolfo |
|
| D3d | E C3 3C2 i 2S6 3σd | "60° twist" |  Etano (rotamero sfalsato) |
 Cicloesano (conformazione "a sedia") |
|
| D4d | E 2S8 2C4 2S83 C2 4C2' 4σd | "45° twist" |  Decacarbonile di dimanganese (rotamero sfalsato) |
 Zolfo-α (rotamero sfalsato) |
|
| D5d | E 2C5 2C52 5C2 i 3S103 2S10 5σd | "36° twist" |  Ferrocene (rotamero sfalsato) |
||
| D6d | E 2S12 2C6 2S4 2C3 2S125 C2 6C2' 6σd | "30° twist" |  Dibenzenecromo (rotamero sfalsato) |
||
| S4 | E S4 C2 S43 | asse improprio S4 |  Tetrafenilmetano |
 12-corona-4 |
 1,3,5,7-tetrabromo-2,4,6,8-tetrametil-cicloottano |
| S6 | E C3 C32 i S65 S6 | asse improprio S6 |  [6,5]coronano |
 18-corona-6 |
|
| S8 | E S8 C4 S83 C2 S85 C43 S87 | asse improprio S8 | |||
| S10 | E C5 C52 C53 C54 i S107 S109 S10 S103 | asse improprio S10 | |||
| Td | E 8C3 3C2 6S4 6σd | tetraedrico |  Metano |
 Anidride fosforica |
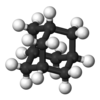 Adamantano |
| Oh | E 8C3 6C2 6C4 3C2 i 6S4 8S6 3σh 6σd | ottaedrico o cubico |  Cubano |
 Esafluoruro di zolfo |
 Esafluoruro di uranio |
| Ih | E 12C5 12C52 20C3 15C2 i 12S10 12S103 20S6 15σ | icosaedrico o dodecaedrico |  Buckminsterfullerene |
 Anione dei dodecaborani |
 Dodecaedrano |
Tavole dei caratteri
[modifica | modifica wikitesto]Le tavole dei caratteri sono utilizzate per elencare sinteticamente il risultato delle operazioni di simmetria e i relativi tipi di simmetria caratteristici di uno specifico gruppo puntuale. Sono molto utili dal punto di vista pratico, ad esempio per determinare in modo relativamente agevole quali orbitali possono combinarsi in un legame chimico, considerando che si combinano gli orbitali che presentano medesima simmetria.
Per ricavare le tavole dei caratteri bisogna esprimere le operazioni di simmetria nella notazione matriciale. Dato un set base di partenza è possibile ottenere una cosiddetta matrice rappresentativa per ogni operazione di simmetria. Ad esempio partendo da un insieme di tre orbitali di valenza p (indicati come pA, pB e pC), nel gruppo puntuale C2v considerando un'operazione σv si ottiene l'insieme (pA, pC, pB). In termini matriciali ciò equivale alla moltiplicazione
dove D(σv) è la matrice rappresentativa. Se la trasformazione di base permette che tale matrice sia fattorizzabile in una matrice a blocchi diagonale, allora si è in presenza di una rappresentazione riducibile che per successive fattorizzazioni fornisce infine una rappresentazione monodimensionale irriducibile. I caratteri sono ottenuti proprio da queste rappresentazioni irriducibili.
Riassumendo quanto detto sopra, nel caso del gruppo puntuale C2v qui considerato si perviene alla seguente tavola dei caratteri:
| C2v | E | C2 | σv | σv' | h=4 | |
|---|---|---|---|---|---|---|
| A1 | 1 | 1 | 1 | 1 | z | x2, y2, z2 |
| A2 | 1 | 1 | −1 | −1 | Rz | xy |
| B1 | 1 | −1 | 1 | −1 | x, Ry | xz |
| B2 | 1 | −1 | −1 | 1 | y, Rx | yz |
La prima colonna indica i tipi di simmetria: le lettere A e B indicano rappresentazioni monodimensionali; quando la rotazione intorno l'asse principale ha il carattere +1 si utilizza la lettera A, mentre quando ha il carattere −1 si utilizza la lettera B. A1 indica la rappresentazione che possiede tutti caratteri con valore +1. Quando esistono rappresentazioni di ordine maggiore si utilizzano rispettivamente la lettera E nel caso di rappresentazioni bidimensionali e la lettera T per rappresentazioni tridimensionali. Da notare che gli orbitali che possiedono una data simmetria sono invece indicati con stesse lettere però in minuscolo. Le colonne successive elencano le operazioni di simmetria (riunite in classi) e i rispettivi caratteri delle rappresentazioni irriducibili: il carattere +1 indica la conservazione della simmetria, mentre il valore −1 indica l'antisimmetria. La colonna in cui compare h=4 indica nell'intestazione l'ordine del gruppo (il numero totale di operazioni di simmetria) e la base della rappresentazione irriducibile (orbitali px, py, pz o la rotazione R attorno a un asse cartesiano). L'ultima colonna indica le basi analoghe per le funzioni di secondo grado (gli orbitali d).
Le tavole dei caratteri per ciascun gruppo puntuale sono raccolte in pubblicazioni scientifiche specialistiche.
Note
[modifica | modifica wikitesto]Bibliografia
[modifica | modifica wikitesto]- D.F. Shriver, P.W Atkins; C.H. Langford, Chimica inorganica, Zanichelli, 1993, ISBN 978-88-08-12624-5.
- F.A. Cotton, Chemical Applications of Group Theory, Wiley-Interscience, 1990, ISBN 978-0-471-51094-9.
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) Tavole dei caratteri dei gruppi puntuali, su webqc.org.
