Ammonio quaternario
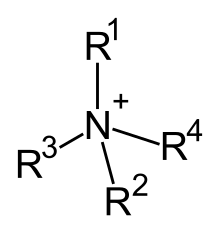
L'ammonio quaternario è un catione organico di formula generale R4N+, nel quale un atomo di azoto carico positivamente è direttamente legato a quattro gruppi organici R, alchilici o arilici. A differenza degli altri ioni ammonio, il catione quaternario in sé non ha apprezzabile acidità. L'eventuale reazione acido-base dipende esclusivamente dall'anione associato nei suoi sali (vide infra), oppure dalla eventuale, particolare struttura dei gruppi sostituenti.
Gli ioni ammonio con i quattro gruppi differenti sono chirali ed esistono in due forme otticamente attive separabili.
A causa della carica netta positiva, si trovano in natura sotto forma di sali (R4N+X−) più o meno solubili in acqua a seconda della natura dei gruppi sostituenti. Gli ioni ammonio quaternari con sostituenti a catena lunga hanno carattere anfifilico e si comportano da tensioattivi, fattore che conferisce a tali composti proprietà detergenti e battericide.
Sintesi
[modifica | modifica wikitesto]I sali di ammonio quaternario si possono ottenere per alchilazione di un'ammina terziaria ed un alogenuro alchilico, spesso nota nella letteratura antica come reazione di Menšutkin anche se attualmente vi si fa riferimento come reazione di quaternarizzazione. La reazione può essere usata per produrre un composto con lunghezze di catena alchilica diverse; per esempio nel caso dei tensioattivi cationici uno dei gruppi alchilici sull'ammina è tipicamente più lungo degli altri.[1] Una sintesi tipica è il cloruro di benzalconio ottenuto da una alchildimetilammina e benzil cloruro:
- CH3(CH2)nN(CH3)2 + ClCH2C6H5 → [CH3(CH2)nN(CH3)2CH2C6H5]+Cl−
Reazioni
[modifica | modifica wikitesto]I cationi di ammonio quaternario non sono reattivi verso elettrofili anche forti, gli ossidanti e gli acidi. Essi sono pure stabili verso la maggior parte dei nucleofili. Quest'ultimo è indicato dalla stabilità dei loro idrossidi come l'idrossido di tetrametilammonio e l'idrossido di tetrabutilammonio. A causa della loro resilienza, molti anioni insoliti sono stati isolati come controioni in sali di ammonio quaternari. Gli esempi includono tetrametilammonio pentafluoroxenato, contenente lo ione pentafluoroxenato altamente reattivo (XeF−5). Il permanganato può essere solubilizzato in solventi organici, se utilizzato come sale di ammonio NBu+4.[2][3]
Subiscono degradazione con basi eccezionalmente forti. Subiscono il riarrangiamento di Sommelet-Hauser e quello di Stevens,[4] nonché dealchilazione in condizioni difficili. Cationi di ammonio quaternario aventi almeno un idrogeno in posizione beta, contenenti cioè unità N-C-C-H, possono anche subire l'eliminazione di Hofmann, formando alcheni ed ammine, e la degradazione di Emde.
Applicazioni
[modifica | modifica wikitesto]I sali di ammonio quaternario sono usati come disinfettanti, tensioattivi, ammorbidenti, colliri[5] e agenti antistatici (ad esempio, negli shampoo). In ammorbidenti liquidi, sono spesso utilizzati i sali clorurati.
Come antimicrobici
[modifica | modifica wikitesto]I composti di ammonio quaternario hanno dimostrato di avere attività antimicrobica.[6] Alcuni composti di ammonio quaternario, in particolare quelli contenenti catene alchiliche lunghe, vengono usati come antimicrobici e disinfettanti. Alcuni esempi sono il benzalconio cloruro, il benzetonio cloruro, il cetrimonio, la cetrimide e il bromuro di tetraetilammonio. Sono efficienti anche contro i funghi, le amebe e i virus con involucro. I composti di ammonio quaternario sono infatti letali per una vasta gamma di organismi, tranne le endospore, il Mycobacterium tuberculosis e virus senza involucro.
I composti di ammonio quaternario sono detergenti cationici, nonché disinfettanti, e come tali possono essere utilizzati per rimuovere materiale organico. Essi sono molto efficaci in combinazione con fenoli anche se, in presenza di detergenti anionici (compresi i saponi comuni), i composti di ammonio quaternario vengono disattivati.
Come catalizzatori a trasferimento di fase
[modifica | modifica wikitesto]In chimica organica, i sali di ammonio quaternario sono impiegati come catalizzatori di trasferimento di fase (CTF).[7] Tali catalizzatori accelerano reazioni tra reagenti disciolti in solventi immiscibili tra di loro. Ad esempio, il diclorocarbene altamente reattivo viene generato per reazione tra cloroformio e idrossido di sodio acquoso tramite l'aggiunta di sali di questo tipo; la reazione avviene all'interfaccia tra la soluzione organica in cloroformio e quella acquosa, soluzioni tra loro non mutuamente miscibili.[8]
Come ammorbidenti
[modifica | modifica wikitesto]Nel 1950, il distearildimetilammonio cloruro (DSDMAC) è stato introdotto come ammorbidente. Tuttavia il suo uso è cessato perché il catione si biodegrada troppo lentamente. Gli ammorbidenti contemporanei sono a base di sali di cationi di ammonio quaternario in cui l'acido grasso è collegato al centro quaternario mediante legami esterei; questi sono comunemente indicati come esteri della betaina e sono suscettibili di degradazione, ad esempio, per idrolisi.[9] Tipicamente, i cationi contengono uno o due lunghe catene alchiliche derivate da acidi grassi legati ad un sale di ammonio etossilato.[10] Altri composti cationici possono essere derivati da sali di ammonio dell'imidazolo o della guanidina.
- Tensioattivi cationici usati come ammorbidenti
-
Distearildimetilammonio cloruro, un ammorbidente di prima generazione non più usato per la sua scarsa biodegradabilità.
-
Un esempio di diestere quaternario usato come ammorbidente
-
Il dietil e il dimetil ammonio cloruro, noti ammorbidenti
-
Un altro esempio di diestere quaternario usato come ammorbidente
Come osmoliti
[modifica | modifica wikitesto]
Alcuni composti di ammonio quaternario sono presenti come osmoliti, specificamente nella glicina betaina, che stabilizzano la pressione osmotica nelle cellule.[11]
Come ritardanti della crescita delle piante
[modifica | modifica wikitesto]Il Cycocel (clormequat cloruro) riduce l'altezza della pianta inibendo la produzione di gibberelline, che costituiscono gli ormoni primari responsabili per l'allungamento delle cellule. Pertanto, i loro effetti sono principalmente sugli stami, il picciolo e il peduncolo. Sono stati visti effetti minori quali riduzioni di espansione della foglia, con conseguenti foglie spesse con colore verde più scuro.[12]
Effetti sulla salute
[modifica | modifica wikitesto]I composti di ammonio quaternario sono in grado di comportare una serie di effetti sulla salute, tra i quali vi sono l'irritazione delle vie respiratorie e della pelle[13] fino a gravi ustioni caustiche sulla pelle e nel tratto gastrointestinale (a seconda della concentrazione),altri sintomi gastrointestinali (ad esempio, nausea e vomito), coma, convulsioni, ipotensione e la morte.[14] Inoltre, comportano la morte degli oligodendrociti.[15]
Si pensa sia la sostanza responsabile delle reazioni anafilattiche che si verificano con l'uso di miorilassanti durante l'anestesia generale in chirurgia.[16] Il Quaternium-15 è la sostanza singola più spesso trovata come causa di dermatite allergica da contatto delle mani (16,5% nel 959 casi).[17]
Possibili effetti sulla riproduzione negli animali da laboratorio
[modifica | modifica wikitesto]Disinfettanti a base di sali quaternari di ammonio (come Virex e Quatricide) sono stati provvisoriamente identificati come la causa più probabile di difetti di nascita e problemi di fertilità nei topi di laboratorio in gabbia.[18]
Quantificazione analitica
[modifica | modifica wikitesto]La quantificazione di composti di ammonio quaternario in campioni ambientali e biologici è problematica mediante tecniche cromatografiche convenzionali, perché i composti sono molto solubili in acqua. Invece, analizzandoli mediante cromatografia liquida tandem spettrometria di massa (HPLC-MS), è stato trovato che seguono una regola particolare. Utilizzando una ionizzazione elettrospray (ESI), si è scoperto che i composti di ammonio quaternario formano ioni molecolari talvolta con rapporto massa su carica (m/z) maggiore rispetto allo ione molecolare di partenza, portando quindi a degli errori nella lettura dello spettro.[19]
Note
[modifica | modifica wikitesto]- ^ (EN) Kurt Kosswig, Surfactants, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 1º gennaio 2000, DOI:10.1002/14356007.a25_747, ISBN 9783527306732. URL consultato il 28 agosto 2016.
- ^ (EN) Arthur W. Herriott, Purple benzene: Solubilization of anions in organic solvents, in Journal of Chemical Education, vol. 54, n. 4, 1º aprile 1977, DOI:10.1021/ed054p229.1. URL consultato il 28 agosto 2016.
- ^ (EN) Anthony J. Doheny e Bruce Ganem, Purple benzene revisited, in Journal of Chemical Education, vol. 57, n. 4, 1º aprile 1980, DOI:10.1021/ed057p308.1. URL consultato il 28 agosto 2016.
- ^ (EN) Stanley H. Pine, The Base-Promoted Rearrangements of Quaternary Ammonium Salts, in Organic Reactions, John Wiley & Sons, Inc., 1º gennaio 2004, DOI:10.1002/0471264180.or018.04, ISBN 9780471264187. URL consultato il 28 agosto 2016.
- ^ http://www.onmedicine.it/articolo.php?id=15&nr=12018&t=app
- ^ Zhishen Jia, Dongfeng shen e Weiliang Xu, Synthesis and antibacterial activities of quaternary ammonium salt of chitosan, in Carbohydrate Research, vol. 333, n. 1, 22 giugno 2001, pp. 1-6, DOI:10.1016/S0008-6215(01)00112-4. URL consultato il 28 agosto 2016.
- ^ In inglese la sigla è PTC, da Phase-transfer Catalists.
- ^ (EN) Charles M. Starks, Phase-transfer catalysis. I. Heterogeneous reactions involving anion transfer by quaternary ammonium and phosphonium salts, in Journal of the American Chemical Society, vol. 93, n. 1, 1971-01, pp. 195–199, DOI:10.1021/ja00730a033. URL consultato il 26 agosto 2023.
- ^ (EN) Per-Erik Hellberg, Karin Bergström e Krister Holmberg, Cleavable surfactants, in Journal of Surfactants and Detergents, vol. 3, n. 1, pp. 81-91, DOI:10.1007/s11743-000-0118-z. URL consultato il 28 agosto 2016.
- ^ Dichiarazione degli ingredienti secondo il Regolamento Detergenti (EC No 648/2004), su henkelconsumerinfo.com. URL consultato il 28 agosto 2016 (archiviato dall'url originale il 6 settembre 2016).
- ^ (EN) Roy D. Sleator, Jeroen Wouters e Cormac G. M. Gahan, Analysis of the Role of OpuC, an Osmolyte Transport System, in Salt Tolerance and Virulence Potential of Listeria monocytogenes, in Applied and Environmental Microbiology, vol. 67, n. 6, 1º giugno 2001, pp. 2692-2698, DOI:10.1128/AEM.67.6.2692-2698.2001. URL consultato il 28 agosto 2016.
- ^ Growth Retardants, su users.in.gr, 25 settembre 2011. URL consultato il 28 agosto 2016 (archiviato dall'url originale il 25 settembre 2011).
- ^ Anila Bello, Margaret M. Quinn e Melissa J. Perry, Characterization of occupational exposures to cleaning products used for common cleaning tasks-a pilot study of hospital cleaners, in Environmental Health, vol. 8, 1º gennaio 2009, p. 11, DOI:10.1186/1476-069X-8-11. URL consultato il 28 agosto 2016.
- ^ Quaternary ammonium (PIM G022), su inchem.org. URL consultato il 28 agosto 2016.
- ^ AGI-Agenzia Italia, Alcuni prodotti di uso comune fanno male al nostro cervello, ecco perché, su www.agi.it, 2 aprile 2024. URL consultato il 25 aprile 2024.
- ^ (EN) Membership of the Working Party, N J N Harper e T Dixon, Suspected Anaphylactic Reactions Associated with Anaesthesia, in Anaesthesia, vol. 64, n. 2, 1º febbraio 2009, pp. 199-211, DOI:10.1111/j.1365-2044.2008.05733.x. URL consultato il 28 agosto 2016.
- ^ Erin M. Warshaw, Rehana L. Ahmed e Donald V. Belsito, Contact dermatitis of the hands: Cross-sectional analyses of North American Contact Dermatitis Group Data, 1994-2004, in Journal of the American Academy of Dermatology, vol. 57, n. 2, pp. 301-314, DOI:10.1016/j.jaad.2007.04.016.
- ^ (EN) Brendan Maher, Lab disinfectant harms mouse fertility, in Nature News, vol. 453, n. 7198, 18 giugno 2008, pp. 964-964, DOI:10.1038/453964a. URL consultato il 28 agosto 2016.
- ^ Thirumurthy Velpandian, Jayabalan Nirmal e Beauty Arora, Understanding the Charge Issues in Mono and di-Quaternary Ammonium Compounds for Their Determination by LC/ESI-MS/MS, in Analytical Letters, vol. 45, n. 16, 1º novembre 2012, pp. 2367-2376, DOI:10.1080/00032719.2012.693140. URL consultato il 28 agosto 2016.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su Sale di ammonio quaternario
Wikimedia Commons contiene immagini o altri file su Sale di ammonio quaternario
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) quaternary ammonium compound, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.