Uranile


Lo ione uranile è un catione poliatomico di formula [UO2]2+.
È una specie chimica ben caratterizzata, ha una struttura lineare con legami U–O corti, indice della presenza di legami multipli tra uranio e ossigeno. Lo stato di ossidazione dell'uranio è +6. I composti che contengono lo ione uranile sono in genere di colore giallo. Lo ione uranile può formare molti complessi, specie con leganti che utilizzano atomi donatori di ossigeno. I complessi dello ione uranile sono importanti nell'estrazione dell'uranio dai suoi minerali e nel riprocessamento del combustibile nucleare.
Struttura e legami[modifica | modifica wikitesto]
Lo ione uranile è lineare con simmetria D∞h, con distanze U–O di circa 180 pm. Queste distanze di legame indicano la presenza di un legame multiplo tra gli atomi di uranio e ossigeno. L'uranio nello stato di ossidazione +6 ha configurazione elettronica [Rn], e quindi gli elettroni usati per formare i legami provengono dagli atomi di ossigeno. In genere si considera che i tre orbitali p dell'ossigeno si combinino con gli orbitali 6d e 5f dell'uranio in modo da fornire un legame σ e due legami π. Ne risultano tre legami fra U ed O, come da figura.[1]
Lo ione uranile è sempre accompagnato ad una componente anionica, che in forma solida si dispone nel piano equatoriale della molecola (cioè quello perpendicolare all'asse O–U–O e passante per l'atomo di uranio).
I leganti aggiuntivi possono essere quattro, cinque o sei; ne risultano rispettivamente strutture ottaedriche, a bipiramide pentagonale, e a bipiramide esagonale.[1]
Spettroscopia[modifica | modifica wikitesto]
I composti che contengono lo ione uranile sono in genere di colore giallo, ma possono essere anche di colore rosso, arancio e verde. In quelli gialli il colore è dovuto ad una banda a trasferimento di carica LMCT a circa 420 nm, all'estremità blu dello spettro visibile.[2][3] La posizione esatta della banda di assorbimento e delle bande XANES dipende dalla natura dei leganti equatoriali.[4]
Lo ione uranile è luminescente, con una banda di emissione nell'intervallo 450-650 nm. Il primo studio sulla luminescenza verde del vetro all'uranio fu condotto da David Brewster nel 1849.[5] In seguito sono stati condotti numerosissimi studi e si è stabilito che la luminescenza è classificabile come fosforescenza, dato che è originata dalla transizione dal più basso stato eccitato di tripletto allo stato fondamentale di singoletto.[6] La luminescenza di K2UO2(SO4)2 è implicata nella scoperta della radioattività.
Lo ione uranile ha frequenze di stiramento caratteristiche a circa 880 cm−1 (spettro Raman) e circa 950 cm−1 (spettro IR). Le frequenze sono un po' influenzate dalla natura dei leganti presenti nel piano equatoriale. Le frequenze di stiramento sono correlate con la distanza di legame U–O. Si è anche osservato che le frequenze di stiramento sono correlate con la posizione dei leganti equatoriali nella serie spettrochimica.[7]
Reattività[modifica | modifica wikitesto]
Lo ione uranile in acqua è stabile e mantiene la sua identità in molte reazioni, ma la sua chimica è complicata per la simultanea presenza di reazioni di complessazione e di idrolisi. La specie predominante è quella con cinque molecole d'acqua coordinate; esiste anche una piccola percentuale di ioni uranile coordinati a quattro molecole d'acqua.[8] Soluzioni dello ione uranile in acqua sono acide a causa dell'idrolisi. Gli equilibri di idrolisi sono piuttosto complicati, con formazione di specie anche polimeriche, e sono influenzati dal pH e dalla presenza di altri ioni; le specie più importanti sono [UO2OH]+, [(UO2)2(OH)2]2+ e [(UO2)3(OH)5]+.[1][9]
Lo ione uranile è abbastanza resistente alla riduzione, ma può essere ridotto a U4+ con Cr2+, e a U3+ con amalgama di zinco o per via elettrolitica. Sia U4+ che U3+ in presenza di aria sono riossidati a [UO2]2+. La corrispondente specie di U(V), [UO2]+ è invece molto instabile e dà luogo a dismutazione.[9]
Per irradiazione con luce visibile si forma lo stato eccitato *[UO2]2+ che è luminescente ed è un ossidante molto forte (E° = 2,6 V).[9]
Complessi[modifica | modifica wikitesto]
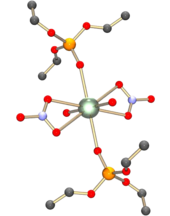
Lo ione uranile si comporta da acido hard e quindi forma complessi più stabili con lo ione fluoruro e leganti con atomi donatori di ossigeno, come gli ioni idrossido, nitrato, solfato e carbossilato. Anche molecole neutre come acqua e fosfinossidi possono legarsi in modo analogo. Il complesso formato può contenere quattro, cinque o sei atomi coordinati nel piano equatoriale. Ad esempio il nitrato di uranile, [UO2(NO3)2]•2H2O, contiene sei atomi coordinati nel piano equatoriale: quattro dai leganti nitrato legati in modo bidentato, e due dalle due molecole di acqua. L'atomo di uranio risulta così al centro di una struttura a bipiramide esagonale,[1] simile a quella illustrata a fianco per UO2(NO3)2•2OP(OC2H5).
Presenza in natura[modifica | modifica wikitesto]
A riprova della stabilità dello ione [UO2]2+, lo si trova in natura in molti minerali. Alcuni esempi sono:
- Carnotite K2(UO2)2V2O8·3(H2O)
- Autunite Ca(UO2)2(PO4)2·10-12(H2O)
- Torbernite Cu(UO2)2(PO4)2·8-12(H2O)
- Uranofano Ca(UO2)2(SiO3OH)2·5H2O
- Coffinite U(SiO4)1-x(OH)4x
Questi minerali sono di scarsa importanza commerciale; la maggior parte dell'uranio viene estratta dalla pechblenda, che è sostanzialmente UO2 contaminata da UO3 e ossidi di altri elementi.
Usi[modifica | modifica wikitesto]
Il nitrato di uranile, UO2(NO3)2, è importante nei processi di purificazione dell'uranio perché può essere estratto in solventi non polari a partire da soluzioni di acido nitrico.[1][9]
L'ossalato di uranile era usato come attinometro prima dell'introduzione del ferriossalato di potassio.[10]
Sali di uranile sono usati per colorare campioni per studi di microscopia elettronica sul DNA.[11]
Tossicologia[modifica | modifica wikitesto]
I sali di uranile sono tossici e possono causare grave insufficienza renale e necrosi tubulare acuta. Tra gli organi bersaglio ci sono reni, fegato, polmoni e cervello. Accumulo di ioni uranile nei gonociti provoca malattie congenite,[12] e nei globuli bianchi del sangue provoca danni al sistema immunitario.[13] I composti contenenti uranile sono anche neurotossine. Contaminazione da ioni uranile è stata rilevata nei pressi di bersagli colpiti con uranio impoverito.[14]
Tutti i composti di uranio sono radioattivi. Tuttavia l'uranio in genere è disponibile nella forma impoverita, tranne che nell'ambito dell'industria nucleare. L'uranio impoverito è costituito principalmente da 238U che decade con un tempo di dimezzamento di 4,47 × 109 anni. Dato che emette deboli radiazioni alfa, la sua radioattività è pericolosa solo per contatto diretto o per ingestione.
Note[modifica | modifica wikitesto]
- ^ a b c d e Greenwood e Earnshaw (1997)
- ^ Umreiko 1965
- ^ Berto et al. 2006
- ^ Fillaux et al. 2010
- ^ Brewster 1849
- ^ Balzani e Carassiti 1970
- ^ Nakamoto 1997
- ^ Hagberg et al. 2005
- ^ a b c d Cotton et al. 1999
- ^ Montalti et al. 2006
- ^ Zobel e Beer 1961
- ^ Arfsten et al. 2001
- ^ Schröder et al. 2003
- ^ Salbu et al. 2004
Bibliografia[modifica | modifica wikitesto]
- D. P. Arfsten, K. R. Still e G. D. Ritchie, A review of the effects of uranium and depleted uranium exposure on reproduction and fetal development, in Toxicol. Ind. Health, vol. 17, 5–10, 2001, pp. 180–191, DOI:10.1191/0748233701th111oa.
- V. Balzani e V. Carassiti, Photochemistry of coordination compounds, Londra, Academic Press, 1970, ISBN 0-12-077250-7.
- S. Berto, F. Crea, P. G. Daniele, C. de Stefano, E. Prenesti e S. Sammartano, Dioxouranium(VI) – Carboxylate Complexes. Interaction with Dicarboxylic Acids in Alqueous Solution: Speciation and Structure, in Ann. Chim., vol. 96, n. 78, 2006, p. 399420, DOI:10.1002/adic.200690042.
- D. Brewster, Trans. R. Soc. Edinburgh, vol. 6, 1849, pp. 111–121.
- F. A. Cotton, G. Wilkinson, C. A. Murillo e M. Bochmann, Advanced Inorganic Chemistry, 6ª ed., Wiley-Interscience, 1999, ISBN 978-0-471-19957-1.
- C. Fillaux, D. Guillaumont, J.-C. Berthet, R. Copping, D. K. Shuh, T. Tyliszczak e C. Den Auwer, Investigating the electronic structure and bonding in uranyl compounds by combining NEXAFS spectroscopy and quantum chemistry, in Phys. Chem. Chem. Phys., vol. 12, 2010, pp. 14253–14262, DOI:10.1039/C0CP00386G.
- N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- D. Hagberg, G. Karlström, B. O. Roos e L. Gagliardi, The Coordination of Uranyl in Water: A Combined Quantum Chemical and Molecular Simulation Study, in J. Am. Chem. Soc., vol. 127, n. 41, 2005, pp. 14250–14256, DOI:10.1021/ja0526719.
- M. Montalti, A. Credi, L. Prodi, M. T. Gandolfi, Handbook of photochemistry, 3ª ed., Boca Raton, CRC Press, 2006, ISBN 0-8247-2377-5.
- K. Nakamoto, Infrared and Raman spectra of Inorganic and Coordination compounds, Parte A, 5ª ed., Wiley, 1997, ISBN 0-471-16394-5. Parte B, ISBN 0-471-16392-9.
- B. Salbu, K. Janssens, O.C. Lind, K. Proost, L. Gijsels e P.R. Danesi, Oxidation states of uranium in depleted uranium particles from Kuwait, in J. Environ. Radioactivity, vol. 78, n. 2, 2004, pp. 125–135, DOI:10.1016/j.jenvrad.2004.04.001.
- H. Schröder, A. Heimers, R. Frentzel-Beyme, A. Schott e W. Hoffman, Chromosome Aberration Analysis in Peripheral Lymphocytes of Gulf War and Balkans War Veterans (PDF), in Radiation Protection Dosimetry, vol. 103, n. 3, 2003, pp. 211–219. URL consultato il 5 marzo 2012 (archiviato dall'url originale l'8 gennaio 2014).
- D. S. Umreiko, Symmetry in the electronic absorption spectra of uranyl compounds, in J. Appl. Spectrosc., vol. 2, n. 5, 1965, pp. 302–304, DOI:10.1007/BF00656800.
- C. R. Zobel e M. Beer, Electron Stains I. Chemical Studies on the Interaction of DNA with Uranyl Salts, in J. Cell Biol., vol. 10, n. 3, 1961, pp. 335–346, DOI:10.1083/jcb.10.3.335. URL consultato il 2 marzo 2012.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Uranile
Wikimedia Commons contiene immagini o altri file su Uranile
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) uranyl ion, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.