Ionone
| Ionone | |
|---|---|
 | |
| Nome IUPAC | |
| (3E)-4-(2,6,6-trimetil-2-cicloesen-1-il)-3-buten-2-one (α-ionone) (3E)-4-(2,6,6-trimetil-1-cicloesen-1-il)-3-buten-2-one (β-ionone) (3E)-4-(2,2-dimetil-6-metilenecicloesil)-3-buten-2-one (γ-ionone) | |
| Nomi alternativi | |
| Ciclocitrilideneacetone Irisone | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C13H20O |
| Massa molecolare (u) | 192,30 |
| Aspetto | liquido da incolore a giallastro |
| Numero CAS | |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,93 (α-ionone) 0,95 (β-ionone) |
| Solubilità in acqua | poco solubile |
| Temperatura di fusione | 224,15 K (-49 °C) (β-ionone) |
| Temperatura di ebollizione | 510,15 K (237 °C) (α-ionone) |
| Indicazioni di sicurezza | |
| Frasi H | -- |
| Consigli P | -- |
Ionone è il nome di una serie di composti chimici, tutti isomeri strutturali, che rappresentano una classe di sostanze odoranti presenti in diversi oli essenziali incluso l'olio di rosa. Chimicamente sono dei chetoni, noti come α-ionone (numero CAS 127-41-3), β-ionone (numero CAS 79-77-6) e γ-ionone (numero CAS 79-76-5).
L'isomero β è il principale responsabile dell'aroma di rose, sebbene presente a relativamente basse concentrazioni, e costituisce un'importante fragranza usata in profumeria.[1] La combinazione di α-ionone e β-ionone è caratteristica del profumo di viole e viene utilizzata, insieme ad altri componenti, per ricrearne il tipico profumo e aroma.[2][3]
Biochimica[modifica | modifica wikitesto]
In natura gli iononi sono sintetizzati per scissione dei carotenoidi mediata dalle carotenoide diossigenasi:[4]

Affinché i carotenoidi possano essere considerati precursori della vitamina A, con la sintesi di retinolo e retinale da parte degli animali che si nutrono di vegetali, è necessario che la loro struttura presenti almeno un anello di β-ionone non sostituito.[5] Questo è il caso, ad esempio, dei caroteni α-carotene, β-carotene, γ-carotene e della xantofilla β-criptoxantina.
Sintesi organica[modifica | modifica wikitesto]
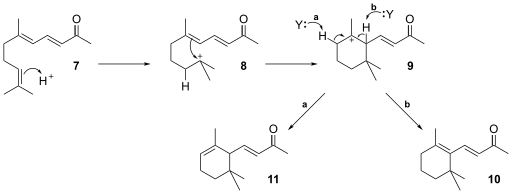
Lo ionone può essere sintetizzato a partire da citrale e acetone con l'aggiunta di ossido di calcio che funge da catalizzatore, seguendo un meccanismo che consiste in una condensazione aldolica seguita da una reazione di riarrangiamento.[6][7]
L'addizione nucleofila del carbanione (3) dell'acetone (1) al gruppo carbonilico del citrale (4) è catalizzata da una base (2). Il prodotto della condensazione aldolica (5) elimina un atomo di idrogeno formando acqua, dando origine a un enolato (6) che a sua volta forma lo pseudoionone (7).
La reazione procede adesso attraverso catalisi acida, con formazione di un carbocatione (8) che subisce un riarrangiamento originando un anello (9). Infine l'estrazione di un atomo di idrogeno, da parte di un accettore, genera il β-ionone (10) e l'α-ionone (11).
Note[modifica | modifica wikitesto]
- ^ John Leffingwell, Rose (Rosa damascena), in Leffingwell Reports, vol. 1, n. 3, 2000, pp. 1-3.
- ^ T. Curtis e D.G. Williams, Introduction to Perfumery, 2ª ed., Micelle Press, 2001, ISBN 9781870228244.
- ^ (EN) B. Jensen, Violet, su bojensen.net. URL consultato il 1º settembre 2017.
- ^ S. Baldermann, M. Kato, M. Kurosawa, Y. Kurobayashi, A. Fujita, P. Fleischmann e N. Watanabe, Functional characterization of a carotenoid cleavage dioxygenase 1 and its relation to the carotenoid accumulation and volatile emission during the floral development of Osmanthus fragrans Lour, in Journal of Experimental Botany, vol. 61, n. 11, 2010, pp. 2967–2977, DOI:10.1093/jxb/erq123, PMID 20478967.
- ^ Srinivasan Damodaran, Kirk L. Parkin e Owen R. Fennema, Fennema's Food Chemistry, 4ª ed., CRC Press, 2008, p. 454, ISBN 0-8493-9272-1.
- ^ C. Noda, G.P. Alt, R.M. Werneck, C.A. Henriques e J.L.F. Monteiro, Aldol condensation of citral with acetone on basic solid catalysts, in Brazilian Journal Chemical Engineering, vol. 15, n. 2, 1998, DOI:10.1590/S0104-66321998000200004.
- ^ A. Russell e R.L. Kenyon, Pseudoionone, in Organic Syntheses, vol. 23, 1943, p. 78, DOI:10.15227/orgsyn.023.0078.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Ionone
Wikimedia Commons contiene immagini o altri file su Ionone
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) ionone, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.