Trimetilfosfina
| Trimetilfosfina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Trimetilfosfano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H9P |
| Massa molecolare (u) | 76,08 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 209-823-1 |
| PubChem | 68983 |
| SMILES | CP(C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,735 |
| Indice di rifrazione | 1,428 |
| Temperatura di fusione | –86 °C (187 K) |
| Temperatura di ebollizione | 38–39 °C (311–312 K) |
| Tensione di vapore (Pa) a 20 °C K | 49,9 kPa |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| Frasi H | H225, H315, H319, H335 |
| Consigli P | P210, P261, P305+351+338 |
La trimetilfosfina (trimetilfosfano secondo la nomenclatura IUPAC) è un composto di organofosforo(III) con formula P(CH3)3, comunemente abbreviata come PMe3. In condizioni normali è un liquido incolore con un forte odore sgradevole, caratteristico delle fosfine alchiliche. Nella chimica metallorganica è un legante di uso comune.
Storia[modifica | modifica wikitesto]
La trimetilfosfina fu sintetizzata per la prima volta nel 1847 da Paul Thénard, figlio del più famoso chimico Louis Jacques Thénard, facendo reagire ad alta temperatura cloruro di metile con fosfuro di calcio impuro.[1]
Struttura[modifica | modifica wikitesto]
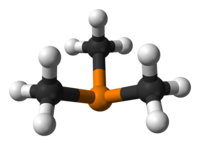
La molecola di trimetilfosfina ha forma piramidale, con simmetria molecolare approssimativamente C3v, cioè appartiene allo stesso gruppo puntuale di ammoniaca (NH3) e fosfina (PH3). Gli angoli C–P–C sono di circa 98,6°.[2] Questo angolo è consistente con il fatto che il fosforo usa principalmente gli orbitali 3p per formare i legami, mentre l'orbitale 3s contribuisce scarsamente alla formazione dell'ibrido. Di conseguenza la coppia solitaria della trimetilfosfina ha un carattere principalmente s, come nel caso della fosfina PH3.[3] Nel caso del fosforo questo succede perché la separazione tra gli orbitali 3s e 3p è più grande della corrispondenze separazione tra gli orbitali 2s e 2p, utilizzati da carbonio, azoto e ossigeno (dove il mescolamento degli orbitali s e p è invece forte).
Sintesi[modifica | modifica wikitesto]
La trimetilfosfina è preparata in genere trattando trifenilfosfito con cloruro di metilmagnesio come reattivo di Grignard. La sintesi viene condotta in dibutiletere, solvente dal quale si può separare per distillazione la trimetilfosfina volatile.[4]
- P(OC6H5)3 + 3CH3MgCl → P(CH3)3 + 3C6H5OMgCl
Reattività[modifica | modifica wikitesto]
PMe3 è un composto stabile, ma facilmente ossidabile come tutte le fosfine. In presenza di aria viene ossidato dall'ossigeno per formare il fosfinossido OPMe3. Può anche essere facilmente alchilato per formare derivati di fosfonio RPMe3+.[5]
PMe3 ha pKa = 8,65 e può dar luogo a reazioni acido-base. Con acidi forti forma sali tipo [HPMe3]X.[2] La reazione è reversibile. Con basi forti, come i composti litio alchili, viene deprotonato un gruppo metile e si ottiene PMe2CH2Li.
Chimica di coordinazione[modifica | modifica wikitesto]
PMe3 è un legante molto usato e forma complessi con la maggior parte dei metalli. Come legante è caratterizzato da un angolo conico di Tolman di 118°.[6] Questo parametro fornisce una indicazione dell'ingombro sterico che il legante provoca coordinandosi sul metallo. Essendo un legante relativamente compatto, più trimetilfosfine possono coordinarsi ad un singolo metallo, come illustrato nel seguente caso:
- 2PMe3 + Fe(CO)5 → Fe(CO)3(PMe3)2 + 2CO
Tossicità / Indicazioni di sicurezza[modifica | modifica wikitesto]
La trimetilfosfina è disponibile in commercio. Il composto è facilmente infiammabile. È irritante per la pelle, gli occhi e le vie respiratorie. Non ci sono evidenze di effetti cancerogeni.[7]
Note[modifica | modifica wikitesto]
Bibliografia[modifica | modifica wikitesto]
- (EN) R. Engel e J. I. Cohen, Phosphorus: Organophosphorus Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia187, ISBN 978-0-470-86210-0.
- E. Fluck, The chemistry of phosphine, in Top. Curr. Chem., vol. 35, 1973, pp. 1-64, DOI:10.1007/BFb0051357.
- (EN) N. N. Greenwood e A. Earnshaw, Chemistry of the elements, 2ª ed., Oxford, Butterworth-Heinemann, 1997, ISBN 0-7506-3365-4.
- (EN) M. L. Luetkens, A. P. Sattelberger, H. H. Murray, J. D. Basil, J. P. Fackler, R. A. Jones e D. E. Heaton, Trimethylphosphine, in R. J. Angelici) (a cura di), Inorganic Syntheses: Reagents for Transition Metal Complex and Organometallic Syntheses, vol. 28, Hoboken, John Wiley & Sons, 2007, DOI:10.1002/9780470132593.ch76.
- (EN) A. Schier e H. Schmidbaur, P-Donor Ligands, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia177, ISBN 978-0-470-86210-0.
- Sigma-Aldrich, Scheda di dati di sicurezza della trimetilfosfina.
- P. Thenard, Suite des recherches sur le phosphore (quatrième Mémoire), in C. R. Hebd. Seances Acad. Sci., Ser. C, vol. 25, 1847, pp. 892-895. URL consultato il 5 dicembre 2013.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Trimetilfosfina
Wikimedia Commons contiene immagini o altri file su Trimetilfosfina