Ter-Butilossicarbonile
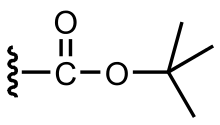
Il gruppo ter-butilossicarbonil, meglio noto come BOC, è un gruppo protettivo delle ammine utilizzato in sintesi organica.
Il gruppo BOC può essere aggiunto alla ammina in ambiente acquoso con di-ter-butil dicarbonato in presenza di una base quale bicarbonato di sodio. La protezione dell'ammina può anche essere eseguita in acetonitrile usando la 4-dimetilamminopiridina (DMAP) come base.
La rimozione (cleavage) può essere effettuata usando acido trifluoroacetico (TFA) puro o sciolto in diclorometano, oppure con HCl in metanolo.[1][2][3] Una complicazione deriva dalla tendenza del catione ter-butilico intermedio ad alchilarsi in presenza di nucleofili, per cui si aggiungono scavengers come l'anisolo od il tioanisolo.[4][5] La rimozione selettiva in presenza di altri gruppi protettivi acido labili viene effettuata utilizzando un acido di Lewis come l'AlCl3.
Talvolta per la rimozione si utilizza una soluzione di TMSI in metanolo,[6][7] utile essendo un metodo molto blando rispetto alle alternative.[8] Il meccanismo vede la sililazione dell'ossigeno carbonilico e l'eliminazione del ter-butil ioduro (1), metanolisi del silil estere ad acido carbammico (2) e infine decarbossilazione a liberare l'ammina (3).[9]
Protezione delle ammine[modifica | modifica wikitesto]

Questo elenco riassume i principali metodi di introduzione e rimozione
Metodi di protezione[modifica | modifica wikitesto]
- Riscaldamento di una miscela di ammina e di-ter-butil dicarbonato (Boc2O) in tetraidrofurano (THF) a 40 °C[10]
- Aggiunta della ammina ad una soluzione acquosa di NaOH e di-ter-butil dicarbonato a R.T.[11]
- Aggiunta della ammina ad una soluzione di acetonitrile contenente il DMAP ed il di-ter-butil dicarbonato a R.T.[12]
Metodi di deprotezione[modifica | modifica wikitesto]
- Si unisce al carbammato da deproteggere una soluzione 3 M di acido cloridrico (HCl) in acetato d'etile a R.T. per 30 min[13]
- Si scalda il carbammato in una miscela aquosa di acido cloridrico e toluene a 65 °C[14]
- Trattamento con TMSI in metanolo
Note[modifica | modifica wikitesto]
- ^ http://www.orgsyn.org/demo.aspx?prep=v80p0018, su orgsyn.org. URL consultato il 29 gennaio 2017.
- ^ Ethan A. Englund, Hosahudya N. Gopi e Daniel H. Appella, An Efficient Synthesis of a Probe for Protein Function: 2,3-Diaminopropionic Acid with Orthogonal Protecting Groups, in Organic Letters, vol. 6, n. 2, 1º gennaio 2004, pp. 213–215, DOI:10.1021/ol0361599. URL consultato il 29 gennaio 2017.
- ^ Deepak M. Shendage, Roland Fröhlich e Günter Haufe, Highly efficient stereoconservative amidation and deamidation of alpha-amino acids, in Organic Letters, vol. 6, n. 21, 14 ottobre 2004, pp. 3675–3678, DOI:10.1021/ol048771l. URL consultato il 29 gennaio 2017.
- ^ B. F. Lundt, N. L. Johansen e A. Vølund, Removal of t-butyl and t-butoxycarbonyl protecting groups with trifluoroacetic acid. Mechanisms, biproduct formation and evaluation of scavengers, in International Journal of Peptide and Protein Research, vol. 12, n. 5, 1º novembre 1978, pp. 258–268. URL consultato il 29 gennaio 2017.
- ^ (EN) Vommina V. Sureshbabu e Narasimhamurthy Narendra, Amino Acids, Peptides and Proteins in Organic Chemistry, Wiley-VCH Verlag GmbH & Co. KGaA, 1º gennaio 2011, pp. 1–97, DOI:10.1002/9783527631827.ch1, ISBN 978-3-527-63182-7. URL consultato il 29 gennaio 2017.
- ^ (EN) Richard S. Lott, Virander S. Chauhan e Charles H. Stammer, Trimethylsilyl iodide as a peptide deblocking agent, in Journal of the Chemical Society, Chemical Communications, n. 11, 1º gennaio 1979, DOI:10.1039/c39790000495. URL consultato il 29 gennaio 2017.
- ^ George A. Olah, Subhash C. Narang, Iodotrimethylsilane - a versatile synthetic reagent, in Tetrahedron, vol. 38, pp. 2225-2277, DOI:10.1016/0040-4020(82)87002-6.
- ^ Zhijian Liu, Nobuyoshi Yasuda e Michael Simeone, N-Boc Deprotection and Isolation Method for Water-Soluble Zwitterionic Compounds, in The Journal of Organic Chemistry, vol. 79, n. 23, 5 dicembre 2014, pp. 11792–11796, DOI:10.1021/jo502319z. URL consultato il 29 gennaio 2017.
- ^ (EN) Michael E. Jung e Mark A. Lyster, Conversion of alkyl carbamates into amines via treatment with trimethylsilyl iodide, in Journal of the Chemical Society, Chemical Communications, n. 7, 1º gennaio 1978, DOI:10.1039/c39780000315. URL consultato il 29 gennaio 2017.
- ^ (EN) Peter G. M. Wuts e Theodora W. Greene, Greene's Protective Groups in Organic Synthesis, John Wiley & Sons, Inc., 1º gennaio 2006, pp. 696–926, DOI:10.1002/9780470053485.ch7, ISBN 978-0-470-05348-5. URL consultato il 29 gennaio 2017.
- ^ (EN) D. Stanley Tarbell, Yutaka Yamamoto e Barry M. Pope, New Method to Prepare N-t-Butoxycarbonyl Derivatives and the Corresponding Sulfur Analogs from di-t-Butyl Dicarbonate or di-t-Butyl Dithiol Dicarbonates and Amino Acids, in Proceedings of the National Academy of Sciences of the United States of America, vol. 69, n. 3, 1972, pp. 730–732, DOI:10.1073/pnas.69.3.730, PMC 426545, PMID 16591972.
- ^ Ethan A. Englund, Hosahudya N. Gopi e Daniel H. Appella, An Efficient Synthesis of a Probe for Protein Function: 2,3-Diaminopropionic Acid with Orthogonal Protecting Groups, in Organic Letters, vol. 6, n. 2, January 2004, pp. 213–215, DOI:10.1021/ol0361599, PMID 14723531.
- ^ Glenn L. Stahl, Roderich Walter e Clark W. Smith, General Procedure for the Synthesis of Mono-N-Acylated 1,6-Diaminohexanes, in The Journal of Organic Chemistry, vol. 43, n. 11, pp. 2285–2286, DOI:10.1021/jo00405a045.
- ^ Mahavir Prashad, Denis Har, Bin Hu, Hong-Yong Kim, Michael J. Girgis, Apurva Chaudhary, Oljan Repič, Thomas J. Blacklock e Wolfgang Marterer, Process Development of a Large-Scale Synthesis of TKA731: A Tachykinin Receptor Antagonist, in Organic Process Research & Development, vol. 8, n. 3, pp. 330–340, DOI:10.1021/op0341824.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Ter-Butilossicarbonile
Wikimedia Commons contiene immagini o altri file su Ter-Butilossicarbonile




