Legame chimico: differenze tra le versioni
Nessun oggetto della modifica Etichette: Modifica da mobile Modifica da web per mobile |
m Annullate le modifiche di 31.199.66.113 (discussione), riportata alla versione precedente di 82.51.159.204 |
||
| Riga 1: | Riga 1: | ||
{{F|concetti fondamentali di chimica|arg2=chimica teorica|maggio 2015}} |
{{F|concetti fondamentali di chimica|arg2=chimica teorica|maggio 2015}} |
||
Si ha un '''legame chimico''' quando una [[forza]] di natura [[elettrostatica]] tiene uniti più |
Si ha un '''legame chimico''' quando una [[forza]] di natura [[elettrostatica]] tiene uniti più [[atomo|atomi]] in una [[specie chimica]] (''legami forti'', o ''primari ''o ''intramolecolari'') o più [[molecola|molecole]] in una sostanza allo [[stato condensato]] (''legami deboli'', o ''secondari ''o ''[[legame intermolecolare|intermolecolari]]''). |
||
I legami chimici "più forti" |
I legami chimici "più forti" hanno un [[Energia di legame|contenuto energetico]] maggiore e sono più difficili da rompere, mentre i legami minori hanno un contenuto energetico minore e sono più facili da rompere. Da ciò deriva che le molecole che hanno al loro interno legami chimici più deboli sono più instabili.<ref>A tale proposito, un esempio è dato dalla molecola di [[etilene]] rispetto alla molecola di [[etano]]. Nel caso dell'etilene, i due atomi di [[carbonio]] sono legati da due legami: un [[legame σ]], più forte, e un [[legame π]], più debole. Nella molecola di etano invece i due atomi di carbonio sono legati da un singolo [[legame σ]]. Per questo motivo, la molecola di etilene è più instabile rispetto alla molecola di etano, in quanto in seguito a riscaldamento si ha l'apertura del [[legame π]], che è più debole.</ref> |
||
Inoltre tanto più un legame è forte, tanto minore è la [[lunghezza di legame|lunghezza del legame]], essendo la forza che tiene uniti gli atomi maggiore.<ref>Infatti il legame chimico funge da forza attrattiva, alla quale è contrapposta una forza di tipo repulsivo (che aumenta di intensità al diminuire |
Inoltre tanto più un legame è forte, tanto minore è la [[lunghezza di legame|lunghezza del legame]], essendo la forza che tiene uniti gli atomi maggiore.<ref>Infatti il legame chimico funge da forza attrattiva, alla quale è contrapposta una forza di tipo repulsivo (che aumenta di intensità al diminuire della distanza), per cui la posizione reciproca degli atomi è una posizione di equilibrio data dall'azione contrastante delle due forze. Per approfondire: [[potenziale di Lennard-Jones]].</ref> |
||
== Natura elettrostatica del legame chimico == |
== Natura elettrostatica del legame chimico == |
||
Versione delle 10:29, 9 gen 2017
Si ha un legame chimico quando una forza di natura elettrostatica tiene uniti più atomi in una specie chimica (legami forti, o primari o intramolecolari) o più molecole in una sostanza allo stato condensato (legami deboli, o secondari o intermolecolari).
I legami chimici "più forti" hanno un contenuto energetico maggiore e sono più difficili da rompere, mentre i legami minori hanno un contenuto energetico minore e sono più facili da rompere. Da ciò deriva che le molecole che hanno al loro interno legami chimici più deboli sono più instabili.[1]
Inoltre tanto più un legame è forte, tanto minore è la lunghezza del legame, essendo la forza che tiene uniti gli atomi maggiore.[2]
Natura elettrostatica del legame chimico
La natura del legame chimico si può spiegare facilmente osservando le forze coulombiane interagenti tra le molecole. Prendiamo ad esempio il catione H2+: esso è costituito da due nuclei di H e da un elettrone. Indichiamo con Ha il primo nucleo di idrogeno e con Hb l'altro nucleo di idrogeno. A ciascuno dei due nuclei è associata una funzione d'onda elettronica, rispettivamente 1sa e 1sb, la cui combinazione lineare forma l'orbitale molecolare Ψ.
Ψ avrà valori bassi tra i due nuclei, mentre crescerà avvicinandosi ad essi e poi decrescerà allontanandosi nuovamente da essi. Quindi se si considera un elettrone, ovvero una carica negativa posta tra i due nuclei, esso sarà sottoposto a forze attrattive da parte dei due nuclei che saranno controbilanciate da quelle repulsive fino a quando non si sarà raggiunta la stabilità del sistema; quindi l'elettrone sarà caduto in una buca di potenziale dalla quale gli sarà difficile uscire. In tal modo si è formato un legame chimico.
Legami primari
| Lunghezza di legame tipica ed energia di legame[3] | ||
| Legame | Lunghezza (pm) |
Energia (kJ/mol) |
|---|---|---|
| H — Idrogeno | ||
| H–H | 74 | 436 |
| H–O | 96 | 366 |
| H–F | 92 | 568 |
| H–Cl | 127 | 432 |
| C — Carbonio | ||
| C–H | 109 | 413 |
| C–C | 154 | 348 |
| C=C | 134 | 614 |
| C≡C | 120 | 839 |
| C–N | 147 | 308 |
| C–O | 143 | 360 |
| C–F | 134 | 488 |
| C–Cl | 177 | 330 |
| N — Azoto | ||
| N–H | 101 | 391 |
| N–N | 145 | 170 |
| N≡N | 110 | 945 |
| O — Ossigeno | ||
| O–O | 148 | 145 |
| O=O | 121 | 498 |
| F, Cl, Br, I - Alogeni | ||
| F–F | 142 | 158 |
| Cl–Cl | 199 | 243 |
| Br–H | 141 | 366 |
| Br–Br | 228 | 193 |
| I–H | 161 | 298 |
| I–I | 267 | 151 |
I legami chimici primari sono le forze che tengono uniti gli atomi che formano le molecole. Un legame primario è attuato dalla condivisione o dal trasferimento di elettroni tra atomi e dall'attrazione elettrostatica tra protoni ed elettroni. Tali legami generano il trasferimento di un numero intero di elettroni, detto ordine di legame, anche se in alcuni sistemi vi sono quantità intermedie di carica, come nel benzene, in cui l'ordine di legame è 1,5 per ogni atomo di carbonio. I legami primari sono generalmente classificati in tre classi, in ordine di polarità crescente:

Legame covalente
Il legame covalente è il legame che si instaura tra due atomi appartenenti ai non metalli (uguali o aventi differenza di elettronegatività - scala di Pauling - compresa tra 0 e 1,7) che mettono in compartecipazione una coppia di elettroni (detti coppia di legame) in un orbitale esterno che abbraccia entrambi gli atomi. Il legame covalente viene rappresentato da un trattino che congiunge i due atomi legati.
Legame covalente puro
Un legame covalente puro (o apolare) è un legame covalente che s'instaura fra due atomi appartenenti allo stesso elemento. In pratica si stabilisce una interazione (cioè il legame) tra atomi dello stesso tipo: è il caso tipico dell'idrogeno, dell'ossigeno, dell'azoto atmosferico, ecc.
Un legame covalente puro (o omopolare o apolare) si ha quando la differenza di elettronegatività tra due atomi è minore o uguale a 0,4.

Essendo la nube elettronica distribuita simmetricamente, il legame risulta non polarizzato.
I legami covalenti che si formano fra due atomi che condividono due coppie di elettroni prendono il nome di doppio legame. I legami covalenti che si formano fra due atomi che condividono tre coppie di elettroni prendono il nome di triplo legame.
Per constatare il numero di legami covalenti formatisi fra due atomi bisogna conoscere la valenza dell'atomo degli elementi considerati e dopo aver fatto questo scoprire quanti elettroni gli mancano per essere stabili (regola dell'ottetto).
es. N=azoto V gruppo= 5 elettroni di valenza (+ 3 elettroni per completare l'ottetto)
I legami fra due atomi di azoto sono un triplo legame.
Legame covalente polare
Il legame covalente polare si instaura tra due atomi con differenza di elettronegatività compresa tra 0,4 e 1,7. In questo caso, gli elettroni coinvolti nel legame risulteranno maggiormente attratti dall'atomo più elettronegativo, il legame risulterà quindi polarizzato elettricamente, cioè ognuno degli atomi coinvolti nel legame presenterà una carica parziale.
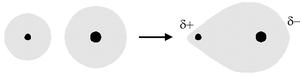
Quando una molecola è tenuta coesa da soli legami covalenti puri o possiede una simmetria tale da annullare reciprocamente le polarità dei suoi legami covalenti risulterà complessivamente apolare. Invece una molecola costituita da due atomi legati fra loro da un legame covalente polare è polare (o dipolo elettrico); ciò non significa, in genere, però che la molecola abbia una carica elettrica perché nella sua totalità essa è elettricamente neutra. Si può prevedere facilmente la struttura polare di una molecola nel caso essa sia biatomica.
Legame di coordinazione o dativo
È un tipo particolare di legame covalente detto dativo, in quanto i due elettroni coinvolti nel legame provengono da uno solo dei due atomi.
L'atomo che "dona" al legame la sua "coppia solitaria", cioè entrambi gli elettroni appaiati presenti in un suo orbitale viene detto "datore". L'altro, che mette a disposizione un orbitale esterno vuoto (cioè con due posti vuoti che possono essere occupati da due elettroni) o che riorganizza la sua configurazione elettronica per accogliere la coppia di elettroni (cioè ad esempio spostare due elettroni presenti su di un orbitale dispari su di un altro orbitale dispari, liberando di fatto un orbitale) viene detto "accettore".
Il legame dativo può essere rappresentato con una freccia, dal donatore all'accettore, o più impropriamente può essere indicato con un doppio trattino.
Legami delocalizzati e legame metallico
Alcuni legami covalenti, detti delocalizzati, possono legare insieme tre o più atomi contemporaneamente, come nei borani e nei composti aromatici.
Legame metallico
La forma più estrema di delocalizzazione del legame covalente si ha nel legame metallico. Secondo questo modello un metallo può essere rappresentato come un reticolo cristallino di ioni positivi tenuti uniti da una nube di elettroni condivisi estesa a tutto il reticolo (mare di Fermi); essendo tali elettroni non legati a nessun atomo particolare, risultano essere estremamente mobili; tale mobilità è responsabile della elevata conducibilità elettrica dei metalli.
Legame ionico
Il legame ionico è un legame tra ioni con carica di segno opposto. Tali ioni si formano da atomi aventi differenza di elettronegatività superiore al limite convenzionale di 1,7 - 1,9: in queste condizioni, l'atomo più elettronegativo (quindi caratterizzato da una elevata energia di ionizzazione ed elevata affinità elettronica, quindi più esposto ad attrarre a se un elettrone) priva l'altro atomo meno elettronegativo (caratterizzato da una bassa energia di ionizzazione ed una affinità elettronica quasi assente, quindi con meno possibilità di attrarre a se un elettrone) di un elettrone; il primo atomo diventa uno ione con carica negativa (ione negativo), il secondo uno ione con carica positiva (ione positivo).
Questo legame è di natura prettamente elettrostatica; l'arrangiamento degli atomi nello spazio non ha la direzionalità del legame covalente: il campo elettrico generato da ciascuno ione si diffonde simmetricamente nello spazio attorno ad esso.
È il tipo più semplice di legame chimico, sia dal punto di vista concettuale sia da quello della sua descrizione analitica, essendo interpretabile in base alle leggi classiche dell'elettrostatica.
Tali legami si rompono durante il processo di solvatazione.
Legami secondari
I dipoli molecolari possono originare delle forze di attrazione intermolecolari.
I legami intermolecolari sono essenzialmente costituiti dalla reciproca attrazione tra dipoli statici - è il caso delle molecole polari - o tra dipoli e ioni - è il caso, ad esempio, di un sale che si scioglie in acqua.
Nel caso dei gas nobili o di composti formati da molecole apolari la possibilità di liquefare viene spiegata tramite la formazione casuale di un dipolo temporaneo quando gli elettroni, nel loro orbitare, si trovino casualmente concentrati su un lato della molecola; tale dipolo induce nelle molecole vicine a sé uno squilibrio di carica elettrica (il cosiddetto dipolo indotto) che genera reciproca attrazione e provoca la condensazione del gas. Il legame viene quindi prodotto da queste particolari forze di attrazione dette forze di dispersione o di Van der Waals.
Un caso particolare di legame intermolecolare, che può anche essere intramolecolare quando la geometria della molecola lo consente, è il legame idrogeno.
Un atomo di idrogeno legato ad un atomo di ossigeno (o di fluoro), a causa della sua polarizzazione positiva e delle sue ridotte dimensioni, attrae con un'intensità relativamente elevata gli atomi di ossigeno (e di fluoro e, in misura minore, di azoto) vicini.
Tale legame, benché debole, è responsabile della conformazione spaziale delle proteine e degli acidi nucleici, conformazione da cui dipende l'attività biologica dei composti stessi.
Come ordine di grandezza, l'entità delle varie forze di legame può essere indicato dalla seguente tabella:
| Tipo di legame | Forza relativa |
|---|---|
| Legame ionico | 1000 |
| Interazioni dipolari e Legame idrogeno | 10 - 100 |
| Forza di van der Waals | 1 |
Note
- ^ A tale proposito, un esempio è dato dalla molecola di etilene rispetto alla molecola di etano. Nel caso dell'etilene, i due atomi di carbonio sono legati da due legami: un legame σ, più forte, e un legame π, più debole. Nella molecola di etano invece i due atomi di carbonio sono legati da un singolo legame σ. Per questo motivo, la molecola di etilene è più instabile rispetto alla molecola di etano, in quanto in seguito a riscaldamento si ha l'apertura del legame π, che è più debole.
- ^ Infatti il legame chimico funge da forza attrattiva, alla quale è contrapposta una forza di tipo repulsivo (che aumenta di intensità al diminuire della distanza), per cui la posizione reciproca degli atomi è una posizione di equilibrio data dall'azione contrastante delle due forze. Per approfondire: potenziale di Lennard-Jones.
- ^ La lunghezza di legame è espressa in pm e può essere convertita in Å dividendo per 100 (1 Å = 100 pm). L'energia è espressa in kJ/mol. Dati presi da [1].
Bibliografia
- Paolo Silvestroni, Fondamenti di chimica, 10ª ed., CEA, 1996, pp. 38-97, ISBN 88-408-0998-8.
Voci correlate
- Elettronegatività
- Forza di van der Waals
- Dipolo molecolare
- Polarità delle molecole
- Scissione (chimica)
- Triangolo di Van Arkel-Ketelaar
Tipi di legame chimico
Caratteristiche del legame chimico
- Energia di legame
- Angolo di legame
- Energia di dissociazione di legame
- Lunghezza di legame
- Regole di Fajans
Altri progetti
 Wikimedia Commons contiene immagini o altri file su legame chimico
Wikimedia Commons contiene immagini o altri file su legame chimico
Collegamenti esterni
- Il legame chimico, su itchiavari.org.
- (EN) IUPAC Gold Book, "chemical bond", su goldbook.iupac.org.
| Controllo di autorità | LCCN (EN) sh85022892 · GND (DE) 4009843-6 · J9U (EN, HE) 987007284925105171 · NDL (EN, JA) 00564418 |
|---|