Acqua: differenze tra le versioni
Etichette: Modifica da mobile Modifica da web per mobile |
corsivo e grassetto imporprio (wp:corsivo, wp:grassetto) + aggiustamenti Etichetta: Editor wikitesto 2017 |
||
| Riga 16: | Riga 16: | ||
|immagine5_dimensioni = |
|immagine5_dimensioni = |
||
|immagine5_descrizione = |
|immagine5_descrizione = |
||
|nome_IUPAC = acqua, ossidano<ref>Il nome sistematico IUPAC dell'acqua dovrebbe essere |
|nome_IUPAC = acqua, ossidano<ref>Il nome sistematico IUPAC dell'acqua dovrebbe essere "monossido di diidrogeno", o anche "idrossido di idrogeno" o "acido ossidrilico", se si vuole enfatizzare il comportamento basico o acido. Tali nomi però non sono mai entrati in uso, se non in [[parodia|parodie]] del linguaggio dei chimici o in scherzi; si veda ad esempio la [[beffa del monossido di diidrogeno]]. La stessa IUPAC raccomanda l'uso dei nomi "''water''", "acqua", e "''oxidane''" ({{Cita pubblicazione|cognome=Leigh |nome=G. J. ''et al.'' |anno=1998 |url=http://old.iupac.org/publications/books/principles/principles_of_nomenclature.pdf |titolo=Principles of chemical nomenclature: a guide to IUPAC recommendations |p=34 |editore=Blackwell Science Ltd, UK |isbn=0-86542-685-6}}).</ref> |
||
|abbreviazioni = |
|abbreviazioni = |
||
|nomi_alternativi =monossido di diidrogeno |
|nomi_alternativi =monossido di diidrogeno |
||
| Riga 70: | Riga 70: | ||
|titolo_indicazioni_sicurezza = --- |
|titolo_indicazioni_sicurezza = --- |
||
}} |
}} |
||
L{{'}}'''acqua''' è un [[composto chimico]] di [[formula molecolare]] [[idrogeno|H]]<sub>2</sub>[[ossigeno|O]], in cui i due [[Atomo|atomi]] di [[idrogeno]] sono [[Legame chimico|legati]] all'atomo di [[ossigeno]] con [[legame covalente]] polare. In condizioni di [[temperatura]] e [[pressione]] [[Condizioni standard|normali]]<ref> |
L{{'}}'''acqua''' è un [[composto chimico]] di [[formula molecolare]] [[idrogeno|H]]<sub>2</sub>[[ossigeno|O]], in cui i due [[Atomo|atomi]] di [[idrogeno]] sono [[Legame chimico|legati]] all'atomo di [[ossigeno]] con [[legame covalente]] polare. In condizioni di [[temperatura]] e [[pressione]] [[Condizioni standard|normali]]<ref>"Condizioni normali" (o "c.n.") significa le [[condizioni standard]] di [[temperatura]] e [[pressione]] rispettivamente di 20 [[Celsius|°C]] e 1 [[Atmosfera (unità di misura)|atm]].</ref> si presenta come un [[Sistema bifase (termodinamica)|sistema bifase]], costituito da un [[liquido]] incolore<ref name=incolor/> e insapore (che viene chiamato "acqua" in senso stretto) e da un [[vapore]] incolore (detto [[vapore acqueo]]). Si presenta allo stato [[solido]] (detto [[ghiaccio]]) nel caso in cui la temperatura sia uguale o inferiore alla [[Punto di fusione|temperatura di congelamento]].<ref>In generale si parla di "temperatura di congelamento" e non di "0 [[Celsius|°C]]". Infatti il valore della temperatura di congelamento dipende dalla pressione, ed è pari a 0 °C solo a [[pressione atmosferica]].</ref> |
||
Essendo l'acqua un ottimo [[solvente]], le acque naturali contengono disciolte moltissime altre sostanze, ed è per questo motivo che con il termine "acqua" si intende comunemente sia il composto chimico [[Sostanza pura|puro]] di formula H<sub>2</sub>O, sia la [[miscela (chimica)|miscela]] (liquida) formata dallo stesso, con altre sostanze disciolte al suo interno. |
Essendo l'acqua un ottimo [[solvente]], le acque naturali contengono disciolte moltissime altre sostanze, ed è per questo motivo che con il termine "acqua" si intende comunemente sia il composto chimico [[Sostanza pura|puro]] di formula H<sub>2</sub>O, sia la [[miscela (chimica)|miscela]] (liquida) formata dallo stesso, con altre sostanze disciolte al suo interno. |
||
| Riga 79: | Riga 79: | ||
==Etimologia== |
==Etimologia== |
||
Il termine |
Il termine "acqua" deriva dal [[lingua latina|latino]] ''aqua'', dal [[lingua proto-italica|protoitalico]] ''akʷā'', a sua volta da una radice indoeuropea ''h₂ékʷeh₂'' con collegamenti nell'area [[lingue germaniche|germanica]] ([[lingua proto-germanica|protogermanico]] ''ahwō'') e nella [[lingua lusitana]]. |
||
Il termine {{lang-grc|ὕδωρ, ὕδατος|hýdōr, hýdatos}} è imparentato con il protogermanico |
Il termine {{lang-grc|ὕδωρ, ὕδατος|hýdōr, hýdatos}} è imparentato con il protogermanico ''watōr'' (da una radice indoeuropea ''wódr̥'') da cui discendono il [[lingua tedesca|tedesco]] ''wasser'' e l'[[lingua inglese|inglese]] ''water''; dalla stessa radice indoeuropea discende il latino ''unda'' (italiano "onda"). |
||
== Fisica e chimica dell'acqua == |
== Fisica e chimica dell'acqua == |
||
| Riga 100: | Riga 100: | ||
[[Gilbert Newton Lewis]] ha isolato il primo campione di pura [[acqua pesante]] (in cui l'idrogeno è sostituito dal [[deuterio]], suo [[isotopo]]) nel [[1933]].<ref>{{en}} {{cita pubblicazione|autore=|nome=Gilbert N.|cognome=Lewis|data=|anno=1933|mese=marzo|titolo=The isotope of hydrogen|rivista=Journal of the American Chemical Society|volume=55|numero=3|pp=1297-1298|accesso=14 agosto 2009|doi=10.1021/ja01330a511|url=http://pubs.acs.org/doi/abs/10.1021/ja01330a511}}</ref> |
[[Gilbert Newton Lewis]] ha isolato il primo campione di pura [[acqua pesante]] (in cui l'idrogeno è sostituito dal [[deuterio]], suo [[isotopo]]) nel [[1933]].<ref>{{en}} {{cita pubblicazione|autore=|nome=Gilbert N.|cognome=Lewis|data=|anno=1933|mese=marzo|titolo=The isotope of hydrogen|rivista=Journal of the American Chemical Society|volume=55|numero=3|pp=1297-1298|accesso=14 agosto 2009|doi=10.1021/ja01330a511|url=http://pubs.acs.org/doi/abs/10.1021/ja01330a511}}</ref> |
||
Una controversia scientifica è nata alla fine degli [[anni 1960|anni sessanta]] a proposito dell'esistenza di una forma [[polimero|polimerica]] dell'acqua (la |
Una controversia scientifica è nata alla fine degli [[anni 1960|anni sessanta]] a proposito dell'esistenza di una forma [[polimero|polimerica]] dell'acqua (la "poliacqua"). È ormai condivisa l'opinione che tale "poliacqua" non esista.<ref>{{en}} {{cita pubblicazione |
||
| cognome = Rousseau |
| cognome = Rousseau |
||
| nome = Denis |
| nome = Denis |
||
| Riga 155: | Riga 155: | ||
[[File:Water fountain near the art museum in Milwaukee, Wisconsin 6178.jpg|thumb|Acqua allo stato liquido]] |
[[File:Water fountain near the art museum in Milwaukee, Wisconsin 6178.jpg|thumb|Acqua allo stato liquido]] |
||
{{vedi anche|Ghiaccio|Ghiaccio amorfo|Cristalli di ghiaccio}} |
{{vedi anche|Ghiaccio|Ghiaccio amorfo|Cristalli di ghiaccio}} |
||
L'acqua assume più [[Stato della materia|forme]] in natura. Allo stato [[solido]] è nota come [[ghiaccio]], allo stato [[aeriforme]] è nota come [[vapore acqueo]]. Sono note anche altre due forme solide, quella del |
L'acqua assume più [[Stato della materia|forme]] in natura. Allo stato [[solido]] è nota come [[ghiaccio]], allo stato [[aeriforme]] è nota come [[vapore acqueo]]. Sono note anche altre due forme solide, quella del [[ghiaccio vetroso]] e quella del [[solido amorfo]], non cristallino, simile al [[vetro]] ([[ghiaccio amorfo]]). A pressioni estreme il ghiaccio può assumere diversi stati solidi, numerati con numeri romani. La gamma delle forme solide dell'acqua è così vasta e varia da non essere nemmeno confrontabile con quella di alcun altro [[scienza dei materiali|materiale]]<ref>{{cita web | url = http://www1.lsbu.ac.uk/water/phase_anomalies.html#ice | titolo = Explanation of the Phase Anomalies of Water (P1-P13). P4 | lingua = en | accesso = 17 marzo 2017 | cognome = Chaplin | nome = Martin | giorno = 19 | mese = dicembre | anno = 2016 | sito = Water Structure and Science | dataarchivio = 20 marzo 2017 | urlarchivio = https://web.archive.org/web/20170320054246/http://www1.lsbu.ac.uk/water/phase_anomalies.html#ice | urlmorto = sì }}</ref>. |
||
Il ghiaccio e la [[neve]] con cui abbiamo a che fare presentano, di norma, una [[Sistema esagonale|struttura cristallina esagonale]] ([[Ghiaccio Ih|ghiaccio I<sub>h</sub>]]). Solo leggermente meno stabile ( |
Il ghiaccio e la [[neve]] con cui abbiamo a che fare presentano, di norma, una [[Sistema esagonale|struttura cristallina esagonale]] ([[Ghiaccio Ih|ghiaccio I<sub>h</sub>]]). Solo leggermente meno stabile ([[metastabile]]) della forma esagonale è quella cubica ([[Ghiaccio Ic|Ghiaccio I<sub>c</sub>]]). Raffreddando il ghiaccio I<sub>h</sub> si ha la formazione di una diversa configurazione, la forma del [[ghiaccio XI]], nella quale i protoni presentano un'elevata mobilità. |
||
A diverse temperature e pressioni possono esistere altri tipi di ghiaccio, che possono essere identificati nel [[diagramma di fase]] del ghiaccio. Tra questi, vi sono: II, III, V, VI, VII, VIII, IX, e X. Il passaggio da un ghiaccio all'altro avviene attraverso una [[Isoterma (termodinamica)|transizione isotermica]] (come per tutte le [[transizione di fase|transizioni di fase]]). Sotto opportune condizioni, tutti questi tipi possono esistere anche a temperatura ambiente. I vari tipi di ghiaccio differiscono per la loro [[Cristallo|struttura cristallina]], ordinamento e [[densità]]. |
A diverse temperature e pressioni possono esistere altri tipi di ghiaccio, che possono essere identificati nel [[diagramma di fase]] del ghiaccio. Tra questi, vi sono: II, III, V, VI, VII, VIII, IX, e X. Il passaggio da un ghiaccio all'altro avviene attraverso una [[Isoterma (termodinamica)|transizione isotermica]] (come per tutte le [[transizione di fase|transizioni di fase]]). Sotto opportune condizioni, tutti questi tipi possono esistere anche a temperatura ambiente. I vari tipi di ghiaccio differiscono per la loro [[Cristallo|struttura cristallina]], ordinamento e [[densità]]. |
||
| Riga 184: | Riga 184: | ||
}}</ref> |
}}</ref> |
||
Oltre alle forme cristalline, l'acqua può esistere in [[ghiaccio amorfo|stati amorfi]]: |
Oltre alle forme cristalline, l'acqua può esistere in [[ghiaccio amorfo|stati amorfi]]: acqua solida amorfa, ghiaccio amorfo a bassa densità, ghiaccio amorfo ad alta densità, ghiaccio amorfo ad altissima densità e acqua vetrosa sottoraffreddata. |
||
Esistono anche molecole d'acqua costituite da [[isotopi dell'idrogeno]] al posto del normale [[Idrogeno#Isotopi|prozio]] (<span style="position: relative; left: 0; top: -0.5ex; font-size: 1.5ex; line-height: 0;"><sup>1</sup><sub style="position: absolute; left: 0; top: 2.1ex;">1</sub></span>H), che trovano impiego principalmente in ambito [[reazione nucleare|nucleare]]. |
Esistono anche molecole d'acqua costituite da [[isotopi dell'idrogeno]] al posto del normale [[Idrogeno#Isotopi|prozio]] (<span style="position: relative; left: 0; top: -0.5ex; font-size: 1.5ex; line-height: 0;"><sup>1</sup><sub style="position: absolute; left: 0; top: 2.1ex;">1</sub></span>H), che trovano impiego principalmente in ambito [[reazione nucleare|nucleare]]. |
||
L'[[acqua pesante]] (D<sub>2</sub>O o <span style="position: relative; left: 0; top: -0.5ex; font-size: 1.5ex; line-height: 0;"><sup>2</sup><sub style="position: absolute; left: 0; top: 2.1ex;">1</sub></span>H<sub>2</sub>O) è un'acqua in cui gli atomi di idrogeno sono sostituiti da atomi di [[deuterio]], [[isotopo]] dell'idrogeno avente [[peso atomico]] 2 [[Unità di massa atomica|uma]]. Il suo comportamento chimico è sostanzialmente uguale a quello dell'acqua; trova applicazione in quanto è un [[Moderatore (fisica)|moderatore]] meno efficace dell'acqua comune (idrogeno + ossigeno) dei [[neutroni]] emessi dalla [[fissione nucleare]] ma ha una sezione di assorbimento dei neutroni molto inferiore. In campo nucleare quindi l'acqua comune viene definita anche come |
L'[[acqua pesante]] (D<sub>2</sub>O o <span style="position: relative; left: 0; top: -0.5ex; font-size: 1.5ex; line-height: 0;"><sup>2</sup><sub style="position: absolute; left: 0; top: 2.1ex;">1</sub></span>H<sub>2</sub>O) è un'acqua in cui gli atomi di idrogeno sono sostituiti da atomi di [[deuterio]], [[isotopo]] dell'idrogeno avente [[peso atomico]] 2 [[Unità di massa atomica|uma]]. Il suo comportamento chimico è sostanzialmente uguale a quello dell'acqua; trova applicazione in quanto è un [[Moderatore (fisica)|moderatore]] meno efficace dell'acqua comune (idrogeno + ossigeno) dei [[neutroni]] emessi dalla [[fissione nucleare]] ma ha una sezione di assorbimento dei neutroni molto inferiore. In campo nucleare quindi l'acqua comune viene definita anche come [[acqua leggera]]. |
||
Esiste anche un'altra forma meno stabile, chiamata [[acqua superpesante]] (T<sub>2</sub>O o <span style="position: relative; left: 0; top: -0.5ex; font-size: 1.5ex; line-height: 0;"><sup>3</sup><sub style="position: absolute; left: 0; top: 2.1ex;">1</sub></span>H<sub>2</sub>O), in cui al posto degli atomi di idrogeno sono presenti atomi di [[trizio]], isotopo dell'idrogeno avente peso atomico 3 uma.<ref>{{Cita|Holleman}}.</ref> |
Esiste anche un'altra forma meno stabile, chiamata [[acqua superpesante]] (T<sub>2</sub>O o <span style="position: relative; left: 0; top: -0.5ex; font-size: 1.5ex; line-height: 0;"><sup>3</sup><sub style="position: absolute; left: 0; top: 2.1ex;">1</sub></span>H<sub>2</sub>O), in cui al posto degli atomi di idrogeno sono presenti atomi di [[trizio]], isotopo dell'idrogeno avente peso atomico 3 uma.<ref>{{Cita|Holleman}}.</ref> |
||
| Riga 208: | Riga 208: | ||
==== L'acqua superionica ==== |
==== L'acqua superionica ==== |
||
Nel [[1999]] fu previsto dal [[SISSA]] di Trieste e “[[Abdus Salam]]” International Centre for Theoretical Physics (ICTP) di Trieste in via teorica l'esistenza di una fase dell'acqua chiamata |
Nel [[1999]] fu previsto dal [[SISSA]] di Trieste e “[[Abdus Salam]]” International Centre for Theoretical Physics (ICTP) di Trieste in via teorica l'esistenza di una fase dell'acqua chiamata "superionica"<ref name="acquasuperionica">{{cita news| url = http://www.lescienze.it/news/2018/02/28/news/acqua_superionica-3883503/ |titolo = Né solida né liquida: ecco l'acqua superionica |pubblicazione = lescienze.it|data=28 gennaio 2018|accesso=28 gennaio 2018}}</ref> o [[ghiaccio superionico]]. |
||
A febbraio [[2018]] uno studio pubblicato su [[Nature Physics]] di ricercatori del [[Lawrence Livermore National Laboratory]] ne conferma l'esistenza<ref name="acquasuperionica" />. |
A febbraio [[2018]] uno studio pubblicato su [[Nature Physics]] di ricercatori del [[Lawrence Livermore National Laboratory]] ne conferma l'esistenza<ref name="acquasuperionica" />. |
||
Dopo una certa pressione gli ioni ossigeno prendono forma di [[reticolo cristallino]], tipico di un solido mentre gli ioni idrogeno si ritrovano in uno stato liquido<ref name="acquasuperionica" />. |
Dopo una certa pressione gli ioni ossigeno prendono forma di [[reticolo cristallino]], tipico di un solido mentre gli ioni idrogeno si ritrovano in uno stato liquido<ref name="acquasuperionica" />. |
||
| Riga 321: | Riga 321: | ||
[[File:Na+H2O.svg|thumb|Sfera di idratazione attorno ad uno ione sodio]] |
[[File:Na+H2O.svg|thumb|Sfera di idratazione attorno ad uno ione sodio]] |
||
Le macromolecole biologiche e le strutture sopramolecolari interagiscono con le molecole di acqua vicine ( |
Le macromolecole biologiche e le strutture sopramolecolari interagiscono con le molecole di acqua vicine (acqua di [[Solvatazione|idratazione]]), modificandone alcune caratteristiche e subendo a loro volta modifiche nelle proprie caratteristiche. Le molecole di acqua dello [[Sfera d'idratazione|strato di idratazione]], ad esempio, hanno un'orientazione preferenziale ed una limitata libertà di movimento rotazionale e traslazionale, che fa passare i tempi di correlazione dai 10<sup>−12</sup> [[secondo|s]] dell'acqua pura ai 10<sup>−6</sup>÷10<sup>−9</sup> s dell'acqua dei gusci di idratazione.<ref>Fermi restando i dubbi precedentemente espressi su quali siano i reali tempi di correlazione dell'acqua e sul fatto che esista un solo tempo di correlazione o ne coesistano diversi.</ref> |
||
L'acqua forma [[Clatrato idrato|clatrati idrati]], costituiti da "gabbie" di molecole di acqua che circondano molecole o ioni estranei. Al di là dell'interesse per la loro struttura, che illustra quale organizzazione possa imporre il legame a idrogeno, gli idrati clatrati si assumono spesso a modello della maniera in cui l'acqua sembra organizzarsi intorno ai gruppi apolari, quali ad esempio quelli delle [[proteina|proteine]]. |
L'acqua forma [[Clatrato idrato|clatrati idrati]], costituiti da "gabbie" di molecole di acqua che circondano molecole o ioni estranei. Al di là dell'interesse per la loro struttura, che illustra quale organizzazione possa imporre il legame a idrogeno, gli idrati clatrati si assumono spesso a modello della maniera in cui l'acqua sembra organizzarsi intorno ai gruppi apolari, quali ad esempio quelli delle [[proteina|proteine]]. |
||
| Riga 332: | Riga 332: | ||
Chimicamente l'acqua è un buon [[soluzione (chimica)|solvente]].<ref name=Polizzotti8>{{Cita|Polizzotti|p. 8}}.</ref> Le proprietà solventi dell'acqua sono essenziali per gli esseri viventi, dal momento che consentono lo svolgersi delle complesse reazioni chimiche che costituiscono le basi della vita stessa (ad esempio, quelle che avvengono nel [[sangue]] o nel [[citoplasma]] della [[cellula]]). |
Chimicamente l'acqua è un buon [[soluzione (chimica)|solvente]].<ref name=Polizzotti8>{{Cita|Polizzotti|p. 8}}.</ref> Le proprietà solventi dell'acqua sono essenziali per gli esseri viventi, dal momento che consentono lo svolgersi delle complesse reazioni chimiche che costituiscono le basi della vita stessa (ad esempio, quelle che avvengono nel [[sangue]] o nel [[citoplasma]] della [[cellula]]). |
||
Il comportamento di solvente dell'acqua è determinato dalla [[polarità]] della sua molecola: quando un composto ionico o polare viene disciolto in acqua, viene circondato dalle molecole di acqua, le quali, si inseriscono tra uno ione e l'altro o tra una molecola e l'altra di soluto (grazie alle loro piccole dimensioni), orientandosi in modo da presentare ad ogni ione (o estremità polare) del soluto la parte di sé che reca la carica opposta; questo indebolisce l'attrazione tra gli ioni (o tra le molecole polari) e rompe la struttura cristallina; ogni ione (o ogni molecola polare) si ritrova quindi |
Il comportamento di solvente dell'acqua è determinato dalla [[polarità]] della sua molecola: quando un composto ionico o polare viene disciolto in acqua, viene circondato dalle molecole di acqua, le quali, si inseriscono tra uno ione e l'altro o tra una molecola e l'altra di soluto (grazie alle loro piccole dimensioni), orientandosi in modo da presentare ad ogni ione (o estremità polare) del soluto la parte di sé che reca la carica opposta; questo indebolisce l'attrazione tra gli ioni (o tra le molecole polari) e rompe la struttura cristallina; ogni ione (o ogni molecola polare) si ritrova quindi [[Solvatazione|solvatato]] (o idratato), cioè circondato completamente da molecole d'acqua che interagiscono con esso.<ref name=Polizzotti8/><ref>{{Cita|Cabras|p. 142}}.</ref> |
||
Un esempio di soluto ionico è il comune [[sale da cucina]] ([[cloruro di sodio]]), un esempio di soluto molecolare polare è lo [[zucchero]]. |
Un esempio di soluto ionico è il comune [[sale da cucina]] ([[cloruro di sodio]]), un esempio di soluto molecolare polare è lo [[zucchero]]. |
||
| Riga 341: | Riga 341: | ||
{{vedi anche|Autoionizzazione}} |
{{vedi anche|Autoionizzazione}} |
||
[[File:Hydronium-3D-balls.png|left|upright|thumb|La struttura tridimensionale dello ione idronio o idrossonio]] |
[[File:Hydronium-3D-balls.png|left|upright|thumb|La struttura tridimensionale dello ione idronio o idrossonio]] |
||
L'acqua è una sostanza |
L'acqua è una sostanza [[anfotero|anfotera]], ovvero capace di comportarsi sia da [[acido]] che da [[base (chimica)|base]]. |
||
A [[pH]] 7 (condizione di neutralità) la [[Concentrazione (chimica)|concentrazione]] di [[ossidrile|ioni idrossido]] OH<sup>-</sup> è uguale a quella di [[idrogenione|ioni idrogeno]] H<sup>+</sup> (o meglio ioni [[ossonio|idrossonio]] H<sub>3</sub>O<sup>+</sup>). Quando questo equilibrio viene alterato, la soluzione diventa acida (maggiore concentrazione di ioni idrogeno) o basica (maggiore concentrazione di ioni idrossido). |
A [[pH]] 7 (condizione di neutralità) la [[Concentrazione (chimica)|concentrazione]] di [[ossidrile|ioni idrossido]] OH<sup>-</sup> è uguale a quella di [[idrogenione|ioni idrogeno]] H<sup>+</sup> (o meglio ioni [[ossonio|idrossonio]] H<sub>3</sub>O<sup>+</sup>). Quando questo equilibrio viene alterato, la soluzione diventa acida (maggiore concentrazione di ioni idrogeno) o basica (maggiore concentrazione di ioni idrossido). |
||
| Riga 355: | Riga 355: | ||
è l'acqua ad agire da acido, donando il suo ione H<sup>+</sup> a quest'ultima. |
è l'acqua ad agire da acido, donando il suo ione H<sup>+</sup> a quest'ultima. |
||
Lo ione H<sub>3</sub>O<sup>+</sup>, presente sempre in piccole quantità insieme alla normale molecola d'acqua, si forma in seguito alla reazione chimica di |
Lo ione H<sub>3</sub>O<sup>+</sup>, presente sempre in piccole quantità insieme alla normale molecola d'acqua, si forma in seguito alla reazione chimica di "autoprotolisi dell'acqua":<ref>{{Cita|Lausarot}}.</ref> |
||
:<chem>2H2O <=> H3O+ + OH-</chem> |
:<chem>2H2O <=> H3O+ + OH-</chem> |
||
Questa reazione è anche nota come |
Questa reazione è anche nota come [[autoionizzazione]],<ref>{{Cita|Brandi}}.</ref> "semi-ionizzazione" o "autodissociazione" dell'acqua, e spiega la natura anfotera dell'acqua.<ref>A. Post Baracchi, A.Tagliabue, ''Chimica, progetto modulare'', ed. Lattes, ISBN 978-88-8042-414-7, p.383</ref> |
||
== L'importanza biologica dell'acqua == |
== L'importanza biologica dell'acqua == |
||
| Riga 410: | Riga 410: | ||
=== L'acqua e la zona abitabile === |
=== L'acqua e la zona abitabile === |
||
La presenza di acqua liquida (e in misura minore nelle forme gassosa e solida) sulla Terra è una condizione essenziale per lo sviluppo e il [[Biosfera|sostentamento della vita]] come la conosciamo. La Terra presenta tali condizioni favorevoli poiché si trova in quella che gli astronomi definiscono |
La presenza di acqua liquida (e in misura minore nelle forme gassosa e solida) sulla Terra è una condizione essenziale per lo sviluppo e il [[Biosfera|sostentamento della vita]] come la conosciamo. La Terra presenta tali condizioni favorevoli poiché si trova in quella che gli astronomi definiscono [[zona abitabile]] del [[sistema solare]], ovvero una stretta fascia orbitale in cui l'[[irraggiamento]] da parte del [[Sole]] è tale da mantenere l'acqua allo stato liquido: infatti, se solo il nostro pianeta fosse stato più lontano,o più vicino alla nostra stella, anche solo del 5% (otto milioni di chilometri), le condizioni in grado di mantenere simultaneamente i tre stati fisici dell'acqua avrebbero avuto minori possibilità di verificarsi.<ref>{{en}} {{cita pubblicazione|autore= J. C. I. Dooge| titolo= Integrated management of water resources| rivista= E. Ehlers, T. Krafft. ''Understanding the Earth System: compartments, processes, and interactions'', Springer| anno= 2001| p= 116| url=http://www.daviddarling.info/encyclopedia/H/habzone.html }}</ref> |
||
Definire la nozione di |
Definire la nozione di [[abitabilità planetaria]] comincia dallo studio delle [[stelle]]: infatti, l'abitabilità di un pianeta dipende in buona parte dalle caratteristiche del sistema planetario, e dunque della stella, che lo ospita.<ref name= extraterr>{{Cita|Dick}}.</ref> Si stima attualmente che il [[classificazione stellare|dominio spettrale]] appropriato per le stelle con pianeti abitabili vada dall'inizio della [[nana bianco-gialla|classe F]] o [[nana gialla|G]] fino a metà della [[nana arancione|classe spettrale K]]; si tratta di stelle non troppo calde né troppo fredde, che stanno nella [[sequenza principale]] sufficientemente a lungo perché la vita abbia possibilità di [[origine della vita|comparire]] ed [[evoluzione|evolvere]] sino anche a forme complesse.<ref name= extraterr/> Questo tipo di stelle costituisce probabilmente dal 5 al 10% delle stelle della nostra galassia. |
||
Poco favorevoli ad ospitare la vita sembrano essere i sistemi planetari attorno alle [[nana rossa|nane rosse]], ovvero le stelle tra la classe K e la classe M. Esse, pur avendo periodi di vita estremamente lunghi (teoricamente, anche centinaia di miliardi di anni o più),<ref>{{cita web | lingua= en | autore= S. A Naftilan | coautori= P. B. Stetson | data= 13 luglio 2006 | url= http://www.sciam.com/article.cfm?id=how-do-scientists-determi | titolo= How do scientists determine the ages of stars? Is the technique really accurate enough to use it to verify the age of the universe? | editore= [[Scientific American]] | accesso= 27 febbraio 2009 | urlmorto= sì | urlarchivio= https://web.archive.org/web/20081205101428/http://www.sciam.com/article.cfm?id=how-do-scientists-determi | dataarchivio= 5 dicembre 2008 }}</ref><ref>{{en}} {{cita pubblicazione | autore= G. Laughlin |coautori= P. Bodenheimer, F. C. Adams | titolo= The end of the main sequence | rivista= The Astrophysical Journal | anno= 1997 | volume= 482 | pp= 420-432 | url= http://adsabs.harvard.edu/abs/1997ApJ...482..420L | accesso=14 agosto 2009 }}</ref> possiedono delle [[luminosità (fisica)|luminosità]] così basse che, perché le condizioni di [[insolazione]] della superficie del pianeta siano favorevoli alla vita, esso dovrebbe orbitare ad una distanza tale che le [[forza di marea|forze di marea]] lo vincolerebbero in un'[[rotazione sincrona|orbita sincrona]]; inoltre, alcune nane rosse manifestano dei [[stella a brillamento|violenti episodi di variabilità]]. Tuttavia, la questione concernente l'effettiva [[abitabilità dei sistemi planetari delle nane rosse]] resta aperta e riveste grandissima importanza, in quanto la maggioranza delle stelle (circa il 65 %) della Galassia fanno parte di questa categoria.<ref>{{en}} {{cita pubblicazione | autore = A. Burrows |coautori= W. B. Hubbard, D. Saumon, J. I. Lunine | titolo= An expanded set of brown dwarf and very low mass star models | rivista= [[Astrophysical Journal]] | anno= 1993 | volume= 406 | numero= 1 | pp= 158-171 | url=http://adsabs.harvard.edu/abs/1998RPPh...61...77K | doi= 10.1086/172427}}</ref> |
Poco favorevoli ad ospitare la vita sembrano essere i sistemi planetari attorno alle [[nana rossa|nane rosse]], ovvero le stelle tra la classe K e la classe M. Esse, pur avendo periodi di vita estremamente lunghi (teoricamente, anche centinaia di miliardi di anni o più),<ref>{{cita web | lingua= en | autore= S. A Naftilan | coautori= P. B. Stetson | data= 13 luglio 2006 | url= http://www.sciam.com/article.cfm?id=how-do-scientists-determi | titolo= How do scientists determine the ages of stars? Is the technique really accurate enough to use it to verify the age of the universe? | editore= [[Scientific American]] | accesso= 27 febbraio 2009 | urlmorto= sì | urlarchivio= https://web.archive.org/web/20081205101428/http://www.sciam.com/article.cfm?id=how-do-scientists-determi | dataarchivio= 5 dicembre 2008 }}</ref><ref>{{en}} {{cita pubblicazione | autore= G. Laughlin |coautori= P. Bodenheimer, F. C. Adams | titolo= The end of the main sequence | rivista= The Astrophysical Journal | anno= 1997 | volume= 482 | pp= 420-432 | url= http://adsabs.harvard.edu/abs/1997ApJ...482..420L | accesso=14 agosto 2009 }}</ref> possiedono delle [[luminosità (fisica)|luminosità]] così basse che, perché le condizioni di [[insolazione]] della superficie del pianeta siano favorevoli alla vita, esso dovrebbe orbitare ad una distanza tale che le [[forza di marea|forze di marea]] lo vincolerebbero in un'[[rotazione sincrona|orbita sincrona]]; inoltre, alcune nane rosse manifestano dei [[stella a brillamento|violenti episodi di variabilità]]. Tuttavia, la questione concernente l'effettiva [[abitabilità dei sistemi planetari delle nane rosse]] resta aperta e riveste grandissima importanza, in quanto la maggioranza delle stelle (circa il 65 %) della Galassia fanno parte di questa categoria.<ref>{{en}} {{cita pubblicazione | autore = A. Burrows |coautori= W. B. Hubbard, D. Saumon, J. I. Lunine | titolo= An expanded set of brown dwarf and very low mass star models | rivista= [[Astrophysical Journal]] | anno= 1993 | volume= 406 | numero= 1 | pp= 158-171 | url=http://adsabs.harvard.edu/abs/1998RPPh...61...77K | doi= 10.1086/172427}}</ref> |
||
| Riga 420: | Riga 420: | ||
Perché possa ospitare condizioni favorevoli alla presenza di acqua liquida, un pianeta deve possedere una [[gravità superficiale]] in grado di trattenere un cospicuo [[atmosfera|involucro atmosferico]]; essa non deve essere troppo grande (in quanto potrebbe mantenere allo stato solido l'acqua anche ad elevate temperature), ma neanche troppo piccola (in quanto tratterrebbe solamente una tenue atmosfera, causando eccessive [[escursione termica|escursioni termiche]] e favorendo l'accumulo di acqua solamente nelle [[regioni polari]]). La presenza poi di vapore acqueo e [[diossido di carbonio]] nell'atmosfera causa un [[effetto serra]] che consente di mantenere stabile la temperatura superficiale.<ref>{{Cita|Doyle}}.</ref> |
Perché possa ospitare condizioni favorevoli alla presenza di acqua liquida, un pianeta deve possedere una [[gravità superficiale]] in grado di trattenere un cospicuo [[atmosfera|involucro atmosferico]]; essa non deve essere troppo grande (in quanto potrebbe mantenere allo stato solido l'acqua anche ad elevate temperature), ma neanche troppo piccola (in quanto tratterrebbe solamente una tenue atmosfera, causando eccessive [[escursione termica|escursioni termiche]] e favorendo l'accumulo di acqua solamente nelle [[regioni polari]]). La presenza poi di vapore acqueo e [[diossido di carbonio]] nell'atmosfera causa un [[effetto serra]] che consente di mantenere stabile la temperatura superficiale.<ref>{{Cita|Doyle}}.</ref> |
||
È stato suggerito che le stesse forme di vita<ref>Intendendo con il termine "forme di vita" non solo le singole specie, ma l'insieme di tutte le forme di vita.</ref> possano contribuire a mantenere le condizioni favorevoli alla propria esistenza. La temperatura superficiale sulla Terra è stata relativamente costante nel susseguirsi delle [[era geologica|ere geologiche]], nonostante le variazioni, anche forti, dell'[[insolazione]] media superficiale, e questo indicherebbe che una serie di [[Sistema dinamico|processi dinamici]] regolerebbero la temperatura del pianeta tramite una combinazione di gas serra e dell'[[albedo]] superficiale o atmosferico. Tale teoria prende il nome di |
È stato suggerito che le stesse forme di vita<ref>Intendendo con il termine "forme di vita" non solo le singole specie, ma l'insieme di tutte le forme di vita.</ref> possano contribuire a mantenere le condizioni favorevoli alla propria esistenza. La temperatura superficiale sulla Terra è stata relativamente costante nel susseguirsi delle [[era geologica|ere geologiche]], nonostante le variazioni, anche forti, dell'[[insolazione]] media superficiale, e questo indicherebbe che una serie di [[Sistema dinamico|processi dinamici]] regolerebbero la temperatura del pianeta tramite una combinazione di gas serra e dell'[[albedo]] superficiale o atmosferico. Tale teoria prende il nome di [[Ipotesi Gaia]].<ref>{{Cita|Lovelock}}.</ref> |
||
Diverse sono le teorie in merito all'[[origine dell'acqua sulla Terra]]. Le due ipotesi più accreditate ritengono che l'acqua o sia giunta sulla Terra a seguito degli impatti con le comete e asteroidi, molto frequenti agli [[origine ed evoluzione del sistema solare|albori del sistema solare]], oppure a seguito della grande [[vulcanismo|attività vulcanica]] della Terra primordiale, che avrebbe rilasciato nell'atmosfera grandi quantità di vapore acqueo che poi sarebbe precipitato al suolo sotto forma di [[precipitazione (meteorologia)|fenomeni idrometeorici]].<ref>{{en}} {{cita pubblicazione| autore= J. Horgan |titolo= In the beginning |rivista= [[Scientific American]] | anno= 1991 |volume= 264 |pp= 100-109 }}</ref><ref>{{Cita|Gonzalez}}.</ref> |
Diverse sono le teorie in merito all'[[origine dell'acqua sulla Terra]]. Le due ipotesi più accreditate ritengono che l'acqua o sia giunta sulla Terra a seguito degli impatti con le comete e asteroidi, molto frequenti agli [[origine ed evoluzione del sistema solare|albori del sistema solare]], oppure a seguito della grande [[vulcanismo|attività vulcanica]] della Terra primordiale, che avrebbe rilasciato nell'atmosfera grandi quantità di vapore acqueo che poi sarebbe precipitato al suolo sotto forma di [[precipitazione (meteorologia)|fenomeni idrometeorici]].<ref>{{en}} {{cita pubblicazione| autore= J. Horgan |titolo= In the beginning |rivista= [[Scientific American]] | anno= 1991 |volume= 264 |pp= 100-109 }}</ref><ref>{{Cita|Gonzalez}}.</ref> |
||
| Riga 462: | Riga 462: | ||
L'[[Antropizzazione|inquinamento di origine antropica]], soprattutto quello derivante dallo [[Scarico (ingegneria idraulica)|scarico]] nelle acque naturali di [[Acque reflue|reflui organici]] di origine civile, può introdurre nei corpi idrici microrganismi non tipici dell'ecosistema acquatico, che costituiscono una microflora d'inquinamento. Tra questi vi possono essere anche batteri [[patogeni]] dei generi [[Salmonella]], [[Shigella]], [[Vibrio]], [[Clostridium]], [[Pseudomonas]], [[Campylobacter]], [[Mycobacterium]], Legionella, ecc., oltre a [[protozoi]], [[elminti]] e [[Virus (biologia)|virus]] di origine enterica. La presenza di questi patogeni può essere pericolosa soprattutto per quelle acque che sono utilizzate dall'uomo per scopi potabili o ricreativi.<ref>{{cita pubblicazione|autore= [[Istituto Superiore di Sanità]] | titolo= Microbiologia delle acque di diversa derivazione | rivista= Rapporti Istisan 04/14 | anno= 2004 | url= http://www.iss.it/binary/publ/publi/0414.1106219382.pdf}}</ref> |
L'[[Antropizzazione|inquinamento di origine antropica]], soprattutto quello derivante dallo [[Scarico (ingegneria idraulica)|scarico]] nelle acque naturali di [[Acque reflue|reflui organici]] di origine civile, può introdurre nei corpi idrici microrganismi non tipici dell'ecosistema acquatico, che costituiscono una microflora d'inquinamento. Tra questi vi possono essere anche batteri [[patogeni]] dei generi [[Salmonella]], [[Shigella]], [[Vibrio]], [[Clostridium]], [[Pseudomonas]], [[Campylobacter]], [[Mycobacterium]], Legionella, ecc., oltre a [[protozoi]], [[elminti]] e [[Virus (biologia)|virus]] di origine enterica. La presenza di questi patogeni può essere pericolosa soprattutto per quelle acque che sono utilizzate dall'uomo per scopi potabili o ricreativi.<ref>{{cita pubblicazione|autore= [[Istituto Superiore di Sanità]] | titolo= Microbiologia delle acque di diversa derivazione | rivista= Rapporti Istisan 04/14 | anno= 2004 | url= http://www.iss.it/binary/publ/publi/0414.1106219382.pdf}}</ref> |
||
L'analisi microbiologica di un'acqua, tuttavia, più che alla ricerca dei patogeni, tende a rilevare microrganismi che sono definiti |
L'analisi microbiologica di un'acqua, tuttavia, più che alla ricerca dei patogeni, tende a rilevare microrganismi che sono definiti "indicatori d'inquinamento fecale", che albergano nell'intestino umano e di animali e vengono quindi eliminati con le feci. |
||
Questi indicatori hanno la caratteristica di avere concentrazioni, nei reflui organici, notevolmente superiori a quelle di eventuali patogeni e, inoltre, richiedono tecniche di rilevamento molto più semplici, per cui si possono facilmente inserire nei protocolli analitici di routine per la caratterizzazione microbiologica delle acque.<ref>{{cita pubblicazione|autore= Istituto Superiore di Sanità | titolo= Metodi analitici di riferimento per le acque destinate al consumo umano ai sensi del DL.vo 31/2001.Metodi microbiologici| rivista= Rapporti Istisan 07/5 | anno= 2007 | url=http://www.iss.it/binary/publ/cont/07-5.1179132742.pdf}}</ref> |
Questi indicatori hanno la caratteristica di avere concentrazioni, nei reflui organici, notevolmente superiori a quelle di eventuali patogeni e, inoltre, richiedono tecniche di rilevamento molto più semplici, per cui si possono facilmente inserire nei protocolli analitici di routine per la caratterizzazione microbiologica delle acque.<ref>{{cita pubblicazione|autore= Istituto Superiore di Sanità | titolo= Metodi analitici di riferimento per le acque destinate al consumo umano ai sensi del DL.vo 31/2001.Metodi microbiologici| rivista= Rapporti Istisan 07/5 | anno= 2007 | url=http://www.iss.it/binary/publ/cont/07-5.1179132742.pdf}}</ref> |
||
| Riga 488: | Riga 488: | ||
Poiché moltissime sostanze hanno una certa solubilità in acqua, in [[natura]] praticamente non esistono acque pure. |
Poiché moltissime sostanze hanno una certa solubilità in acqua, in [[natura]] praticamente non esistono acque pure. |
||
Le |
Le [[Precipitazione (meteorologia)|acque meteoriche]] contengono gas normalmente presenti nell'atmosfera (principalmente [[azoto|N<sub>2</sub>]], [[ossigeno|O<sub>2</sub>]] e [[anidride carbonica|CO<sub>2</sub>]]), quelli localmente presenti per via di attività [[industria]]li o di [[centro abitato|centri abitati]] ([[diossido di zolfo|SO<sub>2</sub>]], [[triossido di zolfo|SO<sub>3</sub>]], [[NOx|ossidi di azoto]], [[monossido di carbonio|CO]]) e quelli che provengono dalla decomposizione di [[composto organico|sostanze organiche]] naturali ([[solfuro di idrogeno|H<sub>2</sub>S]], [[ammoniaca|NH<sub>3</sub>]]). L'acqua meteorica può reagire con tali sostanze. Un esempio è dato dal fenomeno della [[pioggia acida]]: |
||
:<chem>SO3 + H2O -> H2SO4</chem> |
:<chem>SO3 + H2O -> H2SO4</chem> |
||
[[File:Grotte de Soreq, israel, Stalactite.JPG|thumb|left|L'acqua è associata alla formazione delle stalattiti]] |
[[File:Grotte de Soreq, israel, Stalactite.JPG|thumb|left|L'acqua è associata alla formazione delle stalattiti]] |
||
Le |
Le [[acque sotterranee]], alimentate dall'infiltrazione delle acque meteoriche, da cui il terreno filtra le sostanze in [[sospensione (chimica)|sospensione]], sono [[Acqua minerale|acque minerali]]. A volte le acque sotterranee fuoriescono spontaneamente diventando [[sorgiva|acque sorgive]] (notevolmente pregiate per l'uso potabile per la mancanza di organismi patogeni, ma spesso la qualità viene minacciata da [[erbicida|erbicidi]] e [[pesticida|pesticidi]], che sono estremamente dannosi per la salute). |
||
Le acque sotterranee, [[ossidazione|ossidando]] le [[composto organico|sostanze organiche]] presenti nel suolo, si arricchiscono di anidride carbonica, facilitando la dissoluzione di [[calcare|rocce calcaree]] secondo la [[reazione chimica|reazione]]: |
Le acque sotterranee, [[ossidazione|ossidando]] le [[composto organico|sostanze organiche]] presenti nel suolo, si arricchiscono di anidride carbonica, facilitando la dissoluzione di [[calcare|rocce calcaree]] secondo la [[reazione chimica|reazione]]: |
||
| Riga 501: | Riga 501: | ||
Se la concentrazione del diossido di carbonio è elevata, la quantità di roccia dissolta è elevata e si possono formare delle [[grotta|grotte]]; tale fenomeno in [[Italia]] è chiamato [[carsismo]] (dalla regione del [[Carso]], dove questo fenomeno è frequente). La reazione chimica anzidetta può avvenire in entrambe le direzioni (da sinistra verso destra o da destra verso sinistra): dalla reazione inversa alla precedente, con l'eliminazione dell'anidride carbonica, si ha quindi la formazione di [[stalattite|stalattiti]] e [[stalagmite|stalagmiti]]. |
Se la concentrazione del diossido di carbonio è elevata, la quantità di roccia dissolta è elevata e si possono formare delle [[grotta|grotte]]; tale fenomeno in [[Italia]] è chiamato [[carsismo]] (dalla regione del [[Carso]], dove questo fenomeno è frequente). La reazione chimica anzidetta può avvenire in entrambe le direzioni (da sinistra verso destra o da destra verso sinistra): dalla reazione inversa alla precedente, con l'eliminazione dell'anidride carbonica, si ha quindi la formazione di [[stalattite|stalattiti]] e [[stalagmite|stalagmiti]]. |
||
Le |
Le acque superficiali hanno composizione estremamente variabile a seconda delle condizioni climatiche ed ambientali.<ref>{{Cita|Polizzotti|p. 28}}.</ref> Si possono classificare in acque dolci (3%, per circa i {{Frazione|3|4}} allo stato liquido) e salate. Il [[mar Mediterraneo]] contiene circa il 3,5% di [[sale|sali]] (77,7% [[cloruro di sodio]], 11% [[cloruro di magnesio]] ed il restante diviso tra [[solfato|solfati]] di [[solfato di magnesio|magnesio]], [[solfato di calcio|calcio]], [[solfato di potassio|potassio]], [[carbonato di calcio]] e [[bromuro di magnesio]]). |
||
=== Risorse idriche terrestri === |
=== Risorse idriche terrestri === |
||
| Riga 514: | Riga 514: | ||
* {{Tutto attaccato|25 000 000 km<sup>3</sup>}} (pari a circa il 2% del totale) sono nei [[ghiacciaio|ghiacciai]] e nelle [[calotta polare|calotte polari]]. |
* {{Tutto attaccato|25 000 000 km<sup>3</sup>}} (pari a circa il 2% del totale) sono nei [[ghiacciaio|ghiacciai]] e nelle [[calotta polare|calotte polari]]. |
||
* {{Tutto attaccato|13 000 000 km<sup>3</sup>}} (pari a circa l'1% del totale) sono nel [[suolo]], nelle [[falda acquifera|falde acquifere]]. |
* {{Tutto attaccato|13 000 000 km<sup>3</sup>}} (pari a circa l'1% del totale) sono nel [[suolo]], nelle [[falda acquifera|falde acquifere]]. |
||
* {{Tutto attaccato|250 000 km<sup>3</sup>}} (pari a circa lo 0,02% del totale) sono acque dolci nei [[lago|laghi]], nei |
* {{Tutto attaccato|250 000 km<sup>3</sup>}} (pari a circa lo 0,02% del totale) sono acque dolci nei [[lago|laghi]], nei mari interni<ref>Un esempio di "mare interno" è il [[Mar Caspio]].</ref> e nei [[fiume|fiumi]]. |
||
* 13 000 km<sup>3</sup> sono [[vapore acqueo]] nell'[[atmosfera]]. |
* 13 000 km<sup>3</sup> sono [[vapore acqueo]] nell'[[atmosfera]]. |
||
| Riga 566: | Riga 566: | ||
Minore, ma tutt'altro che trascurabile, fu anche l'importanza dei mari interni, soprattutto il [[mar Mediterraneo]], che facilitavano i [[commercio|commerci]] e i contatti [[cultura]]li fra popoli lontani, con la formazione di civiltà prevalentemente dedicate al commercio (anzitutto i [[Fenici]]).<ref>{{Cita|Montevecchi}}.</ref> |
Minore, ma tutt'altro che trascurabile, fu anche l'importanza dei mari interni, soprattutto il [[mar Mediterraneo]], che facilitavano i [[commercio|commerci]] e i contatti [[cultura]]li fra popoli lontani, con la formazione di civiltà prevalentemente dedicate al commercio (anzitutto i [[Fenici]]).<ref>{{Cita|Montevecchi}}.</ref> |
||
L'importanza dell'acqua è riconosciuta nelle [[religione|religioni]] e nei [[filosofia|sistemi filosofici]] sin dai tempi [[età antica|antichi]].<ref>{{Cita|Hidiroglou}}.</ref> Molte religioni venerano [[dio|dei]] legati all'acqua o i corsi d'acqua stessi (ad esempio, il [[Gange]] è una dea per l'[[induismo]]).<ref>{{Cita|Herbert}}.</ref> Ancora, [[semidio|semidivinità]] particolari, chiamate [[Ninfa (mitologia)|Ninfe]], sono posti nella mitologia greca a guardia di particolari fonti d'acqua.<ref>{{Cita|Becatti}}.</ref> L'acqua, poi, fu considerata un elemento primigenio presso molti popoli, anche molto lontani fra loro; ad esempio in [[Cina]] venne identificata con il caos, da cui ha avuto origine l'universo, mentre nella [[Genesi]] compare già nel secondo versetto, prima della luce e delle terre emerse. Anche il filosofo greco [[Talete]] associò l'acqua all{{'}} |
L'importanza dell'acqua è riconosciuta nelle [[religione|religioni]] e nei [[filosofia|sistemi filosofici]] sin dai tempi [[età antica|antichi]].<ref>{{Cita|Hidiroglou}}.</ref> Molte religioni venerano [[dio|dei]] legati all'acqua o i corsi d'acqua stessi (ad esempio, il [[Gange]] è una dea per l'[[induismo]]).<ref>{{Cita|Herbert}}.</ref> Ancora, [[semidio|semidivinità]] particolari, chiamate [[Ninfa (mitologia)|Ninfe]], sono posti nella mitologia greca a guardia di particolari fonti d'acqua.<ref>{{Cita|Becatti}}.</ref> L'acqua, poi, fu considerata un elemento primigenio presso molti popoli, anche molto lontani fra loro; ad esempio in [[Cina]] venne identificata con il caos, da cui ha avuto origine l'universo, mentre nella [[Genesi]] compare già nel secondo versetto, prima della luce e delle terre emerse. Anche il filosofo greco [[Talete]] associò l'acqua all{{'}}origine di tutte le cose e asserì che la sua scorrevolezza è in grado di spiegare anche i mutamenti delle cose stesse.<ref>{{Cita|Mondin}}.</ref> Anche in [[Polinesia]] l'acqua venne considerata la materia prima fondamentale. |
||
[[File:Ludovisi throne Altemps Inv8570.jpg|thumb|Bassorilievo centrale del [[Trono Ludovisi]] ([[Roma]], [[Museo Nazionale Romano|Palazzo Altemps]]), raffigurante [[Afrodite]] che viene sollevata dalle acque]] |
[[File:Ludovisi throne Altemps Inv8570.jpg|thumb|Bassorilievo centrale del [[Trono Ludovisi]] ([[Roma]], [[Museo Nazionale Romano|Palazzo Altemps]]), raffigurante [[Afrodite]] che viene sollevata dalle acque]] |
||
| Riga 576: | Riga 576: | ||
L'indispensabilità dell'acqua per il fiorire della [[vita]] colpì molte civiltà. Ad esempio, nella lingua sumera "a" significa sia "acqua" sia "generazione". Nella maggior parte delle [[religione|religioni]], quindi, l'acqua è diventata un simbolo di rinnovamento e perciò di benedizione divina.<ref>cfr. ad esempio [[Libro di Isaia|Is.]] 35, 6 e [[Libro di Ezechiele|Ez.]] 47, 1-12.</ref> Essa compare logicamente nei riti di "[[Purificazione (Scintoismo)|purificazione]]" e di [[Rinascita (religione)|rinascita]] di molti [[culto|culti]], ad esempio nei riti di immersione del [[Battesimo|battesimo cristiano]] e nelle [[abluzione|abluzioni]] dell'[[ebraismo]] e dell'[[islam]]. Anche nello [[scintoismo]] l'acqua è usata nei rituali di purificazione di persone o luoghi.<ref>{{Cita|Ono}}.</ref> |
L'indispensabilità dell'acqua per il fiorire della [[vita]] colpì molte civiltà. Ad esempio, nella lingua sumera "a" significa sia "acqua" sia "generazione". Nella maggior parte delle [[religione|religioni]], quindi, l'acqua è diventata un simbolo di rinnovamento e perciò di benedizione divina.<ref>cfr. ad esempio [[Libro di Isaia|Is.]] 35, 6 e [[Libro di Ezechiele|Ez.]] 47, 1-12.</ref> Essa compare logicamente nei riti di "[[Purificazione (Scintoismo)|purificazione]]" e di [[Rinascita (religione)|rinascita]] di molti [[culto|culti]], ad esempio nei riti di immersione del [[Battesimo|battesimo cristiano]] e nelle [[abluzione|abluzioni]] dell'[[ebraismo]] e dell'[[islam]]. Anche nello [[scintoismo]] l'acqua è usata nei rituali di purificazione di persone o luoghi.<ref>{{Cita|Ono}}.</ref> |
||
La tradizione sapienzale [[misticismo|mistica]] [[ebraismo|ebraica]] della [[Cabala ebraica]] individua nell'acqua il simbolo della [[Sefirot|Sefirah]] [[Chessed]] indicante la qualità divina della [[Misericordia]], della gentilezza e della grandezza; molti i riferimenti della [[Torah]] all'acqua, anche suo simbolo. Secondo l'esegesi ebraica lo stesso termine |
La tradizione sapienzale [[misticismo|mistica]] [[ebraismo|ebraica]] della [[Cabala ebraica]] individua nell'acqua il simbolo della [[Sefirot|Sefirah]] [[Chessed]] indicante la qualità divina della [[Misericordia]], della gentilezza e della grandezza; molti i riferimenti della [[Torah]] all'acqua, anche suo simbolo. Secondo l'esegesi ebraica lo stesso termine "[[Ebreo]]", in [[ebraico]] ''Yivrì'', significa "colui che viene da oltre il fiume" ed è presente nella [[Bibbia ebraica]], usato per la prima volta riguardo ad [[Abramo]]. Il termine ebraico che traduce la parola "acqua", ''maim'', se associato al termine ''esh'', "fuoco", forma la parola ''shamaim'' che significa "cielo": si ritiene infatti che i cieli presentino l'unione di acqua e fuoco.{{senza fonte}} |
||
[[Mircea Eliade]] ha studiato analiticamente i miti acquatici nelle varie religioni: "Le acque simboleggiano la totalità delle virtualità". Eliade ha considerato: le Acque e i Germi; le [[cosmogonia|cosmogonie]] acquatiche (in [[India]], nell{{'}}''[[Enûma Eliš]]'' della [[mitologia babilonese]]); le ilogenie (origine del genere umano o di una razza dalle acque); l{{'}} |
[[Mircea Eliade]] ha studiato analiticamente i miti acquatici nelle varie religioni: "Le acque simboleggiano la totalità delle virtualità". Eliade ha considerato: |
||
* le Acque e i Germi; |
|||
* le [[cosmogonia|cosmogonie]] acquatiche (in [[India]], nell{{'}}''[[Enûma Eliš]]'' della [[mitologia babilonese]]); |
|||
* le ilogenie (origine del genere umano o di una razza dalle acque); |
|||
* l{{'}}[[acqua della vita]] (l'acqua ringiovanisce e dà la vita eterna); |
|||
* il simbolismo dell'immersione; |
|||
* il [[battesimo]]; |
|||
* la sete del morto (l'evangelica [[Parabola di Lazzaro e il ricco Epulone]], presso i [[Greci]], in [[Mesopotamia]], nell'antico [[Egitto]]); |
|||
* le fonti miracolose ed oracolari (già dal [[Neolitico]], poi ad esempio la [[delfi]]ca [[Pizia]]); |
|||
* le [[epifania|epifanie]] acquatiche e le divinità delle acque; |
|||
* le [[Ninfa (mitologia)|ninfe]]; |
|||
* [[Poseidone]] ed [[Ægir]]; |
|||
* gli animali ed emblemi acquatici (dragoni, delfini, serpenti, conchiglie, pesci, ecc., che regolano la fecondità del mondo e hanno la forza sacra dell'abisso); |
|||
* il simbolismo del [[Diluvio universale|diluvio]].<ref>''Trattato di storia delle religioni'', ed. Universale [[Bollati Boringhieri]], Torino, 2009, capitolo 5.</ref> |
|||
L'attribuzione all'acqua di caratteristiche negative è molto più rara e recente. Nel [[XVI secolo]], durante l'epidemia della peste, si pensò che l'acqua favorisse il [[contagio]], "aprendo" i [[poro (biologia)|pori]] della pelle attraverso cui si sarebbero infiltrati i presunti agenti patogeni, chiamati ''seminaria'', per cui si riteneva che il lavaggio del corpo indebolisse l'organismo, ed era pertanto sconsigliato.<ref>{{cita web | 1 = http://leonardodavinci.csa.fi.it/osservatorio/infea/html/igiene/peste.htm | 2 = Acqua e peste | 3 = 23-12-2008 | urlarchivio = https://web.archive.org/web/20090112183252/http://leonardodavinci.csa.fi.it/osservatorio/infea/html/igiene/peste.htm | dataarchivio = 12 gennaio 2009 | urlmorto = sì }}</ref> |
L'attribuzione all'acqua di caratteristiche negative è molto più rara e recente. Nel [[XVI secolo]], durante l'epidemia della peste, si pensò che l'acqua favorisse il [[contagio]], "aprendo" i [[poro (biologia)|pori]] della pelle attraverso cui si sarebbero infiltrati i presunti agenti patogeni, chiamati ''seminaria'', per cui si riteneva che il lavaggio del corpo indebolisse l'organismo, ed era pertanto sconsigliato.<ref>{{cita web | 1 = http://leonardodavinci.csa.fi.it/osservatorio/infea/html/igiene/peste.htm | 2 = Acqua e peste | 3 = 23-12-2008 | urlarchivio = https://web.archive.org/web/20090112183252/http://leonardodavinci.csa.fi.it/osservatorio/infea/html/igiene/peste.htm | dataarchivio = 12 gennaio 2009 | urlmorto = sì }}</ref> |
||
| Riga 661: | Riga 674: | ||
* [[Filtrazione (chimica)|Filtrazione]]<ref>{{Cita|Polizzotti|pp. 65-68}}.</ref> |
* [[Filtrazione (chimica)|Filtrazione]]<ref>{{Cita|Polizzotti|pp. 65-68}}.</ref> |
||
Una forma di [[inquinamento]] è rappresentata dallo scarico nell'ambiente di acque residue di processi industriali non opportunamente trattate ( |
Una forma di [[inquinamento]] è rappresentata dallo scarico nell'ambiente di acque residue di processi industriali non opportunamente trattate (inquinamento chimico) o di acque di raffreddamento ([[inquinamento termico]]).<ref>{{Cita|Chiesa}}.</ref> |
||
== Immagini 3D della molecola == |
== Immagini 3D della molecola == |
||
Versione delle 11:38, 12 gen 2022
| Acqua | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acqua, ossidano[1] | |
| Nomi alternativi | |
| monossido di diidrogeno | |
| Caratteristiche generali | |
| Formula bruta o molecolare | H2O |
| Massa molecolare (u) | 18,0153 |
| Aspetto | liquido incolore[2] |
| Numero CAS | |
| Numero EINECS | 231-791-2 |
| PubChem | 962 |
| DrugBank | DB09145 |
| SMILES | O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,99984 (0 °C),[3] 0,99705 (25 °C)[3] |
| Indice di rifrazione | 1,3330 |
| Temperatura di fusione | 0,00 °C (273,15 K) |
| ΔfusH0 (kJ·mol−1) | 6 (a 0,00 °C)[4] |
| ΔfusS0 (J·K−1mol−1) | 21,9 (a 0,00 °C)[4] |
| Temperatura di ebollizione | 100,00 °C (373,15 K) |
| ΔebH0 (kJ·mol−1) | 40,7[5] |
| Punto triplo | 273,16 K (0,01 °C) 611,73 Pa |
| Punto critico | 647 K (374 °C) 2,2064 × 107 Pa[3] |
| Tensione di vapore (Pa) a 293,15 K | 2338,54 |
| Sistema cristallino | esagonale (vedi cristalli di ghiaccio) |
| Viscosità cinematica (m2/s a 20 °C) | 1,1[6]-1,01x10-6[7] |
| Viscosità dinamica (mPa·s a 20 °C) | 1,002 × 10-3 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −285,8 |
| ΔfG0 (kJ·mol−1) | −237,1 |
| S0m(J·K−1mol−1) | 70,0 |
| C0p,m(J·K−1mol−1) | 75,3 |
| Indicazioni di sicurezza | |
| Frasi H | --- |
| Consigli P | ---[8] |
L'acqua è un composto chimico di formula molecolare H2O, in cui i due atomi di idrogeno sono legati all'atomo di ossigeno con legame covalente polare. In condizioni di temperatura e pressione normali[9] si presenta come un sistema bifase, costituito da un liquido incolore[2] e insapore (che viene chiamato "acqua" in senso stretto) e da un vapore incolore (detto vapore acqueo). Si presenta allo stato solido (detto ghiaccio) nel caso in cui la temperatura sia uguale o inferiore alla temperatura di congelamento.[10]
Essendo l'acqua un ottimo solvente, le acque naturali contengono disciolte moltissime altre sostanze, ed è per questo motivo che con il termine "acqua" si intende comunemente sia il composto chimico puro di formula H2O, sia la miscela (liquida) formata dallo stesso, con altre sostanze disciolte al suo interno.
L'acqua in natura è tra i principali costituenti degli ecosistemi ed è alla base di tutte le forme di vita conosciute, compreso l'essere umano; ad essa è dovuta anche la stessa origine della vita sul nostro pianeta ed è inoltre indispensabile anche nell'uso civile, agricolo e industriale; l'uomo ha riconosciuto sin da tempi antichissimi la sua importanza, identificandola come uno dei principali elementi costitutivi dell'universo e attribuendole un profondo valore simbolico, riscontrabile nelle principali religioni.
Sul pianeta Terra l'acqua copre il 71% della superficie del pianeta ed è il principale costituente del corpo umano.
Etimologia
Il termine "acqua" deriva dal latino aqua, dal protoitalico akʷā, a sua volta da una radice indoeuropea h₂ékʷeh₂ con collegamenti nell'area germanica (protogermanico ahwō) e nella lingua lusitana. Il termine in greco antico: ὕδωρ, ὕδατος?, hýdōr, hýdatos è imparentato con il protogermanico watōr (da una radice indoeuropea wódr̥) da cui discendono il tedesco wasser e l'inglese water; dalla stessa radice indoeuropea discende il latino unda (italiano "onda").
Fisica e chimica dell'acqua
Le prime scoperte scientifiche
La convinzione che l'acqua fosse un elemento primitivo e indivisibile si protrasse fino agli ultimi decenni del XVIII secolo, quando gli scienziati Lavoisier e Cavendish scoprirono che questa sostanza è formata in realtà da due costituenti: idrogeno e ossigeno.
Nel 1742, Anders Celsius definì la scala di temperatura che prende il suo nome, ponendo il punto di fusione dell'acqua (alla normale pressione atmosferica) a 100 gradi ed il punto di ebollizione a 0 gradi; nel 1745 però Linneo la invertì, arrivando alla scala come la conosciamo oggi.[11]

La prima scomposizione dell'acqua in idrogeno e ossigeno (i suoi componenti elementari) fu eseguita nel 1800 dal chimico inglese William Nicholson, tramite il processo di elettrolisi.[12] L'acqua è infatti parzialmente dissociata in ioni H+ e OH-, che migrano verso i due poli della cella elettrolitica, dove si svolgono le seguenti reazioni:
- anodo (+): 4 OH- → O2 + 2 H2O + 4 e-
- catodo (−): 2 H+ + 2 e− → H2
l'ossigeno e l'idrogeno vengono prodotti sotto forma di bolle gassose sulla superficie degli elettrodi, da cui possono essere raccolti.
Gilbert Newton Lewis ha isolato il primo campione di pura acqua pesante (in cui l'idrogeno è sostituito dal deuterio, suo isotopo) nel 1933.[13]
Una controversia scientifica è nata alla fine degli anni sessanta a proposito dell'esistenza di una forma polimerica dell'acqua (la "poliacqua"). È ormai condivisa l'opinione che tale "poliacqua" non esista.[14][15][16]
Nel 2007 grazie all'uso di supercomputer e alla meccanica quantistica è stato sviluppato un modello numerico dell'acqua che a partire dai principi quantomeccanici delle molecole ne estrapola il comportamento in modo corretto.[17]
Le forme fisiche dell'acqua

L'acqua assume più forme in natura. Allo stato solido è nota come ghiaccio, allo stato aeriforme è nota come vapore acqueo. Sono note anche altre due forme solide, quella del ghiaccio vetroso e quella del solido amorfo, non cristallino, simile al vetro (ghiaccio amorfo). A pressioni estreme il ghiaccio può assumere diversi stati solidi, numerati con numeri romani. La gamma delle forme solide dell'acqua è così vasta e varia da non essere nemmeno confrontabile con quella di alcun altro materiale[18].
Il ghiaccio e la neve con cui abbiamo a che fare presentano, di norma, una struttura cristallina esagonale (ghiaccio Ih). Solo leggermente meno stabile (metastabile) della forma esagonale è quella cubica (Ghiaccio Ic). Raffreddando il ghiaccio Ih si ha la formazione di una diversa configurazione, la forma del ghiaccio XI, nella quale i protoni presentano un'elevata mobilità.
A diverse temperature e pressioni possono esistere altri tipi di ghiaccio, che possono essere identificati nel diagramma di fase del ghiaccio. Tra questi, vi sono: II, III, V, VI, VII, VIII, IX, e X. Il passaggio da un ghiaccio all'altro avviene attraverso una transizione isotermica (come per tutte le transizioni di fase). Sotto opportune condizioni, tutti questi tipi possono esistere anche a temperatura ambiente. I vari tipi di ghiaccio differiscono per la loro struttura cristallina, ordinamento e densità.
Esistono due altre fasi del ghiaccio che sono metastabili: la IV e la XII. Il ghiaccio XII fu scoperto nel 1996 da C. Lobban, J.L. Finney e W.F. Kuhs.[19] Nel 2006 sono state scoperte le forme XIII e XIV.[20]
Oltre alle forme cristalline, l'acqua può esistere in stati amorfi: acqua solida amorfa, ghiaccio amorfo a bassa densità, ghiaccio amorfo ad alta densità, ghiaccio amorfo ad altissima densità e acqua vetrosa sottoraffreddata.
Esistono anche molecole d'acqua costituite da isotopi dell'idrogeno al posto del normale prozio (11H), che trovano impiego principalmente in ambito nucleare.
L'acqua pesante (D2O o 21H2O) è un'acqua in cui gli atomi di idrogeno sono sostituiti da atomi di deuterio, isotopo dell'idrogeno avente peso atomico 2 uma. Il suo comportamento chimico è sostanzialmente uguale a quello dell'acqua; trova applicazione in quanto è un moderatore meno efficace dell'acqua comune (idrogeno + ossigeno) dei neutroni emessi dalla fissione nucleare ma ha una sezione di assorbimento dei neutroni molto inferiore. In campo nucleare quindi l'acqua comune viene definita anche come acqua leggera.
Esiste anche un'altra forma meno stabile, chiamata acqua superpesante (T2O o 31H2O), in cui al posto degli atomi di idrogeno sono presenti atomi di trizio, isotopo dell'idrogeno avente peso atomico 3 uma.[21]
Nel 2016 viene scoperto un secondo stato liquido dell'acqua che si presenta ad una temperatura tra i 40° e i 60° con valori diversi di costante dielettrica e di rilassamento spin-reticolo cambiando il regime della dilatazione termica e della velocità di propagazione del suono[22].
I cambiamenti di stato dell'acqua

L'acqua è una delle pochissime sostanze esistenti (insieme a gallio, bismuto e antimonio) in cui il processo di solidificazione avviene con un aumento di volume specifico (pari a circa 0,087 L/kg, alla temperatura di 0 °C (273,15 K) alla pressione di 1 atm), mentre il suo punto di ebollizione è a 100 °C (373,15 K).[23] Ciò comporta che alla diminuzione della temperatura, la pressione corrispondente al passaggio di stato solido-liquido aumenti sensibilmente: si ha una pendenza negativa della linea di passaggio solido-liquido nel diagramma di fase pressione-temperatura. In particolare, per ogni centesimo di grado Celsius (0,01 °C) di diminuzione della temperatura si ha un aumento della pressione di fusione di circa una atmosfera. Questa relazione è verificata fino alla pressione di 2070 atm e alla temperatura di -22 °C, oltre la quale si hanno altri stati allotropici.
Alla pressione atmosferica (1 atm) l'acqua bolle alla temperatura di 100 °C. Come per tutte le altre sostanze, durante la trasformazione è necessario fornire una certa quantità di calore (detto calore latente), che nel caso dell'acqua è più elevato di ogni altra sostanza nota: a condizioni di 0 °C e di 1 atm questo calore di vaporizzazione è infatti pari a 2501 kJ/kg. Fra i 90 °C e i 250 °C vale la regola empirica per cui la pressione di vaporizzazione (in bar) è pari alla quarta potenza della centesima parte della temperatura di vaporizzazione (in gradi Celsius):

L'acqua superionica
Nel 1999 fu previsto dal SISSA di Trieste e “Abdus Salam” International Centre for Theoretical Physics (ICTP) di Trieste in via teorica l'esistenza di una fase dell'acqua chiamata "superionica"[24] o ghiaccio superionico. A febbraio 2018 uno studio pubblicato su Nature Physics di ricercatori del Lawrence Livermore National Laboratory ne conferma l'esistenza[24]. Dopo una certa pressione gli ioni ossigeno prendono forma di reticolo cristallino, tipico di un solido mentre gli ioni idrogeno si ritrovano in uno stato liquido[24].
Proprietà chimico-fisiche dell'acqua
L'acqua risulta blu perché quando la luce del sole, che contiene tutti i colori, vi penetra, alcuni colori vengono assorbiti dalle sue molecole, in particolare esse assimilano maggiormente i colori arancione e rosso, quindi quando la luce arriva ai nostri occhi ha minore colorazione arancione e rossa e ci appare come se fosse più blu rispetto a ciò che chiamiamo luce bianca.[25]
Invece per quanto riguarda l'acqua marina il motivo della colorazione è un po' diverso: i plancton che vi vivono, infatti, assorbono un po' di luce blu e rossa mentre la grande quantità di materia organica disciolta assorbe quasi esclusivamente luce blu. Questo fa sì che la luce restante tenda ad un blu più profondo e violaceo rispetto all'azzurro pallido dell'acqua pura. Invece il colore verde turchese delle acque dei mari del sud e delle isole dei Caraibi è dovuto all'ingente presenza di fitoplancton, diffusore particolarmente efficace di luce gialla e verde.[25]

Confrontata con altre sostanze dalle molecole simili per massa o omologhe di altri elementi dello stesso gruppo della tavola periodica (ad esempio l'acido solfidrico), l'acqua allo stato liquido presenta alcune anomalie:
- un punto di ebollizione molto alto;
- un volume molare piuttosto basso;
- un calore specifico elevato con un minimo a 35 °C;
- una viscosità che presenta un minimo alle alte pressioni;
- un punto di massimo nel diagramma densità-temperatura, per cui al di sotto della temperatura di massimo il liquido diminuisce di volume all'aumentare della temperatura.
Inoltre durante il processo di congelamento si ha un notevole aumento di volume.[26]
Queste anomalie sono causate dal fatto che l'organizzazione cristallina, dovuta nel ghiaccio ai legami idrogeno, sussiste ancora nell'acqua liquida, costituendo un edificio macromolecolare lacunare con legami interni mobili che diminuiscono di numero all'aumentare delle temperature e che formano un insieme di agglomerati polimerici a grappolo in equilibrio dinamico, e di molecole libere o legate in catene o in anelli.
A differenza della maggior parte delle altre sostanze,[27] per le quali la forma solida presenta una densità maggiore rispetto alla forma liquida, il ghiaccio è meno denso dell'acqua liquida.[28] La densità dell'acqua è infatti massima a 4 °C,[29] temperatura alla quale l'acqua è liquida. Ciò è dovuto appunto alla natura dei legami idrogeno, che tengono le molecole dell'acqua liquida più strette di quanto non lo siano allo stato solido.

Il fenomeno dell'espansione dell'acqua a basse temperature costituisce un vantaggio per tutte le creature che vivono in ambienti di acqua dolce d'inverno. L'acqua, raffreddandosi in superficie, aumenta di densità e scende verso il fondo innescando correnti convettive che raffreddano uniformemente l'intero bacino. Quando la temperatura in superficie scende sotto i 4 °C questo processo si arresta, e per la spinta di Archimede l'acqua più fredda rimane in superficie, dove, con un ulteriore calo della temperatura, forma uno strato di ghiaccio. Se l'acqua non avesse questa particolarità, i laghi ghiaccerebbero interamente, e di conseguenza tutte le forme di vita presenti morirebbero.
La situazione nelle acque salate è differente: il sale contenuto nell'acqua abbassa infatti sia il punto di congelamento dell'acqua (di circa 2 °C, per il fenomeno dell'abbassamento crioscopico) sia la temperatura a cui l'acqua raggiunge la sua massima densità (fino a circa 0 °C). Quindi nelle acque marine i moti convettivi che portano verso il fondo l'acqua più fredda non sono bloccati dal gradiente di densità, come avviene nelle acque dolci. Per questo le creature che vivono sul fondo degli oceani artici si sono dovute adattare, durante il loro processo evolutivo, a sopravvivere a temperature prossime a 0 °C.
Alle normali condizioni di salinità dell'acqua di mare, l'acqua congela a circa −1,9 °C. Il ghiaccio che si forma è sostanzialmente privo di sale (per cui presenta una densità pressoché uguale a quella del ghiaccio di acqua dolce). Questo ghiaccio galleggia sulla superficie, mentre il sale che ne è stato "espulso" aumenta la salinità e la densità dell'acqua circostante, la quale scende per convezione verso il fondo.
Le condizioni di temperatura e pressione in cui le fasi solida, liquida e gassosa di una sostanza coesistono in equilibrio tra loro è detta punto triplo. Per l'acqua il punto triplo viene assunto come riferimento per la misurazione della temperatura, avendo fissato per convenzione che questi è a 273,16 K (e a 0,01 °C); la pressione al punto triplo dell'acqua è di 611,2 Pa, che è un valore molto basso, se si considera che al livello del mare la pressione atmosferica vale mediamente 101.300 Pa.

L'acqua possiede un'elevata tensione superficiale,[30] osservabile dalla geometria sferica delle gocce d'acqua e dal fatto che alcuni oggetti (ad esempio un ago) o insetti riescono a galleggiare sulla superficie dell'acqua.[31] Altra diretta conseguenza della tensione superficiale è la capillarità. Essa consiste nella capacità dell'acqua di risalire (ovviamente per brevi tratti) in fessure e tubi sottilissimi. Tanto più la fessura è sottile tanto maggiore sarà lo spostamento acropeto (verso l'alto).[32] La tensione superficiale svolge un ruolo fondamentale nelle funzioni di molti organismi viventi. Un esempio è il trasporto dell'acqua negli xilemi degli steli delle piante; la tensione superficiale mantiene la colonna d'acqua unita e forze adesive mantengono l'acqua aderente allo xilema. Colonne altrettanto alte e sottili di liquidi meno coesi e meno aderenti andrebbero a spezzarsi, formando sacche d'aria o di vapore, rendendo inefficiente (o addirittura impossibile) il trasporto del liquido attraverso lo xilema.
L'acqua pura (distillata) è un buon isolante elettrico (cioè un cattivo conduttore). Ma, essendo anche un buon solvente, nella pratica sovente reca in sé tracce di sali disciolti in essa, che, con i loro ioni la rendono un buon conduttore di elettricità.[33]
Date le sue buone capacità solventi, l'acqua pura non è reperibile in natura.[34] Per semplice esposizione all'aria, l'acqua ne dissolve l'anidride carbonica, formando una soluzione molto diluita di acido carbonico che può arrivare fino ad un valore di pH 5,6.[35] Analogamente le gocce di pioggia presentano sempre una seppur minima acidità. La presenza di ossidi di zolfo o di azoto nell'atmosfera, tramite la loro dissoluzione nelle gocce di pioggia, porta a piogge acide aventi valori di pH minori di 5 (in Italia si sono registrati anche piogge acide con valori di pH intorno a 3,5),[36] i cui effetti sull'ambiente sono ben più seri. Il pH dell'acqua di mare è tra 7,7 e 8,4.[37]
La natura dipolare dell'acqua
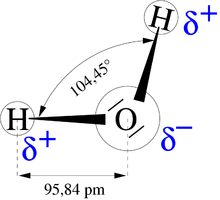
Una importante caratteristica dell'acqua è data dalla polarità della sua molecola, con momento di dipolo molecolare pari a 1,847 D.[38] La forma della molecola dell'acqua è assimilabile a un tetraedro[39] con l'atomo di ossigeno al centro, due atomi di idrogeno a due dei vertici e due doppietti elettronici non condivisi (lone pairs) agli altri due. Questi ultimi, per via della repulsione elettrostatica, distorcono leggermente la struttura tetraedrica, facendo sì che l'angolo formato dai due legami O-H sia di 104,45°, inferiore ai 109.5° di un tetraedro regolare.[40] Gli elettroni sono maggiormente attratti verso l'atomo di ossigeno, essendo questo più elettronegativo dell'idrogeno, pertanto i legami che si formano tra gli atomi di H e l'atomo di O sono chiamati "covalenti polari", in quanto presentano una parziale carica negativa in corrispondenza dell'atomo di ossigeno(2 δ-), e una parziale carica positiva in corrispondenza degli atomi di idrogeno(δ+).
È estremamente rilevante il fatto che l'acqua, essendo un composto anfotero, si autodissoci seppur in maniera estremanente limitata in anioni idrossido e cationi idrossonio. In effetti, da misure accurate risulta che l'acqua pura ha un pH pari a 7,00 a 25 °C e pressione ambiente.
Una molecola che presenta questo squilibrio di cariche elettriche è detta essere un dipolo elettrico. Le cariche fanno sì che molecole d'acqua vengano attratte reciprocamente l'una dall'altra. Questa attrazione nell'acqua è particolarmente intensa (anche se è molto più debole dei legami covalenti interni alla molecola stessa) e prende il nome di legame a idrogeno (o H-bond) e spiega molte delle proprietà fisiche tipiche dell'acqua.
La presenza del legame a idrogeno spiega ad esempio i valori relativamente alti del punto di fusione e del punto di ebollizione dell'acqua: è necessaria infatti una maggiore energia (rispetto a sostanze meno polari) per rompere i legami a idrogeno che tengono unite le molecole le une alle altre. Ad esempio l'acido solfidrico, H2S (simile per geometria ma incapace di formare legami a idrogeno), è un gas a temperatura ambiente, pur avendo un peso molecolare quasi doppio rispetto all'acqua.
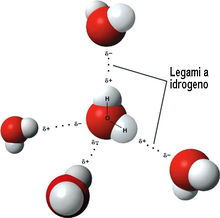
Sempre al legame a idrogeno è da attribuire l'elevata capacità termica specifica. Il legame a idrogeno spiega anche l'insolito comportamento dell'acqua quando questa congela: a causa di questo legame, quando la temperatura si abbassa fino al punto di congelamento, le molecole di acqua si organizzano in una struttura cristallina dalla simmetria esagonale tipica del ghiaccio, che risulta essere meno densa dell'acqua liquida.
Dal fatto che il ghiaccio sia meno denso dell'acqua liquida discende che il ghiaccio può essere fuso anche in seguito ad un aumento di pressione. Tale pressione risulta essere piuttosto elevata.[42] Allo stato solido ogni molecola di acqua si lega con altre quattro molecole mediante legami a idrogeno in una configurazione tetraedrica, dando luogo ad una conformazione tridimensionale a strati costituiti di anelli esagonali.
Allo stato liquido la continua formazione e rottura di legami a idrogeno dà luogo ad aggregati fluttuanti (chiamati "domini") molto estesi (dell'ordine di decine di molecole), dovuti al fatto che la formazione di un legame a idrogeno (H-bond) fra due molecole ne induce la formazione di un altro, innescando una sorta di reazione a catena. Ogni dominio ha una struttura simile a quella del ghiaccio; secondo una ricerca americana, a temperature tra 0 e 100 °C e pressione atmosferica, ogni molecola di acqua è circondata mediamente da altre 4,7 molecole[41] e la distanza fra due atomi di ossigeno di molecole attigue è di circa 3 Å, rendendo così molto influenti le interazioni a corto raggio. In particolare, ogni molecola di acqua instaura, alle condizioni anzidette, circa 1,35 legami idrogeno con le molecole di acqua vicine.[41] L'esistenza di questi domini impartisce all'acqua un elevato grado di strutturazione, che ne determina molte caratteristiche peculiari.
La durata della vita media di un dominio è un argomento molto controverso ed oggetto di dibattito; tralasciando le più o meno recenti polemiche sulla cosiddetta "memoria dell'acqua", la vita media di un dominio è comunemente ritenuta essere dell'ordine di 0,1 ns, ma esistono teorie ed evidenze sperimentali secondo cui potrebbe essere molto più lunga, cioè di alcuni secondi o anche più; secondo altre ricerche, invece, sarebbe assai più breve, dell'ordine dei 50 fs. Si è recentemente appurato, inoltre, che i processi di rilassamento nell'acqua avvengono seguendo diverse scale temporali; ciò vuol dire che coesistono aggregati molecolari diversi, ognuno con la propria struttura, che danno luogo ad un quadro estremamente complesso.[43][44][45][46][47]

Le macromolecole biologiche e le strutture sopramolecolari interagiscono con le molecole di acqua vicine (acqua di idratazione), modificandone alcune caratteristiche e subendo a loro volta modifiche nelle proprie caratteristiche. Le molecole di acqua dello strato di idratazione, ad esempio, hanno un'orientazione preferenziale ed una limitata libertà di movimento rotazionale e traslazionale, che fa passare i tempi di correlazione dai 10−12 s dell'acqua pura ai 10−6÷10−9 s dell'acqua dei gusci di idratazione.[48]
L'acqua forma clatrati idrati, costituiti da "gabbie" di molecole di acqua che circondano molecole o ioni estranei. Al di là dell'interesse per la loro struttura, che illustra quale organizzazione possa imporre il legame a idrogeno, gli idrati clatrati si assumono spesso a modello della maniera in cui l'acqua sembra organizzarsi intorno ai gruppi apolari, quali ad esempio quelli delle proteine.
Alcuni composti ionici formano idrati clatrati nei quali l'anione è incorporato nell'intelaiatura dei legami a idrogeno. Questo tipo di clatrati ricorre frequentemente con gli accettori di legame a idrogeno molto forti, quali F- e OH-. Le molecole di acqua inoltre mediano alcune reti di legami a idrogeno intracatena ed intercatena, contribuendo alla stabilizzazione ed al ripiegamento del collagene, che è una delle proteine più importanti in natura.
L'acqua come solvente

Chimicamente l'acqua è un buon solvente.[49] Le proprietà solventi dell'acqua sono essenziali per gli esseri viventi, dal momento che consentono lo svolgersi delle complesse reazioni chimiche che costituiscono le basi della vita stessa (ad esempio, quelle che avvengono nel sangue o nel citoplasma della cellula).
Il comportamento di solvente dell'acqua è determinato dalla polarità della sua molecola: quando un composto ionico o polare viene disciolto in acqua, viene circondato dalle molecole di acqua, le quali, si inseriscono tra uno ione e l'altro o tra una molecola e l'altra di soluto (grazie alle loro piccole dimensioni), orientandosi in modo da presentare ad ogni ione (o estremità polare) del soluto la parte di sé che reca la carica opposta; questo indebolisce l'attrazione tra gli ioni (o tra le molecole polari) e rompe la struttura cristallina; ogni ione (o ogni molecola polare) si ritrova quindi solvatato (o idratato), cioè circondato completamente da molecole d'acqua che interagiscono con esso.[49][50]
Un esempio di soluto ionico è il comune sale da cucina (cloruro di sodio), un esempio di soluto molecolare polare è lo zucchero.
In generale, le sostanze ioniche polari (quali acidi, alcoli e sali) sono abbastanza solubili in acqua, mentre non lo sono le sostanze non polari (quali grassi ed oli). Le molecole non polari non si miscelano all'acqua, perché per quest'ultima è favorita dal punto di vista energetico la formazione di legami a idrogeno al suo interno, piuttosto che la formazione di legami di Van der Waals con molecole non polari.
La natura anfotera dell'acqua

L'acqua è una sostanza anfotera, ovvero capace di comportarsi sia da acido che da base.
A pH 7 (condizione di neutralità) la concentrazione di ioni idrossido OH- è uguale a quella di ioni idrogeno H+ (o meglio ioni idrossonio H3O+). Quando questo equilibrio viene alterato, la soluzione diventa acida (maggiore concentrazione di ioni idrogeno) o basica (maggiore concentrazione di ioni idrossido).
In presenza di un acido più forte di essa, l'acqua si comporta da base, in presenza di un acido più debole di essa, l'acqua si comporta da acido. Ad esempio, nell'equilibrio:
l'acqua si comporta come base ed un acido le dona il suo ione H+. Invece nella reazione con l'ammoniaca:
è l'acqua ad agire da acido, donando il suo ione H+ a quest'ultima.
Lo ione H3O+, presente sempre in piccole quantità insieme alla normale molecola d'acqua, si forma in seguito alla reazione chimica di "autoprotolisi dell'acqua":[51]
Questa reazione è anche nota come autoionizzazione,[52] "semi-ionizzazione" o "autodissociazione" dell'acqua, e spiega la natura anfotera dell'acqua.[53]
L'importanza biologica dell'acqua

L'acqua è una componente fondamentale di tutti gli organismi viventi presenti sul nostro pianeta. Si trova in elevate percentuali nelle cellule (in particolare nel citoplasma e nei vacuoli, presenti nelle cellule vegetali e in alcuni protisti), al cui interno viene convogliata attraverso il processo di pinocitosi.[55] Nel protoplasma di tutte le cellule, sia procarioti sia eucarioti, l'acqua rappresenta il composto predominante e agisce come solvente per tutte le biomolecole (come carboidrati, proteine, vitamine idrosolubili ecc.), dando loro la possibilità di reagire tra di loro nelle varie reazioni biochimiche. Oltre che come solvente, l'acqua partecipa attivamente come reagente in diverse reazioni metaboliche, soprattutto quelle di idrolisi, ed è, assieme all'anidride carbonica, uno dei principali reagenti della fotosintesi clorofilliana; è inoltre, sempre assieme alla CO2, il prodotto conclusivo del processo di respirazione cellulare.
Essendo il principale costituente della gran parte dei viventi, l'acqua è quindi presente anche nell'organismo umano, in percentuali variabili a seconda dell'età, del sesso e del peso. I fluidi corporei che hanno il maggiore contenuto di acqua sono il liquido cefalo-rachidiano (99%), il midollo osseo (99%) e il plasma sanguigno (85%).[56] Risulta quindi di fondamentale importanza per il trasporto dei nutrienti in tutti i distretti corporei e per l'eliminazione e l'escrezione, tramite l'urina, delle scorie prodotte nelle reazioni biochimiche. L'acqua inoltre svolge una funzione determinante nella regolazione della temperatura corporea (tramite la sudorazione) e della concentrazione dei sali minerali; partecipa inoltre alla digestione, favorendo il transito intestinale e l'assorbimento delle sostanze nutritive. Proprio perché l'acqua deve essere presente in quantità molto elevate nell'alimentazione umana viene classificata come "macronutriente".[57]
Nelle piante è il componente principale della linfa, che ha la funzione di trasportare i principi nutritivi in tutti i tessuti, e dei vacuoli, che regolano la pressione osmotica. Nell'organismo umano l'acqua costituisce il 65% del peso corporeo, diminuendo gradualmente all'avanzare dell'età e a seconda del sesso.[58][59]
| Bambino | Uomo | Donna | |
|---|---|---|---|
| Magro | 80 | 65 | 55 |
| Normale | 70 | 60 | 50 |
| Obeso | 65 | 55 | 45 |
L'acqua nell'universo

Nelle nubi interstellari della nostra galassia, la Via Lattea, è stata riscontrata la presenza di molecole d'acqua.[60] Si presume che l'acqua sia abbondante anche in altre galassie, dato che i suoi componenti elementari (idrogeno e ossigeno) sono tra i più abbondanti elementi dell'universo.
Gran parte dell'acqua presente nell'universo potrebbe essere un prodotto secondario della fase di formazione stellare.[61] Le stelle, al termine della loro formazione, emettono un vento stellare particolarmente intenso, accompagnato dall'emissione di un grande flusso di gas e polveri; quando questo flusso impatta contro il gas residuo della nube molecolare, si generano delle onde d'urto che comprimono e riscaldano i gas. L'acqua riscontrata all'interno delle nebulose in cui è presente un'attività di formazione stellare si è originata rapidamente a partire dal gas compresso riscaldato.[62]
Un "sottoprodotto" della fase di formazione stellare è la formazione di sistemi planetari, anche simili al sistema solare.[63] In simili sistemi sarebbe possibile rintracciare acqua su corpi celesti non molto caldi, quali comete, pianeti e satelliti. Nel nostro sistema solare, acqua allo stato liquido è stata rinvenuta (oltre che sulla Terra) sulla Luna.[64] Concreta è la possibilità che acqua liquida sia presente anche al di sotto della superficie della luna di Saturno Encelado e della luna di Giove Europa.
Sotto forma di ghiaccio, è stata trovata su:
- Marte (per lo più tracce)
- i satelliti di alcuni pianeti, tra cui Titano, Europa, Encelado e Tritone.
È probabile che tracce di ghiaccio d'acqua si trovino sulla superficie lunare, sul pianeta nano Cerere e sul satellite di Saturno Teti. Ghiaccio sarebbe contenuto anche nell'interno di Urano e Nettuno e sul planetoide Plutone, oltre che nelle comete.

Allo stato gassoso (vapore acqueo) è stata trovata su:
- Mercurio (3,4% nell'atmosfera e in alte percentuali nell'esosfera)[65]
- Venere (0,002% nell'atmosfera)
- Marte (0,03% nell'atmosfera)
- Giove (0,0004% nell'atmosfera)
- Encelado (91% nell'atmosfera)
- sugli esopianeti HD 189733 b[66] ed HD 209458 b.[67]
La presenza dell'acqua nell'universo viene considerata dall'esobiologia come un fattore chiave per lo sviluppo della vita in pianeti differenti dal nostro. Alla presenza dell'acqua si richiamano infatti molte teorie sull'origine della vita.
L'acqua e la zona abitabile
La presenza di acqua liquida (e in misura minore nelle forme gassosa e solida) sulla Terra è una condizione essenziale per lo sviluppo e il sostentamento della vita come la conosciamo. La Terra presenta tali condizioni favorevoli poiché si trova in quella che gli astronomi definiscono zona abitabile del sistema solare, ovvero una stretta fascia orbitale in cui l'irraggiamento da parte del Sole è tale da mantenere l'acqua allo stato liquido: infatti, se solo il nostro pianeta fosse stato più lontano,o più vicino alla nostra stella, anche solo del 5% (otto milioni di chilometri), le condizioni in grado di mantenere simultaneamente i tre stati fisici dell'acqua avrebbero avuto minori possibilità di verificarsi.[68]
Definire la nozione di abitabilità planetaria comincia dallo studio delle stelle: infatti, l'abitabilità di un pianeta dipende in buona parte dalle caratteristiche del sistema planetario, e dunque della stella, che lo ospita.[69] Si stima attualmente che il dominio spettrale appropriato per le stelle con pianeti abitabili vada dall'inizio della classe F o G fino a metà della classe spettrale K; si tratta di stelle non troppo calde né troppo fredde, che stanno nella sequenza principale sufficientemente a lungo perché la vita abbia possibilità di comparire ed evolvere sino anche a forme complesse.[69] Questo tipo di stelle costituisce probabilmente dal 5 al 10% delle stelle della nostra galassia.
Poco favorevoli ad ospitare la vita sembrano essere i sistemi planetari attorno alle nane rosse, ovvero le stelle tra la classe K e la classe M. Esse, pur avendo periodi di vita estremamente lunghi (teoricamente, anche centinaia di miliardi di anni o più),[70][71] possiedono delle luminosità così basse che, perché le condizioni di insolazione della superficie del pianeta siano favorevoli alla vita, esso dovrebbe orbitare ad una distanza tale che le forze di marea lo vincolerebbero in un'orbita sincrona; inoltre, alcune nane rosse manifestano dei violenti episodi di variabilità. Tuttavia, la questione concernente l'effettiva abitabilità dei sistemi planetari delle nane rosse resta aperta e riveste grandissima importanza, in quanto la maggioranza delle stelle (circa il 65 %) della Galassia fanno parte di questa categoria.[72]

Perché possa ospitare condizioni favorevoli alla presenza di acqua liquida, un pianeta deve possedere una gravità superficiale in grado di trattenere un cospicuo involucro atmosferico; essa non deve essere troppo grande (in quanto potrebbe mantenere allo stato solido l'acqua anche ad elevate temperature), ma neanche troppo piccola (in quanto tratterrebbe solamente una tenue atmosfera, causando eccessive escursioni termiche e favorendo l'accumulo di acqua solamente nelle regioni polari). La presenza poi di vapore acqueo e diossido di carbonio nell'atmosfera causa un effetto serra che consente di mantenere stabile la temperatura superficiale.[73]
È stato suggerito che le stesse forme di vita[74] possano contribuire a mantenere le condizioni favorevoli alla propria esistenza. La temperatura superficiale sulla Terra è stata relativamente costante nel susseguirsi delle ere geologiche, nonostante le variazioni, anche forti, dell'insolazione media superficiale, e questo indicherebbe che una serie di processi dinamici regolerebbero la temperatura del pianeta tramite una combinazione di gas serra e dell'albedo superficiale o atmosferico. Tale teoria prende il nome di Ipotesi Gaia.[75]
Diverse sono le teorie in merito all'origine dell'acqua sulla Terra. Le due ipotesi più accreditate ritengono che l'acqua o sia giunta sulla Terra a seguito degli impatti con le comete e asteroidi, molto frequenti agli albori del sistema solare, oppure a seguito della grande attività vulcanica della Terra primordiale, che avrebbe rilasciato nell'atmosfera grandi quantità di vapore acqueo che poi sarebbe precipitato al suolo sotto forma di fenomeni idrometeorici.[76][77]
L'acqua sulla Terra
Caratterizzazione chimico-fisica delle acque naturali


L'acqua in natura non è mai pura, bensì contiene al suo interno molte sostanze disciolte (grazie alla sua capacità di solvente), e particelle in sospensione, la maggior parte delle quali microscopiche; le sostanze contenute sostanzialmente si suddividono in base alla loro dimensione:[78]
- Materiali sospesi: > 0,1 μm
- argilla, silice, calcare, idrossido ferrico, alghe, grassi, microrganismi, detriti vegetali
- Materiali dispersi (colloidali): 0,1 ÷ 0,001 µm (0,1 µm ÷ 1 nm)
- Sostanze disciolte: < 10 Å (< 1 nm):
Grazie alle tecniche della chimica analitica è possibile individuare le sostanze presenti nell'acqua.[79] La caratterizzazione chimico-fisica di un'acqua naturale consiste generalmente nella seguente procedura:[80]
- prelevamento (in genere si prelevano 2 campioni rappresentativi);[81]
- osservazione: sensazioni organolettiche primarie;
- misura del pH;[82]
- calcolo della torbidità: metodo fotometrico;[83][84]
- calcolo del residuo fisso: misurazione del peso a diverse temperature;[85][86][87]
- determinazione della conducibilità elettrica;[87]
- determinazione anioni e cationi (tra i quali ioni Ca2+, Mg2+ e HCO3-)[88] e calcolo della durezza: metodi complessometrici[89][90] e/o altro;[91]
- determinazione del TOC: concentrazione del carbonio organico totale.[92]
- determinazione dei composti azotati: concentrazione di ammoniaca, nitriti, nitrati.
Caratterizzazione microbiologica delle acque naturali

Tutte le acque naturali contengono un certo numero di microrganismi, sia autotrofi sia eterotrofi, rappresentati da batteri, alghe, funghi e protozoi, che costituiscono la microflora autoctona delle acque, dove svolgono una funzione fondamentale in tutti i cicli biogeochimici e sono i principali responsabili dei fenomeni di autodepurazione. Anche le acque sotterranee ospitano una microflora specifica, rappresentata soprattutto da organismi oligotrofi, a causa della bassa concentrazione di nutrienti.
L'inquinamento di origine antropica, soprattutto quello derivante dallo scarico nelle acque naturali di reflui organici di origine civile, può introdurre nei corpi idrici microrganismi non tipici dell'ecosistema acquatico, che costituiscono una microflora d'inquinamento. Tra questi vi possono essere anche batteri patogeni dei generi Salmonella, Shigella, Vibrio, Clostridium, Pseudomonas, Campylobacter, Mycobacterium, Legionella, ecc., oltre a protozoi, elminti e virus di origine enterica. La presenza di questi patogeni può essere pericolosa soprattutto per quelle acque che sono utilizzate dall'uomo per scopi potabili o ricreativi.[93]
L'analisi microbiologica di un'acqua, tuttavia, più che alla ricerca dei patogeni, tende a rilevare microrganismi che sono definiti "indicatori d'inquinamento fecale", che albergano nell'intestino umano e di animali e vengono quindi eliminati con le feci. Questi indicatori hanno la caratteristica di avere concentrazioni, nei reflui organici, notevolmente superiori a quelle di eventuali patogeni e, inoltre, richiedono tecniche di rilevamento molto più semplici, per cui si possono facilmente inserire nei protocolli analitici di routine per la caratterizzazione microbiologica delle acque.[94]
I principali organismi indicatori ricercati nelle acque sono:
- Coliformi a 37 °C;
- Escherichia coli;
- Enterococchi;
- Clostridium perfringens.
Nelle acque destinate al consumo umano, si esegue anche il conteggio delle colonie a 22 °C.
Nelle acque potabili i microrganismi indicatori di inquinamento fecale (Escherichia coli e enterococchi) devono essere costantemente assenti e la carica microbica totale deve essere contenuta e costante. La presenza nell'acqua di uno o più di questi indicatori rappresenta un primo segnale di allarme per una probabile contaminazione fecale e può indirizzare verso la ricerca di eventuali patogeni.
Classificazione delle acque naturali

A seconda della loro provenienza, le acque naturali si classificano in:[95]
- acque meteoriche (pioggia, neve, grandine, rugiada, brina);
- acque sotterranee (falde profonde o freatiche);
- acque superficiali (mari, fiumi, laghi, sorgenti).
L'acqua compie un ciclo continuo (il cosiddetto ciclo dell'acqua o ciclo idrologico), consistente nel continuo scambio di acqua nell'idrosfera tra l'atmosfera, il suolo, le acque di superficie, le acque profonde e gli esseri viventi. Grazie all'evaporazione delle acque superficiali per effetto dell'irraggiamento solare ed alla traspirazione delle piante, si formano le nubi negli strati più freddi dell'atmosfera. Queste vengono trasportate dai venti ed al variare di temperatura e/o pressione, ritornano al suolo sotto forma di acque meteoriche, arricchendo ulteriormente le acque superficiali ed in parte (filtrando nel terreno) quelle sotterranee.
Poiché moltissime sostanze hanno una certa solubilità in acqua, in natura praticamente non esistono acque pure.
Le acque meteoriche contengono gas normalmente presenti nell'atmosfera (principalmente N2, O2 e CO2), quelli localmente presenti per via di attività industriali o di centri abitati (SO2, SO3, ossidi di azoto, CO) e quelli che provengono dalla decomposizione di sostanze organiche naturali (H2S, NH3). L'acqua meteorica può reagire con tali sostanze. Un esempio è dato dal fenomeno della pioggia acida:

Le acque sotterranee, alimentate dall'infiltrazione delle acque meteoriche, da cui il terreno filtra le sostanze in sospensione, sono acque minerali. A volte le acque sotterranee fuoriescono spontaneamente diventando acque sorgive (notevolmente pregiate per l'uso potabile per la mancanza di organismi patogeni, ma spesso la qualità viene minacciata da erbicidi e pesticidi, che sono estremamente dannosi per la salute).
Le acque sotterranee, ossidando le sostanze organiche presenti nel suolo, si arricchiscono di anidride carbonica, facilitando la dissoluzione di rocce calcaree secondo la reazione:
- CaCO3 [insolubile] + CO2 + H2O ⇌ Ca(HCO3)2 [solubile]
- MgCO3 [insolubile] + CO2 + H2O ⇌ Mg(HCO3)2 [solubile]
Se la concentrazione del diossido di carbonio è elevata, la quantità di roccia dissolta è elevata e si possono formare delle grotte; tale fenomeno in Italia è chiamato carsismo (dalla regione del Carso, dove questo fenomeno è frequente). La reazione chimica anzidetta può avvenire in entrambe le direzioni (da sinistra verso destra o da destra verso sinistra): dalla reazione inversa alla precedente, con l'eliminazione dell'anidride carbonica, si ha quindi la formazione di stalattiti e stalagmiti.
Le acque superficiali hanno composizione estremamente variabile a seconda delle condizioni climatiche ed ambientali.[96] Si possono classificare in acque dolci (3%, per circa i 3⁄4 allo stato liquido) e salate. Il mar Mediterraneo contiene circa il 3,5% di sali (77,7% cloruro di sodio, 11% cloruro di magnesio ed il restante diviso tra solfati di magnesio, calcio, potassio, carbonato di calcio e bromuro di magnesio).
Risorse idriche terrestri



Il volume di acqua presente sulla Terra è stimato in 1 360 000 000 km3, all'incirca un millesimo del volume complessivo del pianeta; di questi:[97]
- 1 320 000 000 km3 (pari a circa il 97,3% del totale) sono acque marine (in maggioranza oceano).
- 25 000 000 km3 (pari a circa il 2% del totale) sono nei ghiacciai e nelle calotte polari.
- 13 000 000 km3 (pari a circa l'1% del totale) sono nel suolo, nelle falde acquifere.
- 250 000 km3 (pari a circa lo 0,02% del totale) sono acque dolci nei laghi, nei mari interni[98] e nei fiumi.
- 13 000 km3 sono vapore acqueo nell'atmosfera.
L'acqua dolce rappresenta solo il 2,5% del volume totale presente sulla Terra[99] e per più dei 2⁄3 si trova in pochi ghiacciai, in particolare nell'Antartide e in Groenlandia, i quali sono quindi la principale riserva di acqua dolce nel nostro pianeta.[100]
La fusione dei ghiacciai a causa dell'effetto serra e dell'aumento delle temperature ha un forte impatto ambientale, sia per l'innalzamento del livello dei mari ma anche per la scomparsa di questa riserva. Durante la fusione dei ghiacci, infatti, l'acqua dolce si mescola a quella salata del mare, divenendo inutilizzabile dall'uomo.
Un ulteriore 30% di acqua dolce si trova in riserve sotterranee e solo meno dell'1% dell'acqua dolce si trova in laghi, fiumi o bacini ed è quindi facilmente accessibile.[101] In uno studio pubblicato nel 1996 dalla rivista Science[102] si stimava che:
- il ciclo dell'acqua genera un totale di acqua dolce rinnovabile pari a circa 110 300 km3/anno;
- circa 69 600 km3/anno delle precipitazioni evapora a sua volta (ma consente la vita di forme importanti di vegetazione, quali le foreste, non irrigate dall'uomo);
- rimangono circa 40 700 km3/anno, che ritornano nei mari e negli oceani; di tale acqua:
- 7 774 km3/anno sono in zone di difficile accesso e, in pratica, non utilizzate (circa il 95% del Rio delle Amazzoni, metà del Congo, buona parte dei fiumi nelle terre più settentrionali);
- 29 600 km3/anno finiscono in mare senza essere utilizzati mediante dighe;
- 12 500 km3/anno possono essere utilizzati dall'uomo; di questi:
- 4 430 km3/anno vengono direttamente utilizzati nell'agricoltura (2880 km3/anno), nell'industria (975 km3/anno) e nelle città (300 km3/anno); il dato comprende, peraltro, anche la perdita di riserve per evaporazione (275);
- 2 350 km3/anno vengono utilizzati "così come sono", ad esempio per navigazione, pesca e parchi;
- la costruzione di dighe può aumentare di circa il 10% la disponibilità di acqua dolce utilizzabile dall'uomo nel 2025, ma si prevede che per quel tempo la popolazione potrebbe aumentare di circa il 45%;
- l'aumento stimato dell'acqua disponibile può inoltre risultare ottimistico, a causa del crescente inquinamento e del riscaldamento globale.
L'acqua in meteorologia
L'acqua è anche un elemento fondamentale di controllo della meteorologia e del clima terrestre. Il vapore acqueo presente nell'atmosfera può, sotto determinate circostanze, subire dei processi di accrescimento (coalescenza) portando alla formazione di nuvole, e, raggiungendo la saturazione, alla pioggia o ad altre forme di precipitazioni atmosferiche. Grazie a questi eventi l'acqua può ridistribuirsi sul territorio, venendo anche accumulata nei ghiacciai polari o in quelli presenti ad elevate altitudini. L'abbondanza o meno di precipitazioni acquose nelle varie aree geografiche ne stabilisce il clima, da estremi di aridità fino alle foreste tropicali, e di conseguenza la biodiversità e le risorse.
L'acqua e l'uomo
Essendo l'acqua un bene irrinunciabile per la vita, la proprietà e la gestione dell'acqua, delle infrastrutture e dei servizi idrici è oggetto di questioni di diritto e di politica.
L'acqua nella storia della civiltà e nelle religioni

L'acqua ha svolto un ruolo fondamentale nello sviluppo delle prime civiltà antiche, che erano situate lungo i grandi fiumi dell'Oriente: il Nilo per la civiltà egizia,[103] il Tigri e l'Eufrate per le civiltà mesopotamiche (Sumeri,[104] Babilonesi e Assiri), lo Huang He (Fiume Giallo) per la Cina, l'Indo e il Gange per l'India.
I grandi bacini fluviali costituivano un'opportunità per la maggior fertilità del suolo e per la facilità dei trasporti, ma determinavano un'organizzazione sociale più complessa necessaria per gestire i conflitti per le risorse e per affrontare la costruzione e manutenzione di imponenti sistemi di irrigazione e di protezione dalle alluvioni.
Minore, ma tutt'altro che trascurabile, fu anche l'importanza dei mari interni, soprattutto il mar Mediterraneo, che facilitavano i commerci e i contatti culturali fra popoli lontani, con la formazione di civiltà prevalentemente dedicate al commercio (anzitutto i Fenici).[105]
L'importanza dell'acqua è riconosciuta nelle religioni e nei sistemi filosofici sin dai tempi antichi.[106] Molte religioni venerano dei legati all'acqua o i corsi d'acqua stessi (ad esempio, il Gange è una dea per l'induismo).[107] Ancora, semidivinità particolari, chiamate Ninfe, sono posti nella mitologia greca a guardia di particolari fonti d'acqua.[108] L'acqua, poi, fu considerata un elemento primigenio presso molti popoli, anche molto lontani fra loro; ad esempio in Cina venne identificata con il caos, da cui ha avuto origine l'universo, mentre nella Genesi compare già nel secondo versetto, prima della luce e delle terre emerse. Anche il filosofo greco Talete associò l'acqua all'origine di tutte le cose e asserì che la sua scorrevolezza è in grado di spiegare anche i mutamenti delle cose stesse.[109] Anche in Polinesia l'acqua venne considerata la materia prima fondamentale.

Con lo sviluppo dei primi sistemi filosofici, l'acqua venne affiancata da pochi altri elementi primigenii senza perdere la sua importanza. In tutte le civiltà antiche era molto diffusa la convinzione che la molteplicità della natura potesse essere ricondotta alla combinazione di pochissimi elementi costitutivi: l'acqua, appunto, il fuoco, la terra e l'aria (o il legno) ed eventualmente una quinta essenza. Così ad esempio in oriente il taoismo cinese include l'acqua fra i suoi cinque elementi con terra, fuoco, legno e metallo.[110] In Occidente anche Empedocle (492 a.C. circa – 430 a.C. circa) annoverò l'acqua fra i quattro elementi fondamentali, ai quali Platone nel Timeo aggiunse l'etere. Lo stesso Aristotele (384 a.C. - 322 a.C.) sosteneva che la materia fosse formata dall'interazione dei quattro elementi citati da Empedocle.

L'indispensabilità dell'acqua per il fiorire della vita colpì molte civiltà. Ad esempio, nella lingua sumera "a" significa sia "acqua" sia "generazione". Nella maggior parte delle religioni, quindi, l'acqua è diventata un simbolo di rinnovamento e perciò di benedizione divina.[111] Essa compare logicamente nei riti di "purificazione" e di rinascita di molti culti, ad esempio nei riti di immersione del battesimo cristiano e nelle abluzioni dell'ebraismo e dell'islam. Anche nello scintoismo l'acqua è usata nei rituali di purificazione di persone o luoghi.[112]
La tradizione sapienzale mistica ebraica della Cabala ebraica individua nell'acqua il simbolo della Sefirah Chessed indicante la qualità divina della Misericordia, della gentilezza e della grandezza; molti i riferimenti della Torah all'acqua, anche suo simbolo. Secondo l'esegesi ebraica lo stesso termine "Ebreo", in ebraico Yivrì, significa "colui che viene da oltre il fiume" ed è presente nella Bibbia ebraica, usato per la prima volta riguardo ad Abramo. Il termine ebraico che traduce la parola "acqua", maim, se associato al termine esh, "fuoco", forma la parola shamaim che significa "cielo": si ritiene infatti che i cieli presentino l'unione di acqua e fuoco.[senza fonte]
Mircea Eliade ha studiato analiticamente i miti acquatici nelle varie religioni: "Le acque simboleggiano la totalità delle virtualità". Eliade ha considerato:
- le Acque e i Germi;
- le cosmogonie acquatiche (in India, nell'Enûma Eliš della mitologia babilonese);
- le ilogenie (origine del genere umano o di una razza dalle acque);
- l'acqua della vita (l'acqua ringiovanisce e dà la vita eterna);
- il simbolismo dell'immersione;
- il battesimo;
- la sete del morto (l'evangelica Parabola di Lazzaro e il ricco Epulone, presso i Greci, in Mesopotamia, nell'antico Egitto);
- le fonti miracolose ed oracolari (già dal Neolitico, poi ad esempio la delfica Pizia);
- le epifanie acquatiche e le divinità delle acque;
- le ninfe;
- Poseidone ed Ægir;
- gli animali ed emblemi acquatici (dragoni, delfini, serpenti, conchiglie, pesci, ecc., che regolano la fecondità del mondo e hanno la forza sacra dell'abisso);
- il simbolismo del diluvio.[113]
L'attribuzione all'acqua di caratteristiche negative è molto più rara e recente. Nel XVI secolo, durante l'epidemia della peste, si pensò che l'acqua favorisse il contagio, "aprendo" i pori della pelle attraverso cui si sarebbero infiltrati i presunti agenti patogeni, chiamati seminaria, per cui si riteneva che il lavaggio del corpo indebolisse l'organismo, ed era pertanto sconsigliato.[114]
Usi dell'acqua

L'acqua riveste un ruolo centrale in una moltitudine di campi. Sostanzialmente si possono suddividere gli usi dell'acqua in:
- Usi civili:
- Uso potabile
- Alimentazione (preparazione alimenti e bevande)
- Igiene (personale e degli impianti sanitari)
- Imprese alimentari
- Usi civili non potabili (per molti dei quali, comunque, si usa di norma acqua potabile), fra cui:
- Spegnimento degli incendi
- Giardinaggio
- Usi ricreativi (sport acquatici)
- Abluzione e riti religiosi
- Uso potabile
- Usi agricoli (irrigazione)
- Utilizzi industriali, fra cui:[115]
- Fonte energetica in impianti idroelettrici
- Applicazioni chimiche (come solvente e agente di reazione)
- Vettore termico in impianti di riscaldamento e raffreddamento.
- Taglio ad acqua nel quale si utilizza un getto potente d'acqua per tagliare con alta precisione superfici più o meno spesse di vari materiali
Sebbene l'acqua ricopra il 70.8% della superficie terrestre, la maggior parte di questa non è utilizzabile direttamente, in quanto necessita di particolari trattamenti, che sono diversificati a seconda dell'utilizzo a cui l'acqua è destinata.
Acqua leggera e acqua pesante
Nell'ingegneria nucleare l'acqua comune viene detta acqua leggera quando viene impiegata come refrigerante/moderatore del nocciolo di un LWR, sia in condizioni sottoraffreddate (reattori PWR) sia in condizioni di ebollizione (reattori BWR). L'origine di questo termine deriva dalla contrapposizione con il termine acqua pesante, che identifica una sostanza chimicamente simile all'acqua ma in cui l'isotopo più comune dell'idrogeno di peso 1 è sostituito con l'isotopo deuterio di peso 2; l'acqua pesante è impiegata come moderatore/refrigerante nei reattori CANDU.
Trattamenti delle acque

L'acqua può subire diversi trattamenti per la rimozione di inquinanti e per la correzione di alcune caratteristiche chimico-fisiche; la progettazione di impianti di trattamento richiede delle analisi preliminari dell'acqua grezza che possano esprimere con chiarezza tutte le sostanze in essa contenute (le cui concentrazioni sono solitamente espresse con unità di misura in ppm o ppb) e determinare le sue caratteristiche microbiologiche.
I trattamenti che vengono effettuati sull'acqua dipendono soprattutto dalla loro destinazione, ad esempio l'acqua potabile deve avere un certo contenuto di concentrazione salina, un valore di pH contenuto in un intervallo specifico, una conducibilità elettrica limite, assenza di microrganismi indicatori di inquinamento e di patogeni, mentre un tipo di acqua ad uso agricolo sarà più ricca di minerali.
Il trattamento delle acque reflue prevede una serie di operazioni di tipo chimico-fisico e biologico, suddivise in trattamento primario,[116] trattamento secondario e trattamento terziario, oltre ad una serie di operazioni specifiche per il trattamento dei fanghi.[117][118] I reflui depurati sono generalmente riversati in acque superficiali e in Italia devono rispettare i valori limiti di emissione stabiliti dal decreto legislativo n.152/2006,[119] in relazione agli obiettivi di qualità dei corpi idrici riceventi. Lo scarico di un depuratore, infatti, non deve contenere sostanze inquinanti in concentrazioni tali da interferire con la naturale capacità autodepurativa del corpo idrico[120] né compromettere la vitalità e la biodiversità delle comunità biotiche degli ecosistemi acquatici. I reflui depurati, dopo aver subito un idoneo trattamento terziario, comprensivo di filtrazione su sabbia, adsorbimento su carboni attivi, disinfezione con raggi ultravioletti, biossido di cloro, o altri ossidanti, possono essere riutilizzati soprattutto per un uso irriguo o industriale.
Il trattamento per le acque marine consiste principalmente nell'operazione di dissalazione.[121]

I trattamenti per la potabilizzazione si applicano ad acque superficiali naturali, o provenienti da invasi artificiali, con lo scopo di ottenere acque idonee all'uso umano, che rispettino le norme di qualità stabilite in Italia dal decreto legislativo n.31/2001;[122] questi trattamenti comprendono le operazioni di:[123]
- Sedimentazione
- Coagulazione
- Filtrazione
- Aerazione
- Trattamento biologico a fanghi attivi
- Filtrazione con carbone attivo
- Purificazione ad osmosi inversa
- Addolcimento
- Disinfezione
Naturalmente non tutte le operazioni elencate sono applicate contemporaneamente, ma queste potranno essere assemblate in schemi diversi, secondo il grado d'inquinamento dell'acqua grezza. Ad esempio, un'acqua poco inquinata potrà subire un trattamento più semplice, consistente in una filtrazione su sabbia seguita da disinfezione. Un'acqua dolce superficiale mediamente inquinata, invece, subirà un trattamento più spinto che, secondo uno schema classico, potrà seguire la successione delle seguenti operazioni: sedimentazione, preossidazione con biossido di cloro, ipoclorito di sodio o altri ossidanti, coagulazione-flocculazione-sedimentazione, filtrazione su sabbia, adsorbimento su carboni attivi e disinfezione finale.
L'acqua nell'industria

L'acqua è solo seconda come capacità termica molare specifica rispetto a qualsiasi sostanza nota, subito dopo l'ammoniaca. Per questa sua caratteristica, viene molto usata come mezzo di trasporto ed accumulo del calore. L'acqua è usata in numerosi processi ed apparecchiature industriali, quali ad esempio il motore a vapore, i generatori di vapore, gli scambiatori di calore ed i radiatori, nonché nei processi dell'industria chimica. Infatti, grazie alle sue proprietà chimiche, l'acqua costituisce l'ambiente di reazione e dissoluzione di molte sostanze, e, per le sue caratteristiche termiche, è un ottimo fluido trasportatore di calore. Inoltre l'acqua viene impiegata per la produzione di energia nelle centrali idroelettriche. Il vapore acqueo è utilizzato per alcuni processi nell'industria chimica. Un esempio è la produzione di acido acrilico[124][125]. Il possibile effetto dell'acqua in queste reazioni include l'interazione fisico-chimica dell'acqua con il catalizzatore e la reazione chimica dell'acqua con gli intermedi di reazione.
Il fabbisogno d'acqua dell'industria viene soddisfatto con prelievi di acque di origine superficiale (dal ridotto contenuto salino ed un basso tenore in ossigeno a causa dell'inquinamento), profonda (maggiori contenuti di anidride carbonica), o molto più raramente di origine atmosferica (in genere corrosive a causa dei gas disciolti); solo in particolari casi si ricorre all'acqua di mare.
Si effettuano perciò trattamenti di natura meccanica, fisica o chimica, in relazione allo stato ed alle dimensioni dei contaminanti, per rendere l'acqua utilizzabile nei processi industriali[126].
I trattamenti per le acque industriali sono molteplici, e comprendono le operazioni di:[127]

- Flocculazione e coagulazione[128]
- Neutralizzazione, precipitazione[129]
- Trattamenti di ossido-riduzione[130]
- Disinfezione
- Addolcimento[131]
- Decarbonatazione
- Desilicazione[132]
- Demineralizzazione[133]
- Deferrizzazione e demanganizzazione[134]
- Trattamenti anticorrosione (ad esempio eliminazione dei gas disciolti)
- Sedimentazione (sfrutta la legge di Stokes)[135]
- Flottazione
- Filtrazione[136]
Una forma di inquinamento è rappresentata dallo scarico nell'ambiente di acque residue di processi industriali non opportunamente trattate (inquinamento chimico) o di acque di raffreddamento (inquinamento termico).[137]
Immagini 3D della molecola
Note
- ^ Il nome sistematico IUPAC dell'acqua dovrebbe essere "monossido di diidrogeno", o anche "idrossido di idrogeno" o "acido ossidrilico", se si vuole enfatizzare il comportamento basico o acido. Tali nomi però non sono mai entrati in uso, se non in parodie del linguaggio dei chimici o in scherzi; si veda ad esempio la beffa del monossido di diidrogeno. La stessa IUPAC raccomanda l'uso dei nomi "water", "acqua", e "oxidane" ( G. J. et al. Leigh, Principles of chemical nomenclature: a guide to IUPAC recommendations (PDF), Blackwell Science Ltd, UK, 1998, p. 34, ISBN 0-86542-685-6.).
- ^ a b Nel caso di grandi masse d'acqua, quali ad esempio laghi e mari, l'acqua assume colore blu per la lunghezza d'onda più ampia dei raggi luminosi che filtrano a grandi profondità (analogamente a come avviene nell'atmosfera all'alba o al tramonto quando l'umidità filtra invece raggi luminosi di più bassa lunghezza d'onda).
- ^ a b c (EN) National Institute of Standards and Technology, "Isothermal Properties for Water", su webbook.nist.gov.
- ^ a b Fabbri.
- ^ Mazza.
- ^ Tabella viscosità cinematica di alcuni fluidi a diverse temperature, su engineerplant.it.
- ^ A. Pavan, R. Frassine, 4.1 Progettazione idraulica, in Tubazioni in polietilene per il trasporto di acqua, Milano, Springer, 2005, p. 27, 88-470-0268-0.
- ^ Sigma Aldrich; rev. del 03.07.2012
- ^ "Condizioni normali" (o "c.n.") significa le condizioni standard di temperatura e pressione rispettivamente di 20 °C e 1 atm.
- ^ In generale si parla di "temperatura di congelamento" e non di "0 °C". Infatti il valore della temperatura di congelamento dipende dalla pressione, ed è pari a 0 °C solo a pressione atmosferica.
- ^ Celsius.
- ^ Nicholson.
- ^ (EN) Gilbert N. Lewis, The isotope of hydrogen, in Journal of the American Chemical Society, vol. 55, n. 3, marzo 1933, pp. 1297-1298, DOI:10.1021/ja01330a511. URL consultato il 14 agosto 2009.
- ^ (EN) Denis Rousseau, Case Studies in Pathological Science, in American Scientist, vol. 80, n. 1, gennaio 1992, pp. 54-63. URL consultato il 14 agosto 2009.
- ^ (EN) Henry H. Bauer, "Pathological Science" is not Scientific Misconduct (nor is it pathological), in International Journal for Philosophy of Chemistry, vol. 8, n. 1, 2002, pp. 5-20. URL consultato il 14 agosto 2009.
- ^ (EN) Felix Franks, David Eisenberg, A Scientific Gold Rush. (Book Reviews: Polywater), in Science, vol. 213, n. 4512, settembre 1981, pp. 1104-1105. URL consultato il 14 agosto 2009.
- ^ I segreti dell'acqua, in Le Scienze, 6 marzo 2007. URL consultato il 14 agosto 2009.
- ^ (EN) Martin Chaplin, Explanation of the Phase Anomalies of Water (P1-P13). P4, su Water Structure and Science, 19 dicembre 2016. URL consultato il 17 marzo 2017 (archiviato dall'url originale il 20 marzo 2017).
- ^ (EN) C. Lobban, J.L. Finney, W.F. Kuhs, The structure of a new phase of ice, in Nature, vol. 390, 15 gennaio 1998, pp. 268-270, DOI:10.1038/34622. URL consultato il 14 agosto 2009.
- ^ (EN) Martin Chaplin, Ice-five and ice-thirteen structures, su Water Structure and Science, 11 novembre 2007. URL consultato il 14 agosto 2009.
- ^ Holleman.
- ^ Esistono due tipi di acqua allo stato liquido, in wired.it, 15 novembre 2016. URL consultato il 29 dicembre 2016.
- ^ I punti di fusione ed ebollizione riportati sono riferiti alla pressione di 1 atm.
- ^ a b c Né solida né liquida: ecco l'acqua superionica, in lescienze.it, 28 gennaio 2018. URL consultato il 28 gennaio 2018.
- ^ a b Wolke, pp. 141-143.
- ^ Collepardi.
- ^ Lo stato liquido (PDF), su chimica.unipd.it. URL consultato il 14 agosto 2009 (archiviato dall'url originale il 9 maggio 2013).
- ^ Calcolo della densità del ghiaccio, su scuolainrete.com. URL consultato il 26-08-2009 (archiviato dall'url originale l'8 giugno 2008).
- ^ Calore e temperatura, su nivoland.net. URL consultato il 26-08-2009 (archiviato dall'url originale il 3 dicembre 2008).
- ^ Menisco e tensione superficiale, su ettoreconti.mi.it. URL consultato il 26-08-2009 (archiviato dall'url originale il 23 gennaio 2010).
- ^ Liquidi... Tensione di vapore e tensione superficiale (PDF), su sciformprim.campusnet.unito.it. URL consultato il 26-08-2009.
- ^ Acqua - Conoscere l'acqua - Le proprietà fisiche, su eniscuola.net (archiviato dall'url originale il 18 gennaio 2013).
- ^ La demineralizzazione dell'acqua (PDF), su nobelitaly.it. URL consultato il 26-08-2009.
- ^ L'acqua ed il pH, su gaem.it. URL consultato il 26-08-2009.
- ^ (EN) Water properties: pH, su ga.water.usgs.gov. URL consultato il 26 agosto 2009.
- ^ Ecologia.
- ^ Ministero dell'ambiente e della tutela del territorio e del mare, su minambiente.it. URL consultato il 26 agosto 2009.
- ^ Introduzione alla Simulazione quanto-meccanica di materiali - Dalle molecole ai cristalli (PDF), su theochem.unito.it. URL consultato il 26-08-2009 (archiviato dall'url originale il 25 novembre 2012).
- ^ G.Valitutti, M. Falasca, A. Tifi, A. Gentile., chimica concetti e modelli, Zanichelli, 2012.
- ^ Cabras, p. 140.
- ^ a b c Theory and molecular models for water (PDF), su princeton.edu.
- ^ Si pensi per confronto che la pressione esercitata da un pattinatore abbassa il punto di fusione del ghiaccio su cui si trova di circa 0,09 °C.
- ^ (EN) Philippa M. Wiggins, High and low-density water in gels, in Progress in Polymer Science, vol. 20, n. 6, 1995, pp. 1121-1163, DOI:10.1016/0079-6700(95)00015-8.
- ^ (EN) S. M. Pershin, OH-Group vibration spectrum of metastable hydrogen-bound states of liquid water, in Physics of Wave Phenomena, vol. 11, n. 2, 2003, pp. 89-95. ISSN 1541-308X.
- ^ Vybíral.
- ^ (EN) M. L. Cowan, B. D. Bruner, N. Huse, J. R. Dwyer, B. Chugh, E. T. J. Nibbering, T. Elsaesser, R. J. D. Miller, Ultrafast memory loss and energy redistribution in the hydrogen bond network of liquid H2O, in Nature, vol. 434, n. 7030, 2005, pp. 199-202, DOI:10.1038/nature03383.
- ^ (EN) Renato Torre, Bartolini Paolo, Righini Roberto, Structural relaxation in supercooled water by time-resolved spectroscopy, in Nature, vol. 428, n. 6980, 2004, pp. 296-299. ISSN 0028-0836.
- ^ Fermi restando i dubbi precedentemente espressi su quali siano i reali tempi di correlazione dell'acqua e sul fatto che esista un solo tempo di correlazione o ne coesistano diversi.
- ^ a b Polizzotti, p. 8.
- ^ Cabras, p. 142.
- ^ Lausarot.
- ^ Brandi.
- ^ A. Post Baracchi, A.Tagliabue, Chimica, progetto modulare, ed. Lattes, ISBN 978-88-8042-414-7, p.383
- ^ Il corpo umano e l'acqua, su medicinaecologica.it. URL consultato il 26 agosto 2009.
- ^ Funzione biologica dell'acqua (PDF), su chimica-cannizzaro.it. URL consultato il 26-08-2009 (archiviato dall'url originale il 22 dicembre 2011).
- ^ Il ruolo dell'acqua nell'organismo, su doctor33.it. URL consultato il 26-08-2009 (archiviato dall'url originale il 3 aprile 2007).
- ^ I macronutrienti - L'acqua, il nutriente più importante, su guide.supereva.it. URL consultato il 26-08-2009.
- ^ Composizione chimica del corpo umano (PDF), su itaseinaudi.it. URL consultato il 21 ottobre 2012 (archiviato dall'url originale il 24 luglio 2015).
- ^ Acqua corporea e bilancio idrico, su my-personaltrainer.it.
- ^ (EN) Gary Melnick (Harvard-Smithsonian Center for Astrophysics), David Neufeld (Johns Hopkins University), Water, water everywhere: radio telescope finds water is common in universe, The Harvard University Gazette, 15 febbraio 1999.
- ^ (EN) Gary Melnick (Harvard-Smithsonian Center for Astrophysics), David Neufeld (Johns Hopkins University), Space cloud holds enough water to fill Earth's oceans 1 million times, Headlines@Hopkins, JHU, 8 aprile 1998.
- ^ (EN) Gary Melnick (Harvard-Smithsonian Center for Astrophysics), David Neufeld (Johns Hopkins University), Discover of water vapor near Orion Nebula suggests possible origin of H20 in Solar System, The Harvard University Gazette, 13 aprile 1998. URL consultato il 3 gennaio 2009 (archiviato dall'url originale il 16 gennaio 2000).
- ^ Lada.
- ^ (DE) Versteckt in Glasperlen: Auf dem Mond gibt es Wasser - Wissenschaft - SPIEGEL ONLINE - Nachrichten, su spiegel.de. URL consultato il 26 agosto 2009.
- ^ (EN) Messenger Scientists "astonished" to find water in Mercury's thin atmosphere, su planetary.org, Planetary Society. URL consultato il 5 luglio 2008.
- ^ (EN) Laura Blue, Water found on distant planet, in TIME, 12 luglio 2007. URL consultato il 26 agosto 2009 (archiviato dall'url originale il 16 luglio 2007).
- ^ (EN) Water found in extrasolar planet's atmosphere, su space.com. URL consultato il 26 agosto 2009.
- ^ (EN) J. C. I. Dooge, Integrated management of water resources, in E. Ehlers, T. Krafft. Understanding the Earth System: compartments, processes, and interactions, Springer, 2001, p. 116.
- ^ a b Dick.
- ^ (EN) S. A Naftilan, P. B. Stetson, How do scientists determine the ages of stars? Is the technique really accurate enough to use it to verify the age of the universe?, su sciam.com, Scientific American, 13 luglio 2006. URL consultato il 27 febbraio 2009 (archiviato dall'url originale il 5 dicembre 2008).
- ^ (EN) G. Laughlin, P. Bodenheimer, F. C. Adams, The end of the main sequence, in The Astrophysical Journal, vol. 482, 1997, pp. 420-432. URL consultato il 14 agosto 2009.
- ^ (EN) A. Burrows, W. B. Hubbard, D. Saumon, J. I. Lunine, An expanded set of brown dwarf and very low mass star models, in Astrophysical Journal, vol. 406, n. 1, 1993, pp. 158-171, DOI:10.1086/172427.
- ^ Doyle.
- ^ Intendendo con il termine "forme di vita" non solo le singole specie, ma l'insieme di tutte le forme di vita.
- ^ Lovelock.
- ^ (EN) J. Horgan, In the beginning, in Scientific American, vol. 264, 1991, pp. 100-109.
- ^ Gonzalez.
- ^ Polizzotti, pp. 29-30.
- ^ Metodi analitici per le acque - Solidi (PDF), su apat.gov.it. URL consultato il 26-08-2009 (archiviato dall'url originale il 18 gennaio 2012).
- ^ Nollet.
- ^ Polizzotti, pp. 30-31.
- ^ Polizzotti, p. 31.
- ^ Turbidimetria e nefelometria (PDF), su digilander.libero.it. URL consultato il 26-08-2009.
- ^ Polizzotti, pp. 31-32.
- ^ www.anagen.net - Acqua minerale, su anagen.net. URL consultato il 26-08-2009.
- ^ Residuo fisso a 180 °C (PDF) [collegamento interrotto], su sobrero.it. URL consultato il 26-08-2009.
- ^ a b Polizzotti, p. 32.
- ^ Polizzotti, pp. 34-39.
- ^ Determinazione complessometrica della durezza (PDF), su unibas.it. URL consultato il 26-08-2009 (archiviato dall'url originale il 1º aprile 2010).
- ^ Titolazioni complessometriche (PDF), su dicasm.ing.unibo.it. URL consultato il 26-08-2009 (archiviato dall'url originale il 12 giugno 2009).
- ^ Polizzotti, pp. 41-45.
- ^ Metodi analitici ufficiali per le acque destinate al consumo umano ai sensi del D.Lgs. 31/2001 (PDF), su iss.it. URL consultato il 26-08-2009.
- ^ Istituto Superiore di Sanità, Microbiologia delle acque di diversa derivazione (PDF), in Rapporti Istisan 04/14, 2004.
- ^ Istituto Superiore di Sanità, Metodi analitici di riferimento per le acque destinate al consumo umano ai sensi del DL.vo 31/2001.Metodi microbiologici (PDF), in Rapporti Istisan 07/5, 2007.
- ^ Classificazione delle acque (PDF), su chimica-cannizzaro.it. URL consultato il 26-08-2009 (archiviato dall'url originale il 22 dicembre 2011).
- ^ Polizzotti, p. 28.
- ^ (EN) Earth's water distribution, su ga.water.usgs.gov. URL consultato il 28-08-2009.
- ^ Un esempio di "mare interno" è il Mar Caspio.
- ^ Cicerchia.
- ^ Di Donna.
- ^ (EN) Summary of the monograph "World Water Resources at the Beginning of the 21st Century" prepared in the framework of IHP UNESCO, cap. 2, "Water storage on the Earth and hydrological cycle", su webworld.unesco.org. URL consultato il 26 agosto 2009 (archiviato dall'url originale il 19 febbraio 2009).
- ^ (EN) Sandra L. Postel, Gretchen C. Daily, Paul R. Ehrlich, Human appropriation of renewable fresh water (PDF), in Science, vol. 271, n. 5250, 9 febbraio 1996, pp. 785-788, DOI:10.1126/science.271.5250.785.
- ^ Amenta.
- ^ Altamore.
- ^ Montevecchi.
- ^ Hidiroglou.
- ^ Herbert.
- ^ Becatti.
- ^ Mondin.
- ^ Abdallah.
- ^ cfr. ad esempio Is. 35, 6 e Ez. 47, 1-12.
- ^ Ono.
- ^ Trattato di storia delle religioni, ed. Universale Bollati Boringhieri, Torino, 2009, capitolo 5.
- ^ Acqua e peste, su leonardodavinci.csa.fi.it. URL consultato il 23-12-2008 (archiviato dall'url originale il 12 gennaio 2009).
- ^ Polizzotti, p. 53.
- ^ Trattamenti delle acque primarie (PDF), su corsiadistanza.polito.it. URL consultato il 26-08-2009.
- ^ Trattamento fanghi (PDF), su corsiadistanza.polito.it. URL consultato il 26-08-2009.
- ^ Impianti di trattamento delle acque (PDF), su corsiadistanza.polito.it. URL consultato il 26-08-2009.
- ^ Decreto Legislativo 3 aprile 2006, n. 152, "Norme in materia ambientale", su camera.it. URL consultato il 26-08-2009.
- ^ Inquinamento delle acque, su galileimirandola.it. URL consultato il 26-08-2009.
- ^ Processi di desalinizzazione dell'acqua di mare e loro prospettive (PDF), su diia.unina.it. URL consultato il 26-08-2009.
- ^ Attuazione della direttiva 98/83/CE relativa alla qualità delle acque destinate al consumo umano, su parlamento.it.
- ^ Potabilizzazione delle acque.
- ^ The reaction network in propane oxidation over phase-pure MoVTeNb M1 oxide catalysts (PDF), in Journal of Catalysis, vol. 311, pp. 369-385. URL consultato il 28 gennaio 2018 (archiviato dall'url originale il 15 febbraio 2016).
- ^ Surface chemistry of phase-pure M1 MoVTeNb oxide during operation in selective oxidation of propane to acrylic acid (PDF), in Journal of Catalysis, vol. 285, pp. 48-60. URL consultato il 28 gennaio 2018 (archiviato dall'url originale il 30 ottobre 2016).
- ^ Kinetic studies of propane oxidation on Mo and V based mixed oxide catalysts (PDF), 2011.
- ^ Bianucci.
- ^ Polizzotti, pp. 59-64.
- ^ Polizzotti, p. 202.
- ^ Polizzotti, pp. 113-120.
- ^ Polizzotti, pp. 78-96.
- ^ Polizzotti, pp. 111-112.
- ^ Polizzotti, pp. 97-110.
- ^ Polizzotti, pp. 75-77.
- ^ Polizzotti, pp. 56-59.
- ^ Polizzotti, pp. 65-68.
- ^ Chiesa.
Bibliografia
- Albert Abou Abdallah, Roberto Sorgo, Religioni ieri e oggi: storia, idee, società, FrancoAngeli, 2001, pp. 77-78, ISBN 88-464-3115-4.
- Giuseppe Altamore, L'acqua nella storia. Dai Sumeri alla battaglia per l'oro blu, Sugarco Edizioni, 2008, ISBN 88-7198-547-8.
- Alessia Amenta, Maria Michela Luiselli, Maria Novella Sordi, L'acqua nell'antico Egitto. Vita, rigenerazione, incantesimo, medicamento, L'Erma di Bretschneider, 2005, ISBN 88-8265-207-6.
- Giuseppe Banchi, C. Gallini, C.G. Rizzieri, 1, in Materiali da costruzione, Firenze, Le Monnier, 1995, ISBN 88-00-49229-0.
- Giovanni Becatti, G. Tarozzi, Ninfe e divinità marine: ricerche mitologiche iconografiche e stilistiche, De Luca, 1971. ISBN non esistente
- Giovanni Bianucci, Il trattamento delle acque residue industriali e agricole, 3ª ed., Hoepli, 1996, ISBN 88-203-1961-6.
- Giovanni Bianucci, Esther Ribaldoni Bianucci, L'analisi chimica delle acque naturali e inquinate, Hoepli, 1993, ISBN 88-203-1987-X.
- Primo Brandi, Anna Salvadori, Modelli matematici elementari, Pearson Paravia Bruno Mondadori, 2004, p. 156, ISBN 88-424-9016-4.
- Gianluca Buganè, Ufficio marketing & comunicazione: principi, attività e casi di marketing strategico e operativo, Hoepli, 2006, ISBN 88-203-3621-9.
- Paolo Cabras, Aldo Martelli, Chimica degli alimenti, Piccin editore, 2004, ISBN 88-299-1696-X.
- Francesco Calza, L'acqua. Utilizzo, depurazione, recupero, 3ª ed., Tecniche Nuove, 2008, ISBN 88-481-1540-3.
- Pietro Celico, Elementi di idrogeologia, Liguori editore, 2004, ISBN 978-88-207-1875-6.
- (EN) Anders Celsius, Observations on two persistent degrees on a thermometer, Kungliga Swenska Wetenskaps Academiens Handlingar.
- Guido Chiesa, Inquinamento delle acque sotterranee, 2ª ed., Hoepli, 1994, ISBN 88-203-2120-3.
- Annalisa Cicerchia, Leggeri sulla terra. L'impronta ecologica della vita quotidiana, FrancoAngeli, 2004, p. 66, ISBN 88-464-5599-1.
- Mario Collepardi, Scienza e tecnologia del calcestruzzo, Hoepli, 1991, p. 271, ISBN 88-203-1910-1.
- Carlo Collivignarelli, Sabrina Sorlini, Potabilizzazione delle acque. Processi e tecnologie, Dario Flaccovio Editore, 2009, ISBN 88-7758-856-X.
- Carla Contardi, M. Gay, A. Ghisotti, Guido Robasto, Guido Tabasso, Guida tecnica sui trattamenti delle acque. Tecniche di trattamento dei reflui, sistemi di depurazione e di smaltimento, 2ª ed., Edizioni Franco Angeli, 1991, ISBN 88-204-6582-5.
- Costanzo Mazza, Daniele Mazza, Esercitazioni di chimica, Società Editrice Esculapio, 2008, p. 98, ISBN 88-7488-273-4.
- Emiliano Degiorgi, L'acqua. Un percorso tra scienza e insegnamento, Carocci Faber, 2004, ISBN 88-7466-114-2.
- (EN) Steven J. Dick, Life on other worlds: the 20th century extraterrestrial life debate, Cambridge, Cambridge University press, 2001, ISBN 0-521-79912-0.
- Valerio Di Donna, Fondamenti e didattica della geografia, Liguori Editore Srl, 2007, p. 171, ISBN 88-207-3975-5.
- (EN) Stephen H. Doyle, Habitable planets for man, American Elsevier Pub. Co, 1970, ISBN 0-444-00092-5.
- Gianfranco Fabbri, La trasformazione chimica. Chimica fisica per corsi annuali e semestrali, Piccin editore, 1992, p. 117, ISBN 88-299-1015-5.
- (EN) Felix Franks, Polywater, Cambridge, MA, The MIT Press, 1981, ISBN 0-262-06073-6.
- Roberto Germano, Aqua. L'acqua elettromagnetica e le sue mirabolanti avventure, Bibliopolis, 2007, ISBN 88-7088-517-8.
- Guillermo Gonzalez, Jay W. Richards, The Privileged Planet: How Our Place in the Cosmos is Designed for Discovery, Regnery Publishing, 2004, ISBN 0-89526-065-4.
- Pietro Greco, Pianeta acqua, Franco Muzzio editore, 2004, ISBN 88-7413-079-1.
- Mauro Greppi, Idrologia. Il ciclo dell'acqua e i suoi effetti, Hoepli, 1999, ISBN 978-88-203-2728-6.
- Jean L. Herbert, G. Tarozzi, L'induismo vivente, Edizioni Mediterranee, 1985, pp. 120-122, ISBN 88-272-0684-1.
- Patricia Hidiroglou, Acqua divina. Miti, riti, simboli, Edizioni Mediterranee, 2007, ISBN 88-272-1886-6.
- (EN) Arnold F. Holleman, Egon Wiberg, Inorganic chemistry, Academic Press, 2001, p. 248, ISBN 0-12-352651-5.
- (EN) C. J. Lada, N. D. Kylafits, The Origin of stars and planetary systems, Springer, 1999, ISBN 0-7923-5909-7.
- (EN) James Lovelock, Gaia: a new look at life on Earth, Oxford University Press, ISBN 0-19-286218-9.
- Francesco Mantelli, Giorgio Temporelli, L'acqua nella storia, FrancoAngeli, 2008, ISBN 88-464-9147-5.
- Girolamo Mecella, Metodi di analisi delle acque per uso agricolo e zootecnico, 1ª ed., FrancoAngeli, 2001, ISBN 88-464-2924-9.
- Luca Mercalli, Il ciclo dell'acqua, SMS, 2005, ISBN 88-900099-6-9.
- Paola Michelin Lausarot, G. Angelo Vaglio, 13, in Stechiometria per la chimica generale, Piccin editore, 2004, p. 288, ISBN 88-299-1727-3.
- Battista Mondin, Storia Della Metafisica, Edizioni Studio Domenicano, 1998, p. 39, ISBN 88-7094-313-5.
- Franco Montevecchi, Il potere marittimo e le civiltà del Mediterraneo antico, L.S. Olschki, 1997, ISBN 88-222-4492-3.
- (EN) William Nicholson, Journal of Natural Philosophy, Chemistry, and the Arts, G. G. and J. Robinson, 1800.
- (EN) Leo M. L. Nollet, Handbook of water analysis, CRC Press, 2000, ISBN 0-8247-8433-2.
- Sokyo Ono, Iniziazione allo shintoismo, Edizioni Mediterranee, 2004, pp. 62-63, ISBN 88-272-1715-0.
- Giulio Polizzotti, L'acqua, Milano, Casa Editrice Ambrosiana, 1974.
- Vandana Shiva, Le guerre dell'acqua, Feltrinelli, 2003, ISBN 978-88-07-17076-8. (traduzione di Bruno Amato)
- Jacques Sironneau, L'acqua. Nuovo obiettivo strategico mondiale, Asterios Editore, 1997, ISBN 88-86969-07-4.
- (EN) Bohumil Vybíral, Pavel Vorácek, "Autothixotropy" of water - An unknown physical phenomenon, and its possible importance for the cytoskeleton, in Phase Transitions in Cell Biology, Springer Netherlands, 2008, pp. 153-157, DOI:10.1007/978-1-4020-8651-9, ISBN 978-1-4020-8650-2. (Stampato), ISBN 978-1-4020-8651-9 (Online)
- Robert L. Wolke, Al suo barbiere Einstein la raccontava così. Vita quotidiana e quesiti scientifici, Feltrinelli Editore, 2004, ISBN 88-07-81820-5.
- Ecologia, Alpha Test, 2006, pp. 78-79, ISBN 88-483-0491-5.
- Antonio Saltini, Segnerà l'acqua il limite dello sviluppo economico del Pianeta?, in Spazio rurale, LI, n. 3, marzo 2006.
- Associazione nazionale delle bonifiche, La bonifica nella trasformazione del territorio e della società, Bologna, Edagricole, 1992.
- Associazione nazionale delle bonifiche, La protezione del suolo e la regolamentazione delle acque, il Mulino, Bologna, 1967.
- Conferenza nazionale delle acque, I problemi delle acque in Italia, Roma, Tipografia del Senato, 1972.
Voci correlate
- Chimica dell'acqua
- Legame a idrogeno
- Orbitale atomico
- Orbitale molecolare
- Acido
- Base
- Dimero dell'acqua
- Durezza dell'acqua
- Ghiaccio
- Ghiaccio amorfo
- Cristalli di ghiaccio
- Vapore acqueo
- Tipi di acqua
- Eventi naturali
- Utilizzi dell'acqua
- Acquedotto
- Azienda Speciale
- Acqua potabile
- Distribuzione delle risorse idriche
- Acque reflue
- Energia idroelettrica
- Irrigazione
- Taglio ad acqua
- Modi di dire
- Campi di studio
- Idraulica
- Idrografia
- Idrologia
- Ingegneria idraulica
- Ingegneria per l'ambiente e il territorio
- Chimica ambientale
- Altre
Altri progetti
 Wikiquote contiene citazioni sull'acqua
Wikiquote contiene citazioni sull'acqua Wikizionario contiene il lemma di dizionario «acqua»
Wikizionario contiene il lemma di dizionario «acqua» Wikimedia Commons contiene immagini o altri file sull'acqua
Wikimedia Commons contiene immagini o altri file sull'acqua
Collegamenti esterni
- acqua, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- Camillo Porlezza, Riccardo Olivieri, Francesco Scurti, Donato Ottolenghi, Carlo Guido Fontana, Filippo Bottazzi, Plinio Fraccaro, Carlo Cecchelli, ACQUA, in Enciclopedia Italiana, vol. 1, Istituto dell'Enciclopedia Italiana, 1929, p. 355.
- Girolamo Ippolito, ACQUA, in Enciclopedia Italiana, II Appendice, Istituto dell'Enciclopedia Italiana, 1948, p. 16.
- Pietro Venturini, ACQUA, in Enciclopedia Italiana, III Appendice, Istituto dell'Enciclopedia Italiana, 1961, p. 12.
- Eugenio Mariani, ACQUA, in Enciclopedia Italiana, IV Appendice, Istituto dell'Enciclopedia Italiana, 1978, p. 21.
- Paolo Migliorini, Franco Medici e Bruno Giardina, ACQUA, in Enciclopedia Italiana, V Appendice, Istituto dell'Enciclopedia Italiana, 1991, p. 26.
- Mario Beccari, ACQUA, in Enciclopedia Italiana, VI Appendice, Istituto dell'Enciclopedia Italiana, 2000.
- Marcello Benedini, Acqua, in Enciclopedia Italiana, VII Appendice, Istituto dell'Enciclopedia Italiana, 2006.
- Silvia Lilli, ACQUA, in Enciclopedia Italiana, IX Appendice, Istituto dell'Enciclopedia Italiana, 2015.
- àcqua, in Dizionario delle scienze fisiche, Istituto dell'Enciclopedia Italiana, 1996.
- Gianni Carchia, Guido Barone, Pietro Guerrieri, Valerio Leoni e Baldassare Messina, Acqua, in Universo del corpo, Istituto dell'Enciclopedia Italiana, 1998-2000.
- André Guillerme, Acqua, in Enciclopedia delle scienze sociali, Istituto dell'Enciclopedia Italiana, 1991-2001.
- Ven Te Chow e John W. Boylan e Kurt Kramer, Acqua, in Enciclopedia del Novecento, Istituto dell'Enciclopedia Italiana, 1975-2004.
- Sergio Carrà, Acqua, in Enciclopedia della scienza e della tecnica, Istituto dell'Enciclopedia Italiana, 2007-2008.
- acqua, in Dizionario di medicina, Istituto dell'Enciclopedia Italiana, 2010.
- acqua, in Lessico del XXI secolo, Istituto dell'Enciclopedia Italiana, 2012-2013.
- Luigi Cerruti, acqua, in Enciclopedia dei ragazzi, Istituto dell'Enciclopedia Italiana, 2004-2006.
- C. Frugoni e A. Berger, Acqua, in Enciclopedia dell'Arte Medievale, Istituto dell'Enciclopedia Italiana, 1991-2000.
- Alberto Heimler, acqua, in Dizionario di Economia e Finanza, Istituto dell'Enciclopedia Italiana, 2012.
- (EN) Steven S. Zumdahl, water, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- (EN) Opere riguardanti Acqua, su Open Library, Internet Archive.
- Domenico Consoli, acqua, in Enciclopedia dantesca, Istituto dell'Enciclopedia Italiana, 1970.
- Acqua, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
- Legge Galli - L. 5 gennaio 1994, n. 36. (PDF), su gruppo183.org. URL consultato il 27-02-2009.
- (EN) Struttura e proprietà dell'acqua, su lsbu.ac.uk.
- (EN) Stockholm International Water Institute (SIWI), su siwi.org.
- Utilizzo tecnologico dell'acqua, su ingegneria-tecnologia.com. URL consultato il 5 settembre 2009 (archiviato dall'url originale il 22 maggio 2009).
- Valore Acqua: portale dedicato al mondo dell'acqua, su valoreacqua.it. URL consultato il 29 giugno 2019 (archiviato dall'url originale il 19 agosto 2014).
- Trattamento Acqua: portale d'informazione sull'acqua e sul suo trattamento, su iltrattamentoacqua.eu.
- Domande E Risposte Sull’Acqua Del Rubinetto (PDF), su aimag.it. URL consultato il 14 aprile 2016 (archiviato dall'url originale il 20 aprile 2015).
| Controllo di autorità | Thesaurus BNCF 6045 · LCCN (EN) sh85145447 · GND (DE) 4064689-0 · BNE (ES) XX524789 (data) · BNF (FR) cb11931913j (data) · J9U (EN, HE) 987007551108905171 · NDL (EN, JA) 00567741 |
|---|









