Tiirano
| Tiirano | |
|---|---|
 | |
| Nome IUPAC | |
| Tiirano | |
| Nomi alternativi | |
| solfuro di etilene tiaciclopropano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C2H4S |
| Massa molecolare (u) | 60,11 g/mol |
| Aspetto | Liquido giallo pallido |
| Numero CAS | |
| Numero EINECS | 206-993-9 |
| PubChem | 9865 |
| SMILES | C1CS1 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,01 g/cm3 |
| Indice di rifrazione | 1,495 (20 °C) |
| Temperatura di fusione | −109 °C (−164 °F; 164 K) |
| Temperatura di ebollizione | 56 °C (133 °F; 329 K) |
| Tensione di vapore (Pa) a 293,15 K | 28,6 kPa |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 51-53 kJ/mol |
| ΔcombH0 (kJ·mol−1) | -2,0126 MJ/mol |
| Indicazioni di sicurezza | |
| Punto di fiamma | 10 °C (50 °F; 283 K) |
| Simboli di rischio chimico | |
  
| |
| Frasi H | 225 - 301+331 - 318 |
| Consigli P | 210 - 261 - 280 - 301+310 - 305+351+338 - 311 [1] |
Il tiirano, più comunemente conosciuto come solfuro di etilene, è un composto organico solforato (o zolforganico), cioè un composto organico contenente legami carbonio-zolfo, eterociclico avente formula C2H4S, o anche (CH2)2S.[2] Esso è in particolare il più semplice dei composti eterociclici contenenti zolfo nell'anello ed il più semplice degli episolfuri,[3] composti isoelettronici di valenza degli epossidi.
In condizioni standard il tiirano si presenta come un liquido incolore, volatile e infiammabile;[4] come molti altri composti organici solforati, emana un forte odore sgradevole.
Con il nome di tiirani si descrivono oggi tutti i derivati del solfuro di etilene.
Proprietà e struttura molecolare[modifica | modifica wikitesto]
Il solfuro di etilene è un composto endotermico (ΔHƒ° = +52±1 kJ/mol),[5] ma cineticamente è abbastanza stabile, anche se ha un certa tendenza alla polimerizzazione e non si può conservare per lungo tempo.[2] È solubile in acetone e cloroformio, ma poco solubile in alcool ed etere[4] ed è praticamente insolubile in acqua, a differenza dell'ossido di etilene, suo isoelettronico.[6]
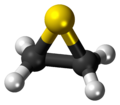
Lo scheletro della molecola è un triangolo isoscele con l'atomo di zolfo al vertice e i carboni alla base, legati ciascuno a due idrogeni; ne risulta una simmetria molecolare C2v.[7] La molecola è polare, il suo momento di dipolo,1,84 D,[8] è quasi uguale a quello dell'acqua (1,86 D) e dell'ossido di etilene (1,89 D).
Da indagini spettroscopiche rotazionali nella regione delle microonde è stato possibile ricavare i parametri strutturali (lunghezze ed angoli di legame) della molecola del solfuro di etilene in fase gassosa:[9]
r(C–C)) = 148,4 pm; r(C–H) = 108,3 pm; r(C–S) = 181,5 pm;
∠(HCH) = 115,8°; ∠(CSC) = 48,27°; ∠(CCS) = 65,865°; ∠(HCC) = 117,926°.
Mentre i legami C–H hanno lunghezza praticamente normale (109 pm[10]), il legame C–C è significativamente più corto del normale (154 pm[10]) per atomi C ibridi sp3 e i legami C–S sono un po' più lunghi del normale (182 pm[10]). Gli angoli interni all'anello differiscono alquanto dai 60° di un triangolo equilatero: come si può vedere, gli angoli su C sono un po' più ampi, mentre quello su S non arriva neanche a 50°. L'angolo tra gli idrogeni geminali (115,8°) è più vicino a quello che ci si attenderebbe per un C sp2 (120°), che per un C sp3 (109,5°). L'anello del tiirano, come altri anelli a tre termini, è in tensione: tensione angolare per gli angoli di legame molto diversi da quelli ottimali, e tensione torsionale per il fatto che gli idrogeni sono tutti eclissati. La tensione complessiva è stata stimata in 17,62 kcal/mol.[11][2]
Sintesi[modifica | modifica wikitesto]
Il tiirano si ottiene dalla reazione del carbonato di etilene con il tiocianato di potassio (KSCN); questo sale, che è igroscopico, viene prima fatto fondere sotto vuoto onde rimuoverne l'acqua assorbita:[12]
- KSCN + C2H4O2CO → KOCN + C2H4S + CO2
Un'altra sintesi del tiirano si basa sulla reazione in soluzione acquosa, a freddo, della tiourea con l'ossido di etilene, che la trasforma in urea:[13]
- (CH2)2O + (H2N)2C=S → (H2N)2C=O + (CH2)2S
Utilizzi[modifica | modifica wikitesto]
Il tiirano viene spesso aggiunto alle ammine per ottenere le 2-mercaptanoetilammine,[14] che sono ottimi composti chelanti:
- C2H4S + R2NH → R2NCH2CH2SH
Il tiirano è stato sperimentato anche nella modifica del chitosano assieme all'acrilato di metile e alla cisteamina, per sintetizzare un biopolimero in grado di immobilizzare e rilasciare in maniera controllata l'ibuprofene, un farmaco antinfiammatorio non steroideo.[15]
Note[modifica | modifica wikitesto]
- ^ Ethylene sulfide - Informazioni sulla sicurezza, su sigmaaldrich.com, Merck. URL consultato il 18 settembre 2017.
- ^ a b c Warren Chew e David N. Harpp, Recent aspects of thiirane chemistry, in Journal of Sulfur Chemistry, vol. 15, n. 1, 1993, pp. 1-39, DOI:10.1080/01961779308050628.
- ^ Giancarlo Bertolotti e Vincenzo Capitelli, Episolfuro, in Dizionario delle materie plastiche, Tecniche Nuove, 2007. URL consultato il 18 settembre 2017.
- ^ a b (EN) PubChem, Thiirane, su pubchem.ncbi.nlm.nih.gov. URL consultato il 23 aprile 2023.
- ^ S. Sunner, Corrected heat of combustion and formation values for a number of organic sulphur compounds, vol. 17, 1963, pp. 728–730. URL consultato il 23 aprile 2023.
- ^ (EN) Manfred Sander, Thiiranes, in Chemical Reviews, vol. 66, n. 3, 1º giugno 1966, pp. 297–339, DOI:10.1021/cr60241a004. URL consultato il 23 aprile 2023.
- ^ CCCBDB Experimental Data page 1, su cccbdb.nist.gov. URL consultato il 23 aprile 2023.
- ^ thiirane, su www.stenutz.eu. URL consultato il 23 aprile 2023.
- ^ (EN) Structure of Free Polyatomic Molecules: Basic Data, Springer Berlin Heidelberg, 1998, DOI:10.1007/978-3-642-45748-7, ISBN 978-3-540-60766-3. URL consultato il 23 aprile 2023.
- ^ a b c J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, Piccin, 1999, pp. A-25 - A-33, ISBN 88-299-1470-3.
- ^ (EN) Roger Ketcham e Vinod P. Shah, Chemistry of Substituted Styrene Sulfides., in Journal of Chemical & Engineering Data, vol. 11, n. 1, 1966-01, pp. 106–107, DOI:10.1021/je60028a031. URL consultato il 23 aprile 2023.
- ^ S. Searles, E. F. Lutz, H. R. Hays e H. E. Mortensen, Ethylene Sulfide (PDF), in Organic Syntheses, vol. 42, n. 59, 1962, DOI:10.15227/orgsyn.042.0059. URL consultato il 18 settembre 2017.
- ^ (EN) John F. Olin e F. B. Dains, THE ACTION OF THE HALOGEN HYDRINS AND OF ETHYLENE OXIDE ON THE THIOUREAS, in Journal of the American Chemical Society, vol. 52, n. 8, 1930-08, pp. 3322–3327, DOI:10.1021/ja01371a047. URL consultato il 23 aprile 2023.
- ^ R. J. Cremlyn, An Introduction to Organosulfur Chemistry, John Wiley and Sons, 1996, ISBN 0-471-95512-4.
- ^ A. P. Vieira, S. Badshah e C. Airoldi, Ibuprofen-loaded chitosan and chemically modified chitosans--release features from tablet and film forms., in International journal of biological macromolecules, vol. 52, Elsevier, 23 settembre 2012, pp. 107-15, DOI:10.1016/j.ijbiomac.2012.09.013. URL consultato il 18 settembre 2017.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su tiirano
Wikimedia Commons contiene immagini o altri file su tiirano
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) thiirane, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.