Colesterolo
| Colesterolo | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| 10R,13R-dimetil-17R-(6-metileptan-2R-il)-2,3,4,7,8,9,11,12,14,15,16,17-dodecaidro-1H-ciclopenta[a]fenantren-3S-olo | |
| Nomi alternativi | |
| (3β)-colest-5-en-3-olo (3β)-idrossicolest-5-ene (3β)-idrossi-5-colestene | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C27H46O |
| Massa molecolare (u) | 386,65 g/mol |
| Aspetto | solido bianco |
| Numero CAS | |
| Numero EINECS | 200-353-2 |
| PubChem | 5997 |
| DrugBank | DB04540 |
| SMILES | CC(C)CCCC(C)C1CCC2C1(CCC3C2CC=C4C3(CCC(C4)O)C)C |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,052 |
| Solubilità in acqua | insolubile[1] |
| Temperatura di fusione | 147 °C (420,15 K) |
| Temperatura di ebollizione | ~ 360 °C (~ 633,15 K) con decomposizione |
| Indicazioni di sicurezza | |
| Punto di fiamma | 250 °C (523,15 K) |
| Frasi S | 22-24/25 |
Il colesterolo è una molecola organica appartenente alla classe dei lipidi[2] e, più nel dettaglio, degli steroli. Riveste un ruolo particolarmente importante nella fisiologia degli animali. La molecola del colesterolo ha una struttura a quattro anelli rigidi ed è un costituente insostituibile delle membrane cellulari animali, oltre a essere un precursore degli ormoni steroidei, della vitamina D e degli acidi biliari. In patologia concorre alla formazione dei calcoli biliari e degli ateromi.
La concentrazione di tale sostanza nel sangue è detta colesterolemia; poiché nel sangue il colesterolo è contenuto nelle lipoproteine plasmatiche, si usa, in termini più precisi, far riferimento al colesterolo plasmatico totale, al colesterolo LDL, al colesterolo HDL o al colesterolo non-HDL (che include il colesterolo trasportato da tutte le lipoproteine plasmatiche con l'eccezione delle HDL). I valori della colesterolemia possono essere normali, bassi (ipocolesterolemia) o elevati (ipercolesterolemia), condizioni queste ultime potenzialmente pericolose per la salute umana.[3]
Livelli elevati di lipoproteine plasmatiche ricche di colesterolo (in particolare LDL) sono considerati tra i più importanti fattori di rischio cardiovascolare e possono provocare malattie molto gravi come l'aterosclerosi, in quanto esse si accumulano nelle arterie e avviano una reazione infiammatoria che conduce alla formazione di ateromi, il cui nucleo è ricco di colesterolo. Le placche aterosclerotiche possono provocare l'occlusione dei vasi ed eventualmente la morte nel caso in cui siano interessati distretti vitali (arterie coronarie e cerebrali).
Etimologia e notizie storiche[modifica | modifica wikitesto]

Il termine "colesterolo" deriva dal greco antico, χολή ("bile") e στερεός ("solido", perché cristallizzabile) uniti al suffisso olo relativo agli alcoli.
Secondo quanto riferisce Antoine-François de Fourcroy (1789),[4] la sua presenza, in forma di scaglie, è stata riscontrata nei calcoli della cistifellea da François Poulletier de La Salle (intorno al 1770)[5] e da Benjamin Gottlob Fridericus Conradi (1775).[6][7]
Nel 1815 Michel Eugène Chevreul ha chiamato questa sostanza "colesterina".[7] Il termine "colesterolo" è stato invece utilizzato per la prima volta nel 1894, dopo che Marcellin Berthelot (1859) ne aveva scoperto la natura alcolica.
Julius Vogel nel 1843 ha isolato il colesterolo dagli ateromi e nel 1910 il patologo russo Nikolaj Aničkov scopriva il ruolo leader del colesterolo nello sviluppo dell'aterosclerosi sperimentale.[8]
Lo studioso Friedrich Reinitzer (1888) ne ha definito la formula empirica (C27H46O) e Adolf Otto Reinhold Windaus (1919) quella di struttura, poi corretta nel 1932.[7] Nel 1975 il premio Nobel John Cornforth ne ha chiarito la stereochimica e stabilito la configurazione degli stereocentri.
Caratteristiche chimiche[modifica | modifica wikitesto]

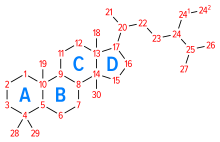
Il colesterolo è un alcool policiclico alifatico, costituito dal nucleo peri-idro-1,2-ciclopentano-fenantrene (nucleo tetraciclico proprio degli steroidi), con un doppio legame in C5 e una catena laterale isottilica in C17. La desinenza -olo deriva dal fatto che sul C3 del primo anello di atomi di carbonio (anello A) è presente il gruppo ossidrilico -OH. La sua formula bruta è C27H46O. Le sue dimensioni sono 5,2 × 6,2 × 18,9 Å.[1] 1 mmol di colesterolo pesa 386,67 mg. I quattro anelli che costituiscono la molecola sono indicati con le lettere dell'alfabeto (A, B, C, D), hanno tutti una conformazione a sedia e una configurazione stereochimica trans. Il gruppo ossidrilico in C3, i gruppi metilici angolari in C18 e C19 e la catena laterale sono in configurazione cis (posizione β).
Il colesterolo appare come una sostanza solida, non combustibile, quasi inodore, di colore bianco, di consistenza simile a quella della cera, di struttura cristallina. In particolare si trova in due forme cristalline: cristalli aghiformi e cristalli poliedrici (scaglie). Praticamente insolubile in acqua, è modestamente solubile in alcool e molto solubile nei solventi organici (ad esempio cloroformio e benzene), in grassi e oli. La solubilità massima del colesterolo in soluzione acquosa è di soli 1,8 µg/mL o 4,7 μmol/100mL.
La molecola del colesterolo è anfifilica (o anfipatica), in quanto è provvista di un'estremità idrofila, polare, costituita dal gruppo ossidrilico, e di una voluminosa parte idrofobica, non polare, rappresentata dal nucleo tetraciclico rigido e dalla catena laterale flessibile. Per questa sua natura il colesterolo dà luogo, in acqua, a una soluzione micellare (concentrazione micellare critica, o CMC, di 2,5÷4 10-8 M a 25 °C) e presenta a 124 °C una fase liquido-cristallina di tipo smectico.[1][9][10]
Il gruppo ossidrilico può formare esteri con gli acidi grassi trasformandosi in colesterolo esterificato, mentre il doppio legame tra C5 e C6 permette reazioni di addizione.
Nel corpo umano il colesterolo è presente sia come alcool non esterificato (anche detto "colesterolo libero"), e in tal caso è una molecola anfipatica, sia come colesterolo esterificato, ovvero come estere del colesterolo (colesteril estere) formatosi per reazione del gruppo ossidrile con un acido carbossilico, nel qual caso l'estere risultante è una molecola completamente apolare. Per la sua insolubilità in acqua, il colesterolo circola nel sangue unicamente in associazione con le lipoproteine plasmatiche.
Funzioni biologiche[modifica | modifica wikitesto]

Il colesterolo è indispensabile per la vita animale. Può rappresentare un 5‰ dei lipidi dei vertebrati, mentre è un costituente minore nella frazione lipidica delle piante.[11] Nelle piante è stato individuato, specie tra i lipidi superficiali, solo a concentrazioni relativamente basse rispetto ad altri steroli.[12] Il colesterolo è presente nei vegetali come intermedio nel metabolismo secondario.[13] I vegetali possono contenere sostanze lipidiche strutturalmente simili (fitosterine o fitosteroli), che differiscono dal colesterolo per le catene laterali, soprattutto quelle in C24: campesterolo, β-sitosterolo, lanosterolo, isofucosterolo.[14] A causa della presenza delle catene laterali, nelle cellule animali le funzioni del colesterolo non possono essere sostituite dai fitosteroli.[15][16] I vertebrati sono capaci sia di sintetizzare de novo il colesterolo, sia di utilizzare quello presente nella dieta; al contrario, gli invertebrati sono incapaci di sintesi endogena, ma sono in grado di convertire i fitosteroli in colesterolo attraverso la rimozione (de-alchilazione) della catena in C24.[17] Le più importanti funzioni svolte dal colesterolo sono:[18]
Funzioni strutturali[modifica | modifica wikitesto]
Negli animali il colesterolo è un componente essenziale di:
- Membrane di tutte le cellule animali, in quanto è l'unica specie lipidica dell'organismo ad avere una struttura ad anelli rigidi, mentre tutti gli altri lipidi di membrana presentano catene idrocarboniose notevolmente flessibili. L'85% del colesterolo libero cellulare si trova nella membrana plasmatica, dove si inserisce per >90% nel foglietto fosfolipidico interno (citoplasmatico) e per il 3÷5% in quello esterno,[19] orientandosi con il gruppo -OH esposto alla superficie, in corrispondenza delle teste polari dei fosfolipidi. In tal modo esso diminuisce la fluidità della membrana (vedi modello a mosaico fluido), proprietà dalla quale dipendono importanti funzioni, ad esempio: permeabilità a piccole molecole idrosolubili; attività dei recettori e degli enzimi di membrana che generano messaggeri intracellulari; stabilità meccanica; formazione di vescicole per il trasporto del loro contenuto ai vari organuli intracellulari.[20] In particolare, il colesterolo rende le membrane meno permeabili alle piccole molecole; è abbondante nella membrana plasmatica (circa il 50% dei lipidi di membrana è costituita da colesterolo), mentre è scarso (pochi punti percentuali) nelle membrane del reticolo endoplasmatico e dei mitocondri.[21][22] Poiché il reticolo endoplasmatico è la sede dove vengono assemblate le proteine, il basso contenuto di colesterolo facilita il movimento delle proteine nell'ambito della membrana.[23] Come sarà descritto nel paragrafo sulla biosintesi, le proteine che regolano la sintesi del colesterolo risiedono nel reticolo endoplasmatico e rispondono rapidamente ai cambiamenti della sua concentrazione nella membrana reticolare.
- Guaina mielinica dei nervi.
- Crescita e divisione cellulare, soprattutto nei tessuti ad alto turnover (es. epidermide, epiteli).
- Sviluppo embrionale: le malformazioni di neonati dopo la somministrazione di Contergan alle madri erano causate da un disturbo nella biosintesi di colesterolo; le sindromi da deficit genetico di enzimi della biosintesi del colesterolo sono caratterizzate da malformazioni plurime.[24][25]
Funzioni metaboliche[modifica | modifica wikitesto]
Il colesterolo costituisce il composto base nei processi di sintesi di:
- Ormoni steroidei delle ghiandole surrenali (aldosterone, cortisolo) e delle gonadi (testosterone, estradiolo, ecc.).[26]
- Vitamina D, sintetizzata nella cute sotto l'azione dei raggi ultravioletti.
- Acidi biliari, che il fegato secerne con la bile nel duodeno al fine di emulsionare i lipidi alimentari e renderli assorbibili dall'intestino tenue.[26]
Metabolismo[modifica | modifica wikitesto]

Il contenuto di colesterolo dell'organismo umano è di circa 150 g; l'encefalo da solo ne contiene 30 g[27] e il plasma circa 8 g. L'uomo produce per biosintesi autonoma la maggior parte del colesterolo necessario (pool endogeno), solo una piccola parte, in media 0,1÷0,3 g (massimo 0,5 g), viene assunta giornalmente con l'alimentazione (pool esogeno). Entrambi i pool sono soggetti a meccanismi regolatori, in modo tale che, in condizioni di equilibrio, la quantità di colesterolo sintetizzata più quella assorbita dagli alimenti corrisponde al colesterolo eliminato con la bile come colesterolo libero (negli adulti circa 800÷1400 mg/die)[28] e come acidi biliari (circa 500 mg/die).[29] Negli adulti la sintesi endogena giornaliera di colesterolo è quindi tra 1 e 2 g.[30] In particolare, in presenza di una dieta contenente 450 mg/die di colesterolo, la sintesi endogena nell'uomo si aggira intorno a 11÷13 mg/kg/die.[31]
Tutte le cellule dell'organismo sono capaci di sintetizzare colesterolo a partire dall'acetil-coenzima A, ma l'organo centrale del metabolismo del colesterolo è il fegato.
Al fegato giunge il colesterolo esogeno proveniente dall'assorbimento intestinale, veicolato dalle particelle rimanenti dei chilomicroni; a esso si aggiungono il colesterolo endogeno di sintesi epatica, quello derivato dalla captazione delle IDL (intermediate density lipoproteins) e delle LDL (low density lipoproteins) e quello di ritorno dai tessuti periferici tramite le HDL (high density lipoproteins).
La produzione del colesterolo endogeno è regolata dai componenti della dieta, in modo tale che la sua sintesi viene inibita dal colesterolo alimentare; gli acidi grassi trans-insaturi stimolano la sintesi endogena del colesterolo,[32] gli acidi grassi saturi laurico (C12:0), miristico (C14:0) e palmitico (C16:0), pur innalzando la colesterolemia, non hanno effetto sulla sintesi del colesterolo[33][34][35] (vedi Colesterolemia - Colesterolo e alimentazione). Negli epatociti il colesterolo è quindi assemblato nelle VLDL (very low density lipoproteins), affinché possa essere trasportato in tutto l'organismo. Il colesterolo epatico viene utilizzato anche per la secrezione di sali biliari e di colesterolo libero (non esterificato) nella bile: il fegato è così l'organo principale in grado di eliminare il colesterolo dall'organismo.

A livello dei tessuti periferici, il pool intracellulare di colesterolo deriva in parte dal plasma e in parte dalla sintesi endogena. Il primo è costituito dal colesterolo trasportato dalle LDL che vengono endocitate grazie all'intervento dei recettori specifici LDLR. Quando la disponibilità intracellulare di colesterolo è alta vengono inibite sia la sintesi endogena del colesterolo sia l'espressione dei recettori LDLR, in modo da evitare un eccesso di colesterolo libero nelle membrane e un suo accumulo nel citoplasma in forma di colesterolo esterificato. Dalla membrana plasmatica il colesterolo libero può essere rimosso dalle HDL che lo riportano nuovamente al fegato.
Poiché le LDL non riescono a superare la barriera emato-encefalica, il cervello deve produrre da sé il colesterolo di cui necessita.[36][37] Circa il 70% del colesterolo encefalico è prodotto dagli oligodendrociti ed è contenuto nel rivestimento mielinico degli assoni.[38]
Il colesterolo viene eliminato dall'organismo attraverso il processo metabolico indicato come trasporto inverso del colesterolo (RTC, reverse cholesterol transport). In questo processo il colesterolo in eccesso viene trasferito, prima, dai tessuti periferici alle HDL; una parte del colesterolo raccolto dalle HDL è ceduto alle LDL per opera della proteina di scambio degli esteri del colesterolo CETP (cholesterol ester transfer protein). Poi, il colesterolo, tramite le HDL e le LDL, raggiunge i due soli organi capaci di eliminare definitivamente il colesterolo: il fegato e l'intestino. Il fegato, come già visto, elimina il colesterolo eccedente ricevuto dalle HDL e dalle LDL nella bile, mentre l'intestino è in grado di espellere il colesterolo ricevuto dalle LDL direttamente nel lume intestinale, grazie alla presenza di un sistema di trasporto presente nell'orletto a spazzola degli enterociti, sistema costituito dalle proteine ABCG5 e ABCG8 (ATP binding cassette transporters G5/8). La fase intestinale del trasporto inverso del colesterolo è conosciuta come TICE (transintestinal cholesterol excretion).[39][40] Al contrario di quanto accade nel fegato, nel caso del TICE non vi è la partecipazione delle HDL.[41]
Assorbimento intestinale[modifica | modifica wikitesto]

È credenza popolare che le uova siano controindicate in una dieta di pazienti diabetici e ipercolesterolemici. Numerose ricerche hanno dimostrato l'inesattezza di questa affermazione. Uno studio pubblicato nel maggio 2018 nell'American Journal of Clinical Nutrition, ha dimostrato che i soggetti con prediabete che hanno utilizzato una dieta controllata (con particolare attenzione alla sostituzione di grassi saturi con monoinsaturi e grassi polinsaturi) e che hanno assunto 12 uova/settimana per 6 mesi, non hanno evidenziato alterazioni della colesterolemia rispetto a quelli che hanno seguito una dieta a basso contenuto di uova, 2/settimana.

Oltre ai 300÷450 mg/die di colesterolo,[28] la dieta occidentale contiene in media circa 70÷80 g/die di trigliceridi, 5 g/die di fosfolipidi e 400 mg/die di steroli vegetali (fitosteroli), per lo più sitosterolo e campesterolo (frutta, mandorle, noci, anacardi, semi, ecc.);[42] un uovo contiene circa 200 mg di colesterolo. Nella dieta statunitense, l'apporto del colesterolo è mediamente così composto: 45÷50% carne e pesce, 30÷35% uova, 12÷15% latticini e 4÷6% condimenti grassi.[43]
Nel lume intestinale, al colesterolo della dieta si aggiungono gli 800–1400 mg/die di colesterolo endogeno provenienti dalla bile, per un totale di 1000–1800 mg/die: 1/3 alimentare (colesterolo esogeno) e 2/3 biliare (colesterolo endogeno); a questi pools andrebbe sommato quello proveniente dal TICE (vedi sopra) e una quantità imprecisata di colesterolo derivato dall'esfoliazione dell'epitelio intestinale, una notevole percentuale del quale non è tuttavia materialmente presente nel tratto enterico deputato all'assorbimento (duodeno e, in minor misura, digiuno).
La percentuale di colesterolo luminale assorbita dalla mucosa intestinale, a parità di contenuto dietetico, mostra una notevolissima variabilità individuale che oscilla tra il 25% e il 75%, attestandosi in media intorno al 50%.[44][45] L'assorbimento dei fitosteroli è invece del 5%-15%.[46] La percentuale assorbita è anche inversamente correlata con la quantità di colesterolo presente nel lume intestinale, sia nel caso di assunzione acuta (risposta a un'unica somministrazione),[47] sia in quello di assunzione cronica (risposta dopo somministrazione protratta per giorni);[48] la percentuale di assorbimento si riduce al 25÷30% quando il carico di colesterolo è grande: un apporto dietetico eccezionale di 3 g di colesterolo comporta un assorbimento di 1 g circa.[49] Un caso assolutamente insolito è stato quello di un individuo ultraottantenne che abitualmente consumava 25 uova giornaliere (circa 5 g/die di colesterolo) da almeno 15 anni: l'assorbimento di colesterolo era del 18%.[50]
La quota di colesterolo alimentare in forma esterificata (10÷15%) viene prima idrolizzata a colesterolo libero per opera dell'enzima colesterol-esterasi pancreatica. Per effetto degli acidi biliari e delle molecole lipidiche anfipatiche (monogliceridi, fosfolipidi, acidi grassi), il colesterolo libero penetra nelle micelle del lume intestinale, che ne consentono la solubilizzazione.[51] A differenza del colesterolo alimentare, che si trova, prima, in forma di emulsione e, poi, in presenza di acidi biliari, nelle micelle, il colesterolo endogeno giunge nel duodeno già in micelle rapidamente assorbibili. Nella forma micellare, il colesterolo viene in contatto con l'orletto a spazzola dell'epitelio intestinale, dal quale viene assorbito, per essere incorporato nei chilomicroni, con i quali è immesso in circolo (70÷80% in forma esterificata) attraverso la linfa.[43]
Hanno influenza sull’assorbimento del colesterolo anche la velocità del transito intestinale e la quantità degli steroli vegetali (in quanto questi competono sia per l'incorporazione nelle micelle sia per il trasporto negli enterociti) e delle fibre alimentari. La mucina, che riveste la superficie luminale degli enterociti, potrebbe legare il colesterolo e facilitare il suo assorbimento, dal momento che i topi MUC1-/- (con deficit di mucina) presentano una riduzione del 50% dell’assorbimento del colesterolo.[52]
Assorbimento negli enterociti[modifica | modifica wikitesto]

L'assorbimento del colesterolo negli enterociti avviene per trasporto facilitato (energia-indipendente), nel quale sono coinvolte una serie di proteine di membrana, la cui relativa importanza deve ancora essere chiarita. Allo stato attuale sembra che i "recettori spazzini" (scavenger receptors) SR-B1 e CD36 siano coinvolti nel trasporto del colesterolo dalle micelle ai microdomini di membrana ricchi di colesterolo (detti raft), ma il ruolo fondamentale è attribuito alla Niemann–Pick C1-like protein 1 (NPC1L1)[53][54] (bersaglio del farmaco ezetimibe).
Secondo l'ipotesi più accreditata, NPC1L1 recluta il colesterolo nella membrana apicale, promuove la formazione di microdomini ricchi di colesterolo e, infine, ne determina l'endocitosi clatrina-dipendente verso il reticolo endoplasmatico, dove il colesterolo viene esterificato per opera della acil-CoA-colesterol-aciltransferasi 2 (ACAT2).[55][56] La proteina NPC1L1 contiene sequenze che legano il colesterolo (SSD, sterol-sensing domains): l'attivazione di queste sequenze permette l'interazione di NPC1L1 con il complesso clatrina-proteina AP2, che è responsabile dell'endocitosi dei raft.[57][58][59] Una volta completato il trasporto, NPC1L1 viene ritrasferita sulla membrana plasmatica per iniziare un nuovo ciclo. Quando la concentrazione intracellulare di colesterolo è elevata, NPC1L1 rimane confinata nel reticolo endoplasmatico, il ciclo si interrompe e l'assorbimento di colesterolo si arresta. Grazie a questo meccanismo di controllo (feedback negativo), l'organismo è in grado di modulare la percentuale di colesterolo alimentare che viene assorbita.
La selettività dei sistemi di trasporto assicura un più elevato assorbimento del colesterolo rispetto ai fitosteroli, che sono molto poco assorbiti. Inoltre due proteine della membrana luminale degli enterociti sono preposte all'eliminazione del surplus degli steroli assorbiti (sia colesterolo sia soprattutto sitosteroli): ABCG5 e ABCG8; la loro mutazione è causa della β-sitosterolemia.[51] Ne consegue che la concentrazione plasmatica dei fitosteroli è molto bassa (<1 mg/dL).[42] Non essendo i fitosteroli sintetizzati nell'organismo umano, i livelli di campesterolo sono utilizzati nella ricerca clinica come marker dell'assorbimento intestinale degli steroli (sia pure con qualche riserva).[60][61]
Biosintesi[modifica | modifica wikitesto]
Il colesterolo si forma dall'acetil-CoA. Nello stadio iniziale tre molecole di acetil-CoA vengono condensate per formare l'acido mevalonico che viene convertito in un'unità isoprenoide, l'isopentenil pirofosfato. Gli isoprenoidi sono una famiglia di composti le cui strutture sono costituite da unità di isoprene. Nel processo di biosintesi hanno successivamente luogo una serie di condensazioni che danno origine a catene isoprenoidi progressivamente più lunghe: geranil pirofosfato, farnesil pirofosfato, geranilgeranil pirofosfato e infine squalene. Nelle ultime tappe, lo squalene si ciclizza formando lanosterolo, che è quindi convertito in colesterolo. La biosintesi di una molecola di colesterolo richiede energia (18 ATP), 27 NADPH e 11 O2; per questa ragione l'organismo si avvale dell'assorbimento del colesterolo alimentare.[17]

Lo studio della biosintesi del colesterolo può essere effettuato facilmente prendendo in esame i monociti.[62] Le complesse tappe biosintetiche seguono la via metabolica dell'acido mevalonico e sono le seguenti:[63][64]
- Nella prima tappa si ha la conversione dell'acetil-CoA in acido mevalonico. Prima, si ha la condensazione di due molecole di acetil-CoA per formare acetoacetil-CoA; quindi l'acetoacetil-CoA reagisce con un'altra molecola di acetil-CoA per formare 3-idrossi-3-metilglutaril-CoA o HMG-CoA; quest'ultimo viene ridotto ad acido mevalonico dall'enzima HMG-CoA reduttasi, l'enzima regolatore dell'intera biosintesi del colesterolo. Le prime due reazioni sono reversibili, mentre la terza è irreversibile e determina la velocità della biosintesi;
- Nella seconda tappa si ha la formazione di unità isopreniche attivate (ricche di fosfato). Per prima cosa due gruppi fosfato(un pirofosfato) vengono aggiunti al mevalonato per trasferimento dall'ATP ( 3 molecole che vengono idrolizzate producendo 3 ADP, un fosfato e un pirofosfato ) e si forma la prima unità isoprenica, il Δ3-isopentenil pirofosfato;. Successivamente per condensazione di due molecole di Δ3-isopentenil pirofosfato si produce il geranil pirofosfato che addiziona un'altra molecola di Δ3-isopentenil pirofosfato formando il farnesil pirofosfato.
- Nella terza tappa per condensazione tra due molecole di farnesil pirofosfato, in cui vengono rilasciati i gruppi pirofosfato, si forma lo squalene, un idrocarburo polinsaturo.
- Nella quarta tappa lo squalene viene convertito in colesterolo. La molecola dello squalene, lineare, viene ciclizzata per formare il lanosterolo. Il lanosterolo viene, infine, convertito in colesterolo, tramite spostamento o rimozione di gruppi metilici.
Regolazione della biosintesi del colesterolo[modifica | modifica wikitesto]
L'enzima chiave (enzima regolatore) della sintesi del colesterolo è la 3-idrossi-3-metilglutaril-CoA-reduttasi (HMG-CoA reduttasi), presente nella membrana del reticolo endoplasmatico.

La biosintesi del colesterolo è regolata dalla concentrazione intracellulare di isoprenoidi, lanosterolo, colesterolo, ossisteroli e da alcuni ormoni, in primo luogo insulina e glucagone. Un'elevata concentrazione intracellulare di isoprenoidi (farnesil-pirofosfato) e di steroli (colesterolo e, soprattutto, lanosterolo) inibisce l'enzima HMG-CoA riduttasi, bloccando la biosintesi di nuovo colesterolo. In caso di carenza di colesterolo l'emivita dell'HMGCoA riduttasi è di oltre 12 ore, mentre nel caso opposto l'emivita è inferiore a 1 ora circa.[65] Anche il carciofo e l'aglio bloccano la sintesi del colesterolo per inibizione della HMG-CoA reduttasi; l'aglio inibisce anche la lanosterolo-14alfa-demetilasi.[66] L'insulina stimola la sintesi endogena di colesterolo, mentre il glucagone la inibisce.[67][68][69]
Questi fattori di controllo creano un meccanismo di feedback negativo tra assorbimento intestinale e sintesi endogena di colesterolo: in questo modo la quantità di colesterolo sintetizzato è inversamente proporzionale alla quantità di colesterolo assunto con la dieta. Tuttavia l'efficienza del meccanismo di feedback varia ampiamente tra gli individui. Ad esempio, nel lavoro di McNamara, a cui si riferisce il grafico riportato a fianco, a fronte di un aumento del contenuto in colesterolo della dieta, gli individui cosiddetti compensatori mostravano una riduzione della sintesi del 26%, mentre per i soggetti non-compensatori la riduzione era del 12%; in questo studio i non-compensatori erano circa il 30% della popolazione esaminata.[48]
Basandosi sui markers di assorbimento degli steroli (sitosterolo, campesterolo e colestanolo) e di markers di sintesi del colesterolo (derivati del lanosterolo, come latosterolo e desmosterolo), è stata proposta una classificazione degli individui in «alti assorbitori/bassi sintetizzatori» e «bassi assorbitori/alti sintetizzatori».[70][71] Hoenig (2006) ha proposto che il rapporto colestanolo/colesterolo venga utilizzato per classificare gli individui in 3 fenotipi: assorbitori (alto rapporto), sintetizzatori (basso rapporto) e fenotipo misto.[72] L'utilità pratica di questa classificazione, soprattutto alla luce di una possibile guida alla terapia ipocolesterolemizzante (ezetimibe vs statine), non è stata dimostrata.
La più comune sindrome genetica da difetto dei processi di biosintesi del colesterolo è la sindrome di Smith-Lemli-Opitz (SLOS), una sindrome rara (1 su 20.000÷50.000 nati) dovuta a deficit dell’enzima 7-deidrocolesterolo reduttasi.[73][25]
Trasporto nell'organismo[modifica | modifica wikitesto]
Visto che il colesterolo, come tutti i grassi, non è solubile nel sangue, per il trasporto ematico deve essere "imballato" in complessi aggregati, sferici o discali, di trasporto (lipoproteine plasmatiche). Questi aggregati consistono essenzialmente di:
- un involucro a singolo strato di fosfolipidi;
- apolipoproteine e colesterolo non esterificato intercalati nell'involucro di fosfolipidi;
- un nucleo idrofobico di acidi grassi, trigliceridi e colesterolo esterificato.
Le lipoproteine plasmatiche vengono classificate in base al loro peso specifico, che varia da <0,98 a 1,17 g/cm3 e che dipende dalla loro composizione lipidica (maggiore è il contenuto lipidico, minore è il peso specifico). Secondo il peso specifico si distinguono le seguenti classi di lipoproteine plasmatiche: chilomicroni, VLDL (very low density lipoproteins), IDL (intermediary density lipoproteins), LDL (low density lipoproteins), HDL2 e HDL3 (high density lipoproteins).


I chilomicroni sono prodotti dall'epitelio intestinale, durante la fase prandiale: il colesterolo e gli altri lipidi assorbiti vengono "assemblati", insieme ai lipidi neosintetizzati, con le apolipoproteine e secreti sotto forma di chilomicroni. Questi, in seguito all'idrolisi da parte della lipoprotein-lipasi presente sulla superficie delle cellule endoteliali, cedono trigliceridi (in forma di acidi grassi e glicerolo) ai tessuti periferici e, come "chilomicroni rimanenti" ricchi di colesterolo, portano il loro contenuto al fegato.
Nel fegato, soprattutto durante il digiuno, i lipidi vengono incorporati nelle VLDL, le quali vengono rilasciate nella circolazione sanguigna. Nel microcircolo, le VLDL sono idrolizzate dalla lipoprotein-lipasi endoteliale, rilasciando gran parte del proprio contenuto di trigliceridi (che diffondono nei tessuti) e trasformandosi in IDL o particelle rimanenti. Le IDL sono quindi idrolizzate a livello epatico (lipasi epatica) e convertite in LDL, ricche di colesterolo.
In circolo, tra le diverse classi di lipoproteine avviene uno scambio di componenti sia lipidici sia proteici. In particolare, si verifica un trasferimento di trigliceridi dalle apoB-lipoproteine (VLDL, IDL, LDL) alle HDL e di colesterolo esterificato in direzione inversa per opera della proteina per il trasferimento degli esteri del colesterolo o CETP (cholesteryl ester transfer protein).
In corrispondenza dei capillari, le LDL fuoriescono dalla circolazione e, dopo aver attraversato la matrice fondamentale del tessuto connettivo, raggiungono le cellule parenchimali, alla cui superficie si legano tramite l'interazione con il recettore per le LDL, e vengono trasportate nell'interno delle cellule, cedendo così il loro carico di colesterolo. Per evitare che le cellule siano sovraccaricate di colesterolo, i recettori LDLR sono soggetti a un meccanismo di controllo a feedback negativo, ovvero quando il contenuto di colesterolo libero nelle membrane cellulari diviene sovrabbondante, la sintesi dei recettori è soppressa.
Poiché il colesterolo in eccesso non può essere degradato nelle cellule, esso può essere immagazzinato nel citoplasma come gocce di colesterolo esterificato oppure può essere trasportato come colesterolo libero nella membrana plasmatica, da dove viene trasferito alle HDL grazie all'intervento di alcune proteine di trasporto di membrana (ABCA1, ABCG1/G4) e del recettore SR-B1 (scavenger receptor B1). In questo modo, le HDL raccolgono il colesterolo libero in eccesso dai tessuti periferici, lo immagazzinano in forma di colesterolo esterificato (per effetto dell'enzima LCAT, Fosfatidilcolina-sterolo O-aciltransferasi) e lo trasportano al fegato (cosiddetto "trasporto inverso del colesterolo"), affinché possa essere eliminato con la bile.[74].
Colesterolemia[modifica | modifica wikitesto]

Quando in medicina si parla di "colesterolo", non si intende il colesterolo inteso come sostanza chimica (si tratta di un'ambiguità semplificatoria), ma si parla delle lipoproteine plasmatiche che circolano nel sangue durante il digiuno: la relativa concentrazione si chiama colesterolemia. La colesterolemia viene distinta in colesterolemia totale, LDL, non-HDL (colesterolo totale - HDL) e HDL: livelli elevati dei primi tre parametri sono considerati dannosi per la salute, mentre alla colesterolemia HDL è attribuito un ruolo protettivo. Il colesterolo non-HDL include VLDL, lDL e LDL; in generale i livelli plasmatici del colesterolo non-HDL corrispondono al valore delle LDL + 30 mg/dL.[75]
I valori della colesterolemia dipendono da:
- equilibrio tra assorbimento intestinale, sintesi endogena, eliminazione biliare del colesterolo e trasformazione del colesterolo in acidi biliari;
- tempo di persistenza in circolo delle lipoproteine plasmatiche, che è funzione del loro metabolismo plasmatico, influenzato dall'azione di alcuni enzimi (LCAT, CETP), dalla degradazione per opera delle varie lipasi (lipoproteinlipasi, lipasi epatica, lipasi endoteliale), dall'esistenza di una moltitudine di varianti genetiche delle apolipoproteine e dalla rimozione dal plasma tramite i recettori specifici.
Grazie agli studi epidemiologici è stato possibile attestare l'esistenza di una relazione positiva tra valori inappropriati (valori eccessivamente alti rispetto al rischio cardiovascolare globale) di colesterolemia totale e di colesterolemia LDL e malattie cardiovascolari (CV) su base ischemica. Le indagini sperimentali hanno chiarito che il trait d'union tra colesterolemia e malattie CV ischemiche è costituito dall'accumulo delle lipoproteine plasmatiche nella parete arteriosa: tale fenomeno dà l'avvio alla serie di reazioni che portano all'aterosclerosi e alla formazione delle placche aterosclerotiche (ateromi) nelle arterie. Le placche, per effetto dei fenomeni infiammatori possono ulcerarsi e così favorire la formazione di un trombo che può ostruire, più o meno completamente, l'arteria.
Su raccomandazioni dell'organizzazione mondiale della sanità (OMS), i valori consigliati di colesterolemia nella popolazione generale sono:[76][77]
- colesterolemia totale inferiore a 200 mg/dl (limiti più restrittivi sono suggeriti dalle varie linee guida, come quelle della Società Europea di Cardiologia, per i soggetti con più fattori di rischio cardiovascolare)[78]
Numerosi studi epidemiologici (MRFIT, CARDIA, CHH, Progetto CUORE) hanno infatti dimostrato che, nella popolazione generale, la più bassa mortalità totale e cardiovascolare si registra negli individui con colesterolo totale <200 mg/dl, pressione arteriosa <120/80, indice di massa corporea (BMI) <25 kg/m2, non fumatori e non diabetici.[79]
Fondamentale è anche la suddivisione tra frazione di colesterolo LDL e HDL: tanto più il rapporto è favorevole alla prima, tanto più alto è il rischio di malattie CV. Il rapporto ottimale colesterolo totale/HDL è non superiore a 5 per gli uomini e a 4,5 per le donne. L'unione dei due parametri (colesterolo LDL e rapporto colesterolo totale/HDL) consente una migliore predittività dei rischi di mortalità CV.[76]

Ipercolesterolemia[modifica | modifica wikitesto]

L'ipercolesterolemia è una dislipidemia caratterizzata da un'elevata concentrazione plasmatica di colesterolo totale e LDL. Anche se è convenzione considerare elevati i valori che eccedono il 95º percentile di quelli della popolazione in esame, in questo caso la soglia per diagnosticare l'ipercolesterolemia è posta a 240 mg/dL a digiuno da 12 ore.[79] Tuttavia, come esposto sopra, i valori desiderabili di colesterolemia mutano a seconda del rischio CV globale.
L'ipercolesterolemia può presentarsi in forma primaria, come ipercolesterolemia familiare (causata da mutazioni del recettore LDL), come altre forme familiari monogeniche (es. mutazioni dell'apolipoproteina apoB-100) o nella più comune forma poligenica (dovuta alla combinazione di fattori dietetici e fattori genetici);[80] l'ipercolesterolemia è spesso secondaria, associata ad altre malattie endocrine e metaboliche, come il diabete mellito di tipo 2, la sindrome metabolica o le malattie della tiroide. Come altre malattie del metabolismo dei lipidi, l'ipercolesterolemia implica un rischio elevato di aterosclerosi.
I parametri metabolici caratteristici dell'ipercolesterolemia sono:
- colesterolo totale elevato
- lipoproteine a bassa densità (LDL) alte
- lipoproteine a bassissima densità (VLDL) normali o elevate
- beta-lipoproteine alte
- trigliceridi normali o elevati.
Clinicamente l'ipercolesterolemia familiare (FH) si manifesta con ipercolesterolemia totale molto elevata (300÷1 000 mg/dL) e alti livelli di LDL, xantomi, tendinosi, xantelasmi e arcus lipoides corneae (alone intorno alla pupilla).
Ipocolesterolemia[modifica | modifica wikitesto]
L'ipocolesterolemia è identificata da una concentrazione di colesterolo plasmatico totale inferiore al 5º percentile della popolazione di riferimento. I livelli di colesterolo che definiscono l'ipocolesterolemia variano, a seconda della popolazione presa in esame, tra <120 mg/dL e <160 mg/dL.[81]
Sulla base di un criterio eziologico si distinguono forme primitive (familiari e no), su base genetica, e forme secondarie, causate da: malattie concomitanti, quali malassorbimento intestinale, ipertiroidismo, insufficienza epatica grave, neoplasie maligne, malattie infettive acute o croniche (sepsi, tubercolosi), alcune anemie croniche; malnutrizione; condizioni critiche mediche e chirurgiche (politraumatizzati, grandi interventi chirurgici). La comparsa e il progressivo aggravamento dell'ipocolesterolemia nei pazienti critici hanno un significato prognostico sfavorevole.[81]
Basi razionali della terapia ipocolesterolemizzante[modifica | modifica wikitesto]
Tenendo presente quanto illustrato nel paragrafo del metabolismo del colesterolo, i farmaci ipocolesterolemizzanti possono essere raggruppati in classi sulla base del principale step metabolico bersaglio della loro azione. Una possibile classificazione, ispirata con qualche modifica a quella proposta da Rzman e Monostory nel 2010[82], potrebbe essere la seguente.
Inibitori dell'assorbimento intestinale del colesterolo[modifica | modifica wikitesto]
Vi appartiene l'ezetimibe. L'ezetimibe inibisce di oltre il 50% l'assorbimento del colesterolo presente nel lume dell'intestino tenue, legandosi alla proteina NPC1L1 e inibendo il trasporto degli steroli (colesterolo e fitosteroli) negli enterociti. Ne consegue una ridotta incorporazione di colesterolo nei chilomicroni e, quindi, un minore apporto di colesterolo al fegato in forma di chilomicroni remnants. Questo minor apporto di colesterolo induce l’espressione dei geni epatici che regolano sia la sintesi endogena del colesterolo, sia soprattutto quella dei recettori per le LDL. Quest’ultimo effetto promuove la captazione epatica delle LDL plasmatiche. Come risultato, in monoterapia (10 mg/die), l'ezetimibe riduce del 15÷20% la concentrazione plasmatica del colesterolo LDL (LDL-C) e di oltre il 40% le concentrazioni di campesterolo e sitosterolo.[83][84]
Inibitori della sintesi endogena del colesterolo[modifica | modifica wikitesto]

Vi fanno parte le statine che si sono rivelate i farmaci più efficaci nel trattamento dell'ipercolesterolemia, sia in termini di riduzione della colesterolemia sia di diminuzione degli eventi cardiovascolari, fatali e no: sono i farmaci di prima scelta per la terapia dell'ipercolesterolemia.[85] Nel gruppo sono compresi anche altri farmaci che inibiscono la sintesi del colesterolo agendo, rispetto alle statine, più a monte (inibitori dell'ACL, ATP citrate lyase quali l'acido bempedoico)[86] o più a valle (ad esempio inibitori della squalene-sintetasi, ancora in fase di studio)[82][87][88] nella via biosintetica del colesterolo.
Le statine sono inibitori competitivi dell'enzima HMG-CoA reduttasi, da cui dipende non solo la sintesi del colesterolo, ma anche quella di isoprenoidi, dolicolo (un poli-isoprenoide) e ubiquinone (o coenzima Q10). Il principale sito di azione delle statine è il fegato. Le statine permettono una riduzione di LDL-C fino al 50% circa.[89] Le azioni terapeutiche delle statine possono essere attribuite principalmente alla riduzione del colesterolo intra- ed extra-cellulare e degli isoprenoidi farnesil pirofosfato e geranilgeranil pirofosfato. Alla ridotta sintesi di ubiquinone e dolicolo, isopentenil pirofosfato e isoprenoidi sono probabilmente dovuti gli effetti tossici delle statine.[90][91] L'effetto ipocolesterolemizzante delle statine è dovuto all'inibizione della sintesi endogena del colesterolo. La riduzione del colesterolo intracellulare che ne consegue attiva i geni dei recettori LDL e ciò comporta una maggiore captazione cellulare delle LDL plasmatiche: il risultato è la riduzione della colesterolemia. Gli effetti della riduzione del colesterolo intracellulare sono dipendenti dall'attivazione del fattore di trascrizione genica, SREBP-2, che viene controllato dalla concentrazione cellulare di colesterolo. SREBP-2 attiva i geni dei recettori LDL e di alcuni enzimi liposintetici (in primis HMG-CoA-reduttasi);[89] nell'uomo prevale nettamente il primo effetto, mentre nel topo è maggiore il secondo: l'induzione compensatoria dell'HMG-CoA-reduttasi nei ratti risulta in un aumento della sintesi di colesterolo, che depotenzia l'effetto ipocolesterolemizzante delle statine.
Il riso rosso fermentato (il cui colore è legato all'azione della muffa Monascus purpureus) presenta delle significative proprietà di riduzione del colesterolo endogeno: con la fermentazione, il lievito produce la monacolina K, che presenta una struttura simile alla lovastatina. Si tratta di un vero e proprio nutraceutico.[92]
Inibitori della produzione epatica delle lipoproteine plasmatiche[modifica | modifica wikitesto]

Includono nuovi farmaci che agiscono sulla fase di assemblaggio delle lipoproteine.[93] Il mipomersen (Kynamro) è un oligonucleotide antisenso (AON, antisense oligonucleotide) per l'ApoB100: un frammento di RNA messaggero che interferisce con la normale sintesi delle apoproteine B100. Mipomersen riduce la produzione di lipoproteine ApoB100, senza bloccare completamente l'assemblaggio delle VLDL nel fegato; LDL-C si riduce del 25÷28%.[94] La lomitapide (Juxtapid e Lojuxta) inibisce la proteina MTP (microsomal triglyceride transfer protein), che permette l'assemblaggio delle lipoproteine nel reticolo endoplasmatico degli epatociti e degli enterociti. L'inibizione della produzione delle VLDL consente di abbassare i livelli delle LDL che da queste hanno origine.[95][96] Lojuxta riduce del 40% circa sia il colesterolo LDL sia i trigliceridi.[97] Entrambi i farmaci sono associati a un possibile rischio di steatosi epatica per accumulo di trigliceridi negli epatociti, quale effetto della loro mancata incorporazione e secrezione con le VLDL, ma questo pericolo è minore nel caso di mipomersen.[98]
Farmaci interferenti con il metabolismo delle lipoproteine plasmatiche[modifica | modifica wikitesto]
Comprendono i farmaci ipocolesterolemizzanti che intervengono sul metabolismo plasmatico delle lipoproteine. I rappresentanti più importanti di questo raggruppamento sono gli inibitori della CETP (cholesteryl ester transfer protein) e gli inibitori della PCSK9 (Proprotein Convertase Subtilisin/Kexin Type 9). I primi bloccano il trasferimento degli esteri del colesterolo dalle HDL alle altre lipoproteine plasmatiche e hanno come effetto la riduzione di LDL-C e l'aumento di HDL-C. Tre di questi farmaci (torcetrapib, evacetrapib e dalcetrapib) hanno dato risultati deludenti, un quarto (anacetrapib) si è rivelato promettente in un grande trial, riducendo LDL-C del 40%, aumentando HDL-C del 100% circa e diminuendo l'incidenza di eventi coronarici (-9%).[99][100] I secondi sono costituiti da anticorpi monoclonali che bloccano l'attività della PCSK9, proteina che agisce come chaperone, presente principalmente nel fegato (ma anche nell'intestino e nel rene). In condizioni fisiologiche la PCSK9, una volta liberata in forma attiva nell'ambiente extracellulare, si lega al recettore delle LDL e ne promuove la degradazione nei lisosomi: di conseguenza viene impedita la rimozione epatica delle LDL dal plasma. L'inibizione della PCSK9 da parte di evolocumab, alirocumab e bococizumab riduce LDL-C di circa il 60%.[101][102]
Dal 2020 è stato approvato anche inclisiran, un siRNA che impedisce la traduzione eucariotica della PCSK9[103].
Farmaci stimolatori dell'eliminazione del colesterolo dall'organismo[modifica | modifica wikitesto]

Sono rappresentati dai farmaci sequestranti gli acidi biliari: colestiramina, colestipolo e colesevelam.[104][105] Si tratta di resine a scambio anionico che non vengono assorbite dall'intestino, ma che nel lume enterico legano i sali biliari impedendone il riassorbimento nel tratto terminale dell'ileo. Questi composti si presentano come voluminosi polimeri che scambiano i loro anioni, soprattutto il cloruro (Cl-), con gli acidi biliari. La perdita di questi ultimi nelle feci, stimola a livello epatico la conversione del colesterolo in acidi biliari; la conseguente deplezione intracellulare di colesterolo induce una maggiore espressione dei recettori per le LDL, con il risultato di abbassare i livelli plasmatici di LDL-C del 10÷20% circa. Le resine a scambio ionico legano anche le vitamine liposolubili (vitamine A, D, E e K), per cui possono causare deficit vitaminico.
Ipocolesterolemizzanti con target principale nelle HDL[modifica | modifica wikitesto]
Tra i farmaci ipocolesterolemizzanti la niacina (o acido nicotinico) si impone come il farmaco più efficace per aumentare i livelli delle HDL.[106] La niacina e i farmaci derivati (acipimox) inibiscono la produzione epatica di VLDL e innalzano i livelli delle HDL.[107] L'effetto sulle VLDL è legato all'inibizione della sintesi di trigliceridi nel fegato attraverso due meccanismi principali: inibizione della lipolisi nel tessuto adiposo, che causa un minor apporto di acidi grassi al fegato, e blocco diretto nel fegato dell'enzima DGAT-2 (diacylglycerol acyltransferase 2), enzima regolatore della sintesi dei trigliceridi. La carenza di trigliceridi nel reticolo endoplasmatico degli epatociti provoca la degradazione delle apoproteine B100, cosicché risulta ostacolata la formazione delle VLDL. L'aumento della concentrazione del colesterolo HDL è determinata soprattutto dal minore trasferimento di esteri del colesterolo dalle HDL alle VLDL e alle LDL. Alte dosi di niacina (2 g) abbassano LDL-C del 10÷25% e trigliceridi del 20÷50%, aumentano le HDL del 15÷35% e diminuiscono il rischio di eventi coronarici.[108][109]
Note[modifica | modifica wikitesto]
- ^ a b c (EN) M.E. Haberland, Self-association of Cholesterol in Aqueous Solution (PDF), in Proc. Nat. Acad. Sci. USA, vol. 70, 1973, p. 2315, PMID 4525165.
- ^ McMurry, p.63.
- ^ Colesterolemia, in Treccani, dizionario della salute, 2010.
- ^ (FR) A.F. De Fourcroy, De la substance feuilletée et cristalline contenue dans les calculs biliaires, et de la nature des concrétions cystiques cristalisées., in Ann. Chim., vol. 3, 1789, pp. 242-252.
- ^ E. Ferroni (a cura di), Enciclopedia della chimica, vol. 3, Firenze, USES, 1974, p. 608.
- ^ Kuntz, p.10.
- ^ a b c R.P. Cook, pp. 1-2.
- ^ Friedman, p. 252.
- ^ (EN) C.R. Loomis, The phase behavior of hydrated cholesterol (PDF), in J. Lipid Res., vol. 20, 1979, pp. 525-535, PMID 458269.
- ^ (EN) P.F. Renshaw, On the nature of dilute aqueous cholesterol suspensions (PDF), in J. Lipid Res., vol. 24, 1983, pp. 47-51, PMID 6833881.
- ^ (EN) E. J. Behrman e Venkat Gopalan, Cholesterol and Plants, in Journal of Chemical Education, vol. 82, n. 12, 2005-12, pp. 1791, DOI:10.1021/ed082p1791. URL consultato il 30 aprile 2022.
- ^ Cholesterol, su Dr. Duke's Phytochemical and Ethnobotanical Database. URL consultato il 26 febbraio 2018 (archiviato dall'url originale il 5 giugno 2022).
- ^ David S. Seigler, Plant secondary metabolism, Springer US, 1999, ISBN 978-1-4615-4913-0, OCLC 840285720. URL consultato il 30 aprile 2022.
- ^ Phytosterols, phytostanols and their esters - Chemical and Technical Assessment (PDF), su fao.org. URL consultato il 26 febbraio 2018.
- ^ (EN) F. Xu, Dual roles for cholesterol in mammalian cells, in Proc. Natl. Acad. Sci. USA, vol. 102, 2005, pp. 14551-14556, PMC 1239893.
- ^ (EN) H.A. Scheidt, Cholesterol's aliphatic side chain modulates membrane properties, in Angew Chem. Int. Ed. Engl, vol. 52, 2013, pp. 12848-12851, PMC 4011182.
- ^ a b (EN) L. Ge, The Cholesterol Absorption Inhibitor Ezetimibe Acts by Blocking the Sterol-Induced Internalization of NPC1L1, in Cell Metabolism, vol. 7, 2008, pp. 508-519, DOI:10.1016/j.cmet.2008.04.001, PMID 18522832.
- ^ (EN) F.R. Maxfield, Cholesterol, the central lipid of mammalian cells, in Curr. Opin. Cell Biol., vol. 22, 2010, pp. 422–429, PMC 2910236.
- ^ (EN) C.J. Fielding, Intracellular cholesterol transport, in J. Lipid Res., vol. 38, 1997, pp. 1503-1521, PMID 9300773.
- ^ Widmaier, p. 49.
- ^ (EN) M.S. Bretscher, Cholesterol and the Golgi Apparatus, in Science, vol. 261, 1993, pp. 1280-1281, PMID 8362242.
- ^ (EN) M. Ohashi, Localization of Mammalian NAD(P)H Steroid Dehydrogenase-like Protein on Lipid Droplets, in J. Biol. Chem., vol. 278, 2003, pp. 36819-36829, PMID 12837764.
- ^ (EN) I. Nilsson, Inhibition of Protein Translocation across the Endoplasmic Reticulum Membrane by Sterols, in J. Biol. Chem., vol. 276, 2001, pp. 41748-41754, PMID 11535595.
- ^ (EN) F.D. Porter, Malformation syndromes due to inborn errors of cholesterol synthesis, in J. Clin. Invest., vol. 110, 2002, pp. 715–724, PMID 12235098.
- ^ a b (EN) F.D. Porter, Malformation syndromes caused by disorders of cholesterol synthesis, in J. Lipid Res., vol. 52, 2011, pp. 6–34, PMID 20929975.
- ^ a b Di Paolo Terlingo, Processo ai killer del colesterolo, in Quark, n. 47, 2 dicembre 2004, pp. 117-120.
- ^ Puri, p.250.
- ^ a b (EN) J-M. Lecerf, Dietary cholesterol: from physiology to cardiovascular risk (PDF), in Br. J. Nutr., vol. 106, 2011, pp. 6-14, PMID 21385506.
- ^ Rodès, p.174.
- ^ (EN) D.E. Cohen, Balancing Cholesterol Synthesis and Absorption in the Gastrointestinal Tract, in J. Clin. Lipidol., vol. 2, 2008, pp. S1–S3, PMC 2390860.
- ^ (EN) K.M. Kostner, Understanding Cholesterol Synthesis and Absorption Is the Key to Achieving Cholesterol Targets (PDF), in Asia Pacific Cardiology, vol. 1, 2007, pp. 7-10.
- ^ (EN) K. Sundram, Exchanging partially hydrogenated fat for palmitic acid in the diet increases LDL-cholesterol and endogenous cholesterol synthesis in normocholesterolemic women (abstract), in Eur. J. Nutr., vol. 42, 2003, pp. 188-194, PMID 12923649.
- ^ (EN) M.F. Fernandez, Mechanisms by which Dietary Fatty Acids Modulate Plasma Lipids, in J. Nutr., vol. 135, 2005, pp. 2075–2078, PMID 16140878.
- ^ (EN) M.J. Mazier, Diet fat saturation and feeding state modulate rates of cholesterol synthesis in normolipidemic men, in J. Nutr., vol. 127, 1997, pp. 332-340, PMID 9039836. URL consultato il 17/06/2018.
- ^ (EN) S.L. Cook, Palmitic acid effect on lipoprotein profiles and endogenous cholesterol synthesis or clearance in humans (PDF), in Asia Pacific J. Clin. Nutr., vol. 6, 1997, pp. 6-11, PMID 24394645.
- ^ (EN) J. Zhang, Cholesterol metabolism and homeostasis in the brain, in Protein Cell., vol. 6, 2015, pp. 254–264, PMID 25682154.
- ^ (EN) R.W. Mahley, Central Nervous System Lipoproteins, in Atherosc. Thromb. Vasc. Biol, vol. 36, 2016, pp. 1305-1315, PMID 27174096.
- ^ (EN) Y.H. Hung, Links between copper and cholesterol in Alzheimer's disease, in Front. Physiol., vol. 4, 2013, p. 111, PMC 3655288.
- ^ (EN) X. Lin, Ezetimibe Increases Endogenous Cholesterol Excretion in Humans, in Atheroscl. Thromb. Vasc. Biol., vol. 37, 2017, pp. 990-996, PMID 28279967.
- ^ (EN) R.E. Temel, A New Model of Reverse Cholesterol Transport: EnTICEing Strategies to Stimulate Intestinal Cholesterol Excretion, in Trends Pharmacol. Sci., vol. 36, 2015, pp. 440–451, PMID 25930707.
- ^ (EN) K.S. Bura, Intestinal SR-BI does not impact cholesterol absorption or transintestinal cholesterol efflux in mice, in J. Lipid Res., vol. 54, 2013, pp. 1567–1577, PMC 3646458.
- ^ a b (EN) B. Genser, Plant sterols and cardiovascular disease: a systematic review and meta-analysis, in Eur. Heart J., vol. 33, 2012, pp. 444-451, PMID 22334625.
- ^ a b Fiocca, pp. 349-351.
- ^ (EN) E. Sehayek, U-shaped relationship between change in dietary cholesterol absorption and plasma lipoprotein responsiveness and evidence for extreme interindividual variation in dietary cholesterol absorption in humans, in J. Lipid Res., vol. 39, 1998, pp. 2415–2422, PMID 9831629.
- ^ (EN) E. Sehayek, Genetic regulation of cholesterol absorption and plasma plant sterol levels: commonalities and differences, in J. Lipid Res., vol. 44, 2003, pp. 2030-2038, PMID 12897193.
- ^ (EN) Y. Yamanashi, Transporters for the Intestinal Absorption of Cholesterol, Vitamin E, and Vitamin K, in J. Atheroscler. Thromb., vol. 24, 2017, pp. 347–359, PMID 28100881.
- ^ (EN) R.E. Ostlund Jr., Cholesterol absorption efficiency declines at moderate dietary doses in normal human subjects, in J. Lipid Res., vol. 40, 1999, pp. 1453-1458, PMID 10428981.
- ^ a b (EN) D.J. McNamara, Heterogeneity of cholesterol homeostasis in man. response to changes in dietary fat quality and cholesterol quantity, in J. Clin. Invest., vol. 79, 1987, pp. 1729–1739, PMC 424515.
- ^ (EN) E. Quintao, Effects of dietary cholesterol on the regulation of total body cholesterol in man, in J. Lipid Res., vol. 12, 1971, pp. 233-247, PMID 5108133.
- ^ (EN) F.Jr. Kern, Normal Plasma Cholesterol in an 88-Year-Old Man Who Eats 25 Eggs a Day — Mechanisms of Adaptation, in N. Engl. J. Med., vol. 324, 1991, pp. 896-899, PMID 1953841.
- ^ a b (EN) J. Iqbal, Intestinal lipid absorption, in Am. J. Physiol. Endocrinol. Metab., vol. 296, 2009, pp. E1183–E1194, PMID 19158321.
- ^ (EN) H.H. Wang, Lack of the intestinal Muc1 mucin impairs cholesterol uptake and absorption but not fatty acid uptake in Muc1-/- mice, in Am. J. Physiol., vol. 287, 2004, pp. G547-554, PMID 15075252 (archiviato dall'url originale il 10 ottobre 2017).
- ^ (EN) A. BR. Thomson, Recent advances in small bowel diseases: Part II (PDF), in World J. Gastroenterol., vol. 18, 2012, pp. 3353–3374, PMID 22807605.
- ^ (EN) L. Jia, Niemann-Pick C1-Like 1 (NPC1L1) Protein in Intestinal and Hepatic Cholesterol Transport, in Ann. Rev. Physiol., vol. 73, 2011, pp. 239–259, PMID 20809793.
- ^ (EN) J.L. Betters, NPC1L1 and Cholesterol Transport, in FEBS Lett., vol. 584, 2010, pp. 2740–2747, PMID 20307540.
- ^ (EN) N.A. Abumrad, Role of the gut in lipid homeostasis, in Physiol. Rev., vol. 92, 2012, pp. 1061–1085, PMID 22811425.
- ^ (EN) J-H. Zhang, The N-terminal Domain of NPC1L1 Protein Binds Cholesterol and Plays Essential Roles in Cholesterol Uptake, in J. Biol. Chem., vol. 286, 2011, pp. 25088–25097, PMID 21602275.
- ^ (EN) L. Ge, Flotillins play an essential role in Niemann-Pick C1-like 1-mediated cholesterol uptake, in Proc. Natl. Acad. Sci. USA, vol. 108, 2011, pp. 551-556, PMID 21187433.
- ^ (EN) M. Meister, Endocytic Trafficking of Membrane-Bound Cargo: A Flotillin Point of View, in Membranes (Basel), vol. 4, 2014, pp. 356–371, PMID 25019426.
- ^ (EN) R.S. Tilvis, Serum plant sterols and their relation to cholesterol absorption, in Am. J. Clin. Nutr., vol. 43, 1986, pp. 92-97.
- ^ (EN) L. Jakulj, Plasma plant sterols serve as poor markers of cholesterol absorption in man, in J. Lipid Res., vol. 54, 2013, pp. 1144-1150, PMID 23178226.
- ^ (EN) P. Mistry, Individual variation in the effects of dietary cholesterol on plasma lipoproteins and cellular cholesterol homeostasis in man: studies of low density lipoprotein receptor activity and 3-hydroxy-3-methylglutaryl coenzyme A reductase activity in blood mononuclear cells, in J. Clin. Invest., vol. 67, 1981, pp. 493–502, PMID 6257763.
- ^ (EN) A. Mazein, A comprehensive machine-readable view of the mammalian cholesterol biosynthesis pathway [collegamento interrotto], in Biochem. Pharmacol., vol. 86, 2013, pp. 56–66, PMID 23583456.
- ^ Nelson, pp.860-870.
- ^ (EN) H. Jingami, Partial deletion of membrane-bound domain of 3-hydroxy-3-methylglutaryl coenzyme A reductase eliminates sterol-enhanced degradation and prevents formation of crystalloid endoplasmic reticulum (abstract), in J. Cell Biol., vol. 104, 1987, pp. 1693-1704, PMID 3584246.
- ^ (EN) S.K. Banerjee, Effect of garlic on cardiovascular disorders: a review (PDF), in Nutr. J., vol. 1, n. 4, 2002, PMID 12537594.
- ^ (EN) G.C. Ness, Feedback and hormonal regulation of hepatic 3-hydroxy-3-methylglutaryl coenzyme A reductase: the concept of cholesterol buffering capacity (abstract), in Proc. Soc. Exp. Biol. Med., vol. 224, 2000, pp. 8-19, PMID 10782041.
- ^ (EN) G.C. Ness, Insulin and glucagon modulate hepatic 3-hydroxy-3-methylglutaryl-coenzyme A reductase activity by affecting immunoreactive protein levels (PDF), in J. Biol. Chem., vol. 269, 1994, pp. 29168-29172, PMID 7961882.
- ^ (EN) G.C. Ness, Involvement of tristetraprolin in transcriptional activation of hepatic 3-hydroxy-3-methylglutaryl coenzyme A reductase by insulin, in Biochem. Biophys. Res. Commun., vol. 420, 2012, pp. 178-182, PMID 22405826.
- ^ (EN) TA. Miettinen, Effect of statins on noncholesterol sterol levels: implications for use of plant stanols and sterols (abstract), in Am. J. Cardiol, 96(1A), 2005, pp. 40D-46D, PMID 15992515.
- ^ (EN) N.R. Matthan, Sex‐Specific Differences in the Predictive Value of Cholesterol Homeostasis Markers and 10‐Year Cardiovascular Disease Event Rate in Framingham Offspring Study Participants (PDF), in J. Am. Heart Assoc., vol. 2, 2013, p. e005066, PMID 23525441.
- ^ (EN) MR. Hoenig, Cholestanol: a serum marker to guide LDL cholesterol-lowering therapy (abstract), in Atherosclerosis, vol. 184, 2006, pp. 247-254, PMID 16216250.
- ^ (EN) M. Witsch-Baumgartner, Birthday of a syndrome: 50 years anniversary of Smith-Lemli-Opitz Syndrome., in Eur. J. Hum. Genet, vol. 23, 2015, pp. 277-278, PMID 24824134.
- ^ (EN) M.W. King, S. Marchesini, Lipid digestion and Lipoproteins, su themedicalbiochemistrypage.org, 21 novembre 2008. URL consultato il 25 novembre 2008.
- ^ Goldman, p.1395.
- ^ a b Robertson, pp.25-27.
- ^ Goldman, p.2713.
- ^ (EN) A.L. Catapano et al., 2016 ESC/EAS Guidelines for the Management of Dyslipidaemias, in European Heart Journal, 27 agosto 2016, pp. 2999-3058, DOI:10.1093/eurheartj/ehw272. URL consultato il 31 agosto 2016.
- ^ a b M.M. Gulizia, Colesterolo e rischio cardiovascolare: percorso diagnostico-terapeutico in Italia (PDF), in G. Ital. Cardiol., 17 (Suppl. 1), 2016, p. S6, DOI:10.1714/2264.24358.
- ^ D.L. Kasper, pp. 2240-2442.
- ^ a b (EN) Y. Oztas, Hypocholesterolemia: A Neglected Laboratory Finding (abstract), in Acta Medica, vol. 4, 2015.
- ^ a b (EN) D. Rzman, Perspectives of the non-statin hypolipidemic agents (abstract), in Pharmacol. Therap., vol. 127, 2010, pp. 19–40, PMID 20420853.
- ^ (EN) H.R. Davis, Zetia: inhibition of Niemann-Pick C1 Like 1 (NPC1L1) to reduce intestinal cholesterol absorption and treat hyperlipidemia, in J. Atheroscler. Thromb., vol. 14, 2007, pp. 99-108, PMID 17587760.
- ^ Brunton, p.113.
- ^ (EN) R. Collins, Interpretation of the evidence for the efficacy and safety of statin therapy (PDF), in Lancet, vol. 388, 2016, pp. 2532–2561, DOI:10.1007/s11883-016-0611-4.
- ^ (EN) O. Bilen, Bempedoic Acid (ETC-1002): an Investigational Inhibitor of ATP Citrate Lyase (PDF), in Curr. Atheroscler. Rep., vol. 18, 2016, p. 61, PMC 5035316.
- ^ (EN) V.C. Menys, Squalene synthase inhibitors, in Br. J. Pharmacol., vol. 139, 2003, pp. 881-882, PMC 1573925.
- ^ (EN) L. Trapani, Potential role of nonstatin cholesterol lowering agents, in IUBMB Life, vol. 63, 2011, pp. 964-971, DOI:10.1002/iub.522/epdf.
- ^ a b (EN) P.J. Barter, New Era of Lipid-Lowering Drugs, in Pharmacol Rev., vol. 68, 2016, pp. 458-475, DOI:10.1124/pr.115.012203.
- ^ (EN) D. Moßhammer, Mechanisms and assessment of statin-related muscular adverse effects, in Br. J. Clin. Pharmacol., vol. 78, 2014, pp. 454–466, PMC 4243897.
- ^ (EN) P. Cao, Statin-induced muscle damage and atrogin-1 induction is the result of a geranylgeranylation defect, in FASEB J., vol. 23, 2009, pp. 2844-2854, PMC 2735363.
- ^ Il riso rosso fermentato è utile per abbassare il colesterolo?, su fondazioneveronesi.it.
- ^ (EN) D. Rader, Lomitapide and Mipomersen, in Circ., vol. 129, 2014, pp. 1022-1032, DOI:10.1161/CIRCULATIONAHA.113.001292.
- ^ (EN) T. Yamamoto, Development of Antisense Drugs for Dyslipidemia, in J. Atheroscler. Thromb., vol. 23, 2016, pp. 1011–1025, PMC 5090806.
- ^ AIFA. Agenzia italiana del farmaco, su aifa.gov.it. URL consultato il 12 febbraio 2018 (archiviato dall'url originale il 13 febbraio 2018).
- ^ (EN) S.C. Goulooze, Lomitapide, in Br. J. Clin. Pharmacol., vol. 80, 2015, pp. 179-181, DOI:10.1111/bcp.12612.
- ^ Scheda tecnica Lojuxta (PDF).
- ^ (EN) G. Reyes-Soffer, Complex effects of inhibiting hepatic apolipoprotein B100 synthesis in humans, in Sci. Transl. Med., vol. 8, n. 323, 2016, PMC 4944115.
- ^ (EN) T.D. Filippatos, Anacetrapib, a New CETP Inhibitor: The New Tool for the Management of Dyslipidemias? (PDF), in Diseases, vol. 5, 2017, p. 21, PMC 5750532.
- ^ (EN) A.R. Tall, Trials and Tribulations of CETP Inhibitors, in Circ. Res., vol. 122, 2018, pp. 106-112, DOI:10.1161/CIRCRESAHA.117.311978.
- ^ (EN) R. Chaudhary, PCSK9 inhibitors: A new era of lipid lowering therapy, in World J. Cardiol., vol. 9, 2017, pp. 76-91, PMC 5329749.
- ^ (EN) M.S. Sabatine, Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease, in New Engl. J. Med., vol. 376, 2017, pp. 1713-1722, DOI:10.1056/NEJMoa1615664.
- ^ Fitzgerald K, White S, Borodovsky A, Bettencourt BR, Strahs A, Clausen V, Wijngaard P, Horton JD, Taubel J, Brooks A, Fernando C, Kauffman RS, Kallend D, Vaishnaw A, Simon A, A Highly Durable RNAi Therapeutic Inhibitor of PCSK9, in The New England Journal of Medicine, vol. 376, n. 1, gennaio 2017, pp. 41–51, DOI:10.1056/NEJMoa1609243, PMC 5778873, PMID 27959715.
- ^ (EN) V. Charlton‐Menys, Human cholesterol metabolism and therapeutic molecules, in Experim. Physiol., vol. 93, 2008, pp. 27–42, DOI:10.1113/expphysiol.2006.035147.
- ^ (EN) H. Bays, Colesevelam hydrochloride: reducing atherosclerotic coronary heart disease risk factors, in Vasc. Health Risk Manag., vol. 3, 2007, pp. 733–742, PMC 2291317.
- ^ (EN) H. Vosper, Niacin: a re-emerging pharmaceutical for the treatment of dyslipidaemia, in Br. J. Pharmacol., vol. 158, 2009, pp. 429–441, PMC 2757682.
- ^ (EN) E.T. Bodor, Nicotinic acid: an old drug with a promising future, in Br. J. Pharmacol., 153(Suppl 1), 2008, pp. S68–S75, PMC 2268066.
- ^ (EN) R.L. Dunbar, Niacin Alternatives for Dyslipidemia: Fool’s Gold or Gold Mine? Part I: Alternative Niacin Regimens (PDF), in Curr. Atheroscler. Rep., vol. 18, 2016, p. 11, PMC 4753247.
- ^ (EN) R.L. Dunbar, Niacin Alternatives for Dyslipidemia: Fool's Gold or Gold Mine? Part II: Novel Niacin Mimetics (PDF), in Curr. Atheroscler. Rep., vol. 18, 2016, p. 17, PMC 4773474.
Bibliografia[modifica | modifica wikitesto]
- (EN) L.L. Brunton, Goodman & Gilman's The pharamacological basis of therapeutics, 12ª ed., McGraw-Hill, 2011, ISBN 978-0-07-162442-8.
- E. Ferroni, Enciclopedia della chimica, vol. 3, Firenze, USES, 1974, ISBN 88-03-00066-6.
- Silvio Fiocca et al., Fondamenti di anatomia e fisiologia umana, 2ª ed., Napoli, Sorbona, 2000, ISBN 88-7150-024-5.
- M. Friedman e G.W. Friedland, Le 10 più grandi scoperte della medicina, traduzione di N. Colombi, Milano, Baldini & Castoldi, 2000, ISBN 88-8089-844-2.
- (EN) L. Goldman e A.I. Schafer, Goldman-Cecil Medicine, 25ª ed., Philadelphia, Elsevier-Saunders, 2016, ISBN 978-1-4557-5017-7.
- (EN) D.L. Kasper, Harrison's Principles of internal medicine, 19ª ed., McGraw-Hill, 2015, ISBN 978-0-07-180216-1.
- (EN) E. Kuntz, Hepatology, 2ª ed., Heidelberg, Springer Medizin Verlag, 2006, ISBN 3-540-28976-3.
- (EN) J. McMurry, 27, in Organic Chemistry, 8ª ed., Belmont, Brooks/Cole, 2012, ISBN 0-8400-5444-0.
- (EN) D.L. Nelson, Lehninger Principles of biochemistry, 8ª ed., New York, W.H. Freeman & Company, 2013, ISBN 978-1-4641-0962-1.
- (EN) D. Puri, Textbook of medical biochemistry, 3ª ed., Elsevier, 2011, ISBN 978-81-312-2312-3.
- (EN) J. Rodès, Textbook of hepatology, 3ª ed., Oxford, Blackwell publishing, 2007, ISBN 978-1-4051-2741-7.
- (EN) A. Robertson et al., Food and health in Europe: a new basis for action (PDF), WHO Regional Publications - European Series N° 96, WHO, 2004, ISBN 92-890-1363-X.
- (EN) L. Stryer, capitolo 26, in Biochemistry, 5ª ed., New York, W.H. Freeman, 2002, ISBN 0-7167-3051-0.
- E.P. Widmaier et al., 3, in Vander Fisiologia, Milano, CEA, 2011, ISBN 978-88-08-18510-5.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni sul colesterolo
Wikiquote contiene citazioni sul colesterolo Wikizionario contiene il lemma di dizionario «colesterolo»
Wikizionario contiene il lemma di dizionario «colesterolo» Wikimedia Commons contiene immagini o altri file sul colesterolo
Wikimedia Commons contiene immagini o altri file sul colesterolo
Collegamenti esterni[modifica | modifica wikitesto]
- colesterolo, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) Medical Crossfire - Lipid/Metabolic, su theheart.org. URL consultato il 25 novembre 2008.
- (EN) Medical Crossfire - Hot Topics in Hypercholesterolemia: Impact of Recent Clinical Trial Data on Clinical Practice, su theheart.org. URL consultato il 25 novembre 2008.
- E. Muritti, G. Pavone, Chi ha paura del colesterolo?, su Repubblica.it, 8 aprile 2013. URL consultato il 31 Marzo 2018 (archiviato il 20 aprile 2013).«Philippe Even; Cesare Fiorentini; Michel de Lorgeril.»
- U. Ravnskov, Md, PhD, Presunti benefici del colesterolo contro le infezioni da batteri, su westonaprice.org, 24 giugno 2004. URL consultato il 31 marzo 2018 (archiviato l'11 luglio 2017).
| Controllo di autorità | Thesaurus BNCF 20899 · LCCN (EN) sh85024654 · GND (DE) 4010034-0 · BNF (FR) cb11931193t (data) · J9U (EN, HE) 987007285757605171 · NDL (EN, JA) 00566626 |
|---|


