Sindrome di Lutembacher
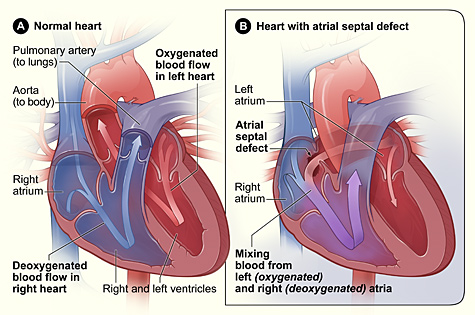
La sindrome di Lutembacher è una forma molto rara[1] di cardiopatia congenita che colpisce una delle camere del cuore (comunemente gli atri) e una valvola (comunemente la valvola mitrale). È comunemente noto sia come difetto del setto interatriale congenito (ASD)che come stenosi mitralica acquisita (SM).[2] Il difetto del setto interatriale congenito (alla nascita) si riferisce a un foro nel setto che separa i due atri; questa condizione è solitamente osservata nei feti e nei neonati.La stenosi mitralica si riferisce ai lembi della valvola mitrale (o lembi della valvola) che si attaccano l'uno all'altro rendendo molto piccola l'apertura per il passaggio del sangue dall'atrio ai ventricoli.[1]Con la valvola così piccola, il sangue ha difficoltà a passare dall'atrio sinistro al ventricolo sinistro. I difetti settali che possono verificarsi con la sindrome di Lutembacher includono: difetto del setto interatriale Ostium primum o ostium secundum che è più diffuso.[1]
La sindrome di Lutembacher colpisce le donne più spesso degli uomini[1] e può colpire bambini o adulti; la persona può nascere con il disturbo o svilupparlo in seguito. La sindrome fu descritta per la prima volta da René Lutembacher (1884–1968) a Parigi nel 1916.[2]
Per correggere la sindrome di Lutembacher, viene spesso eseguita la chirurgia. Esistono diversi tipi di interventi chirurgici a seconda della causa della sindrome di Lutembacher (ASD Primium o ASD Ostium Secundum con stenosi mitralica):
- Sutura (cuciture) o posizionamento di una pezza di tessuto (simile all'innesto cutaneo) sul foro per chiudere completamente l'apertura
- Ricostruzione della valvola mitrale e tricuspide durante la riparazione di eventuali fori nel cuore
- Chiusura tramite un device del ASD (es. Ombrello Amplatzer o CardioSEAL )[2]
- Terapia transcatetere percutanea
- Terapia transcatetere della valvuloplastica con palloncino per correggere la Stenosi Mitralica(SM)
Sintomi[modifica | modifica wikitesto]
Poiché la sindrome di Lutembacher è nota per ASD e SM, la maggior parte dei sintomi sperimentati sarà associata ad ASD e SM. Per la maggior parte delle persone, rimarranno asintomatici (non manifestano sintomi) ma quando i sintomi vengono mostrati, sono dovuti principalmente all'ASD e varieranno a seconda delle dimensioni del foro negli atri. Se il paziente ha un ASD di grandi dimensioni, la congestione polmonare (accumulo di sangue o liquido nei polmoni) si verificherà più tardi, ma se il paziente ha un ASD piccolo, i sintomi appariranno all'inizio del disturbo. In generale, a meno che l'ASD e la stenosi mitralica che causano la sindrome di Lutembacher non siano gravi, i sintomi possono non comparire fino alla seconda e terza decade di vita del paziente. Poiché molti dei pazienti sono asintomici e i sintomi possono non apparire fino a tarda età, la durata o la frequenza dei sintomi varia. Per sintomi come palipitazioni, sovraccarico ventricolare, insufficienza cardiaca e congensione polmonare, questi sintomi possono essere improvvisi e non così frequenti in quanto sono sintomi molto gravi. Per sintomi quali forte S1 mitrale, S2 polmonare, soffio diastolico medio, affaticamento, ridotta tolleranza all'esercizio, aumento di peso, edema alla caviglia e dolore al quadrante superiore destro e ascite, questi sintomi possono essere meno frequenti e gravi; la loro durata può essere solo di pochi secondi, minuti o anche mesi.
Sintomi principali[modifica | modifica wikitesto]
I principali sintomi della sindrome di Lutembacher a seguito di ASD e SM possono variare dall'insufficienza cardiaca alla congestione polmonare.
- Sovraccarico ventricolare destro e insufficienza cardiaca destra: entrambi sono causati da un grande ASD e da una SM (da moderata a grave).
- Palpitazioni: questo è causato dal sangue che scorre dall'atrio sinistro all'atrio destro causando una pressione atriale sinistra più alta e portando alla stenosi mitralica. Entrambi gli atri saranno dilatati (allungati o aperti) portando a future aritmie atriali o fibrillazione atriale.
- Congestione polmonare: quando il sangue o il fluido si accumula nei polmoni; questo di solito è un sintomo di stenosi mitralica e di un piccolo ASD.
- Alto mitrale S1 e ampia divisione fissa di S2 polmonare: Il suono forte della mitrale S1 e l'ampia divisione fissa di polmonare S2 sono un sintomo di stenosi mitralica. I suoni spesso sono causati da un gradiente di pressione ridotto nella zona mitrale che è stata causata dalla decompressione dell'atrio sinistro dall'ASD e da uno spostamento (spostandosi dalla posizione normale) della porzione inferiore del cuore ventricolare sinistro al grande ventricolo destro. La seconda divisione del suono cardiaco (S2) è causata dall'aumento del flusso sanguigno del cuore destro attraverso l'ASD che causa una chiusura tardiva della componente polmonare dell'S2 e una diminuzione del flusso sanguigno ventricolare e aortico sinistro.
- Soffio medio diastolico III/IV, soffio sistolico precoce: questo soffio cardiaco è causato da un aumento del flusso sanguigno attraverso la valvola tricuspide a causa di ASD; si sente meglio nella zona sternale inferiore sinistra o nella parte inferiore del cuore (apice).[1]
Sintomi minori[modifica | modifica wikitesto]
- Affaticamento: i sintomi sono causati da una diminuzione del flusso sistemico (sangue ossigenato al resto del corpo). Quando il paziente soffre di SM e il flusso sanguigno dall'atrio sinistro all'atrio destro provoca la riduzione del flusso sanguigno in avanti nel ventricolo sinistro, con conseguente riduzione del flusso sanguigno sistemico; questo provoca stanchezza.
- Ridotta tolleranza all'esercizio: sintomi causati anche da una diminuzione del flusso sistemico (sangue ossigenato al resto del corpo). Proprio come con la fatica, quando il paziente soffre di SM e il sangue scorre dall'atrio sinistro all'atrio destro, il flusso sanguigno in avanti nel ventricolo sinistro si riduce portando a una riduzione del flusso sanguigno sistemico; questo provoca stanchezza e quindi una ridotta tolleranza all'esercizio.
- Aumento di peso: questo si trova comunemente nei pazienti con ASD di grandi dimensioni e può essere un sintomo dello sviluppo di insufficienza cardiaca del lato destro. Poiché vi è un aumento cronico del flusso sanguigno da sinistra a destra attraverso gli atri, ciò porterà in futuro a un'insufficienza cardiaca del lato destro.
- Edema alla caviglia: anche questo è causato da un grande ASD e ha gli stessi sintomi e cause visti nell'aumento di peso e nel dolore al quadrante superiore destro. Poiché il flusso sanguigno non avviene correttamente e il cuore sta pompando sotto sforzo, nelle caviglie si verificherà un ristagno di sangue e fluido.
- Dolore al quadrante superiore destro: causato anche da un grande ASD; ha gli stessi sintomi e le cause sottostanti dell'aumento di peso e dell'edema alla caviglia.
- Ascite: l'ascite è nota come accumulo anormale di liquido negli spazi tra il rivestimento dell'addome e gli organi addominali. Stessi sintomi e cause di peso, aumento, edema alla caviglia e dolore al quadrante superiore destro.[3]
Sintomi meno comuni[modifica | modifica wikitesto]
- Dispnea parossistica notturna, ortopnea ed emottisi (segno di congestione venosa polmonare): questi sintomi sono meno frequenti nella sindrome di Lutembacher e sono più associati a SM e piccoli ASD o pazienti che sviluppano la sindrome di Lutembacher inversa. Questo sintomo è causato dalla stenosi mitralica.[3]
Disturbi correlati[modifica | modifica wikitesto]
Cause[modifica | modifica wikitesto]
La Sindrome di Lutembacher è causato indirettamente da danni o disturbi cardiaci. La sindrome di Lutembacher è causata da difetti congeniti in cui il cuore non riesce a chiudere tutti i fori nelle pareti tra gli atri o da un episodio di febbre reumatica in cui il danno viene fatto alle valvole cardiache come la valvola mitrale e risulta in un'apertura della parete cardiaca tra atri. Un feto o un bambino con la sindrome di Lutembacher ha solitamente un foro nella parete del cuore (interatriale) che separa l'atrio destro e sinistro.[4] Normalmente durante lo sviluppo fetale, il sangue bypassa i polmoni e viene ossigenato dalla placenta. Il sangue passa dal cordone ombelicale e scorre nell'atrio sinistro attraverso un'apertura chiamata forame ovale; il forame ovale è un buco tra i due atri.Una volta che un bambino nasce ei polmoni iniziano a riempirsi d'aria e il flusso sanguigno del cuore cambia, un lembo di tessuto (un po' 'come una botola) chiamato septum primium chiude il forame ovale o foro tra i due atri e diventa parte di la parete atriale.
La mancata chiusura del foro tra i due atri dopo la nascita porta a un disturbo chiamato ASD primium.Il problema più comune con un'apertura trovata nel cuore con la sindrome di Lutembacher è Ostium Secundum. L'Osteum Secundum è un foro che si trova all'interno del lembo di tessuto (setto primitivo) che alla fine chiuderà il foro tra i due atri dopo la nascita. Con entrambe le tipologie da ASD, l'ASD di solito fa sì che il flusso sanguigno dall'atrio destro salti andando al ventricolo destro e fluisca invece nell'atrio sinistro. Se è presente anche la stenosi mitralica (l'indurimento del lembo di tessuto noto come valvola che si apre e si chiude tra l'atrio sinistro e il ventricolo per controllare il flusso sanguigno), il sangue scorrerà nell'atrio destro attraverso il foro tra la parete degli atri invece di scorrere nel ventricolo sinistro e nella circolazione sistemica.[1]Alla fine questo porta ad altri problemi come il fallimento del ventricolo destro e un flusso sanguigno ridotto al ventricolo sinistro.
Oltre all'ASD, la SM può essere acquisita (presente o da un episodio di febbre reumatica o la madre ha o ha avuto febbre reumatica durante la gravidanza) o congenita (il bambino che nasce con il disturbo). Con la combinazione di ASD e SM, il cuore può essere sottoposto a forti sollecitazioni mentre cerca di spostare il sangue attraverso il cuore e i polmoni.
Meccanismo[modifica | modifica wikitesto]


Non esiste un meccanismo esatto per la sindrome di Lutembacher, ma piuttosto una combinazione di disturbi come risultato del difetto del setto atriale (ASD) e/o della stenosi della valvola mitrale.
Si pensa che l'ASD sia causato dalla mancata chiusura del foro (forame ovale) tra l'atrio destro e quello sinistro che normalmente si trova all'interno del cuore durante lo sviluppo fetale; può anche essere acquisita la creazione di un foro tra l'atrio. Esistono due tipi di ASD: ostium secundum e ostium primium.
Difetto settale atriale (Ostium primum)[modifica | modifica wikitesto]
La mancata chiusura del foro tra l'atrio destro e sinistro subito dopo la nascita è la causa alla base dell'ASD primum. Durante lo sviluppo fetale il sangue passerà dal cordone ombelicale e fluirà nell'atrio sinistro attraverso un foro tra i due atri. Quando un bambino nasce e i polmoni iniziano a riempirsi d'aria, il flusso sanguigno del cuore cambia; un lembo di tessuto (septum primium) normalmente chiude il foro (forame ovale) tra i due atri e diventa parte della parete atriale.[4] Durante l'ASD primum, dopo la nascita il foro non è completamente chiuso permettendo al sangue deossigenato di fluire negli atri sinistri dagli atri destri. Con l'impossibilità del sangue di passare dall'atrio destro al ventricolo destro e quindi alle vene polmonari, il sangue non otterrà ossigeno prima di lasciare il cuore e andare ad altre parti del corpo.A causa del flusso sanguigno errato, sintomi quali affaticamento (dalla diminuzione del flusso sanguigno sistemico), palpitazioni (dal flusso sanguigno dagli atri sinistro all'atrio destro), aumento di peso, edema, dolore toracico superiore destro (tutti causati dall'atrio sinistro a destro) flusso sanguigno) e dispnea parossistica notturna (mancanza di respiro durante il sonno), ortopnea (difficoltà a respirare mentre si è sdraiati) ed emottisi o tosse con sangue (tutti causati da piccoli ASD che causano il flusso sanguigno dall'atrio sinistro a quello destro).[3]
Difetto del setto interatriale (Ostium secundum)[modifica | modifica wikitesto]
Durante la forma più comune della sindrome di Lutembacher, ASD Ostium secundum, si formerà un foro nel lembo di tessuto (septum primium) che dovrebbe chiudersi tra i due atri dopo la nascita. Con l'inizio di un foro creato nel lembo di tessuto che chiude il foro più grande tra l'atrio sinistro e quello destro, il sangue può nuovamente fluire dall'atrio destro a sinistra.[1] L'osteum secundum causa molti degli stessi sintomi osservati nell'ASD primium. Con entrambi i tipi di ASD, il sangue fluirà dall'atrio destro saltando il ventricolo destro (o molto poco nel ventricolo) e fluirà invece nell'atrio sinistro, introducendo la possibilità che il sangue priva di ossigeno per andare al resto del corpo. A volte, la direzione del flusso sanguigno è in gran parte determinata dalla capacità del ventricolo destro e sinistro di contrarsi (contrarsi) e rilassarsi (compliance).
Oltre ai difetti congeniti o alla nascita che causano l'ASD, si pensa che anche l'ASD sia acquisito. Durante le procedure interventistiche pecutanee come la valvuloplastica mitralica (un processo chirurgico eseguito per riparare una valvola mitrale), l'11-12% degli individui svilupperà ASD consentendo al sangue di fluire dall'atrio sinistro a quello destro.[5]
Stenosi della valvola mitrale[modifica | modifica wikitesto]
La seconda causa della sindrome di Lutembacher è la stenosi mitralica (SM). La SM può essere causata da difetti alla nascita, febbre reumatica o solo stress al cuore dovuto all'ASD; Poiché la SM può essere causata da diverse cose, non esiste un meccanismo esatto ma molti meccanismi o cause. Se la stenosi della valvola mitrale è il risultato di difetti congeniti durante lo sviluppo derivanti dalla febbre reumatica, possono verificarsi diverse cose nel cuore. La febbre reumatica induce il sistema immunitario ad attaccare i propri tessuti proteici provocando la formazione di lesioni sui lembi della valvola mitrale. Man mano che i lembi guariscono nel tempo, i lembi perdono la loro pellicola e la loro flaccidità risultando in alette solide e rigide. La perdita di valvole mitraliche adeguate rende più difficile l'apertura delle valvole e il flusso del sangue. Come risultato del flusso sanguigno interrotto o rallentato dalla valvola difettosa, la pressione inizia a crescere nel cuore. Una volta si pensava che un ASD non fosse già presente, potrebbe formarsi a causa della SM, ma ora si pensa che l'ASD sia un difetto alla nascita o acquisito da procedure chirurgiche.[5]
Nel complesso, la sindrome di Lutembacher non ha un meccanismo certo ma una combinazione come risultato di ASD eSM.
Diagnosi[modifica | modifica wikitesto]
La sindrome di Lutembacher viene diagnosticata principalmente mediante esami fisici per suoni cardiaci, elettrocardiogrammi, radiografia del torace, ecocardiografia transtoracica o transesofagea, mappatura del flusso di colore e imaging Doppler. L'utilizzo dei vari test può aiutare a differenziare altre possibili condizioni come rigurgito mitralico, malattia di Ebstein, difetto del setto ventricolare (VSD).[3]
Esami fisici[modifica | modifica wikitesto]
Verrà eseguito un esame fisico per verificare la presenza di suoni cardiaci anormali, condizioni del cuore, pressione sanguigna, polmoni, palpitazioni, edema, aumento di peso, ascite o altri sintomi anormali. Il sangue può anche essere prelevato per aiutare a determinare la causa dell'affaticamento, la determinazione dell'ascite, altri problemi di salute che potrebbero essere strettamente correlati a causare i sintomi come reni, fegato, sistema immunitario (segni di febbre reumatica), livelli di glucosio anormali.
Elettrocardiogrammi[modifica | modifica wikitesto]
L'elettrocardiogramma (ECG) viene utilizzato per determinare la posizione, le dimensioni, la direzione del flusso sanguigno attraverso il foro atriale, l'emodinamica del ventricolo destro (circolazione sanguigna), la valvola tricuspide e il funzionamento del ventricolo sinistro. L'ECG può essere utilizzato anche per determinare il ritmo del cuore per determinare se esiste un'indicazione del ritmo sinusale o della fibrillazione atriale. Nell'ECG verrà studiata la morfologia dell'onda p per eventuali anomalie. Se durante l'ECG, l'onda P (depolarizzazione atriale) è alta, ampia o doppia nella derivazione II e accompagnata da una forza negativa profonda in V1, questa sarebbe considerata anormale; solo un'onda dovrebbe essere associata all'onda P. Inoltre, in un ECG verranno esaminati la morfologia e l'asse del QRS per eventuali anomalie. Se l'ECG mostra una deviazione dell'asse destro anormale o un blocco di branca destra (ciò significherebbe che non c'era alcun segnale che attraversava l'atrio per istruire il ventricolo a contrarsi o spremere il sangue dal ventricolo).[3]
Radiogramma del torace[modifica | modifica wikitesto]
Una radiografia del torace può essere somministrata a un paziente per determinare:
- Pletora polmonare: il test aiuterà a determinare se c'è uno shunt da sinistra a destra, il che significa che il sangue scorre dall'atrio sinistro a destra attraverso un foro tra i due atri.
- Lieve allargamento atriale sinistro: il test aiuterà a determinare se l'atrio sinistro è ingrandito a causa di flussi sanguigni alternati
- Allargamento ventricolare destro: il test aiuterà a determinare se il ventricolo è ingrandito a causa di un'ondata di sangue superiore al normale o se il ventricolo deve lavorare più del normale per pompare il sangue fuori dal ventricolo.
- Ingrandimento dell'arteria polmonare: il test aiuterà a determinare se c'è un volume di sangue grande nelle vene e nelle arterie polmonari rispetto al normale
- Calcificazione della valvola mitrale in età avanzata: il test aiuterà a determinare se la valvola mitrale o i lembi si stanno indurendo e perdendo la loro flaccidità.
- congestione vascolare polmonare, marcato allargamento atriale sinistro: il test aiuterà a determinare se vi è un segno di SM e di lieve ASD e quanto gravi siano entrambi.[3]
Ecocardiografia transtoracica o transesofagea[modifica | modifica wikitesto]
Ecocardiografia transtoracica o transesofagea immagini bidimensionali che possono essere fatte del cuore. Possono essere utilizzati per determinare le fasi della sindrome di Lutembacher. Sono usati per determinare:
- Ampio atrio sinistro: il test può aiutare a determinare se l'atrio sinistro è ingrandito a un flusso sanguigno ampio, quindi insolitamente
- Ampio atrio e ventricolo destro: il test aiuterà a determinare se l'atrio e il ventricolo destro sono ingranditi a causa di un maggiore flusso sanguigno
- Difetto del setto interatriale congenito: il test aiuterà a determinare se c'è un buco tra i due atri e se il sangue scorre attraverso entrambi
- Valvola mitrale stenotica: il test aiuterà a determinare se il flusso sanguigno attraverso la valvola mitrale è normale o se la valvola mitrale è rigida, ha un'apertura ridotta e restringe il flusso sanguigno attraverso di essa.[3]
Ecocolor doppler[modifica | modifica wikitesto]
Un flusso di colore e imaging doppler vengono utilizzati per confermare la presenza e valutare la gravità dell'ASD e della SM.[3]
Radiografia del torace[modifica | modifica wikitesto]
Verrà eseguita una radiografia del torace per determinare le dimensioni del cuore e dei vasi sanguigni che forniscono sangue ai polmoni.[6]
Cateterismo cardiaco[modifica | modifica wikitesto]
Il cateterismo cardiaco viene eseguito per confermare una diagnosi; non viene eseguito di routine prima. Può anche essere utilizzato per valutare la gravità dell'ASD e misurare l'area della valvola mitrale. Per determinare la presenza di ASD, un catetere viene fatto passare attraverso il foro sospetto tra l'atrio nell'atrio sinistro.
Trattamenti[modifica | modifica wikitesto]
Per trattare la sindrome di Lutembacher, devono prima essere trattate le cause alla base del disturbo: stenosi mitralica e difetto del setto interatriale. La sindrome di Lutembacher viene solitamente trattata chirurgicamente con trattamenti come:
- Terapia transcatetere percutanea per la SM
- Chiusura del dispositivo di ASD
Il trattamento transcatetere percutaneo per la SM può includere terapie transcatetere come la valvuloplastica con palloncino.
Terapia transcatetere percutanea[modifica | modifica wikitesto]
La terapia transcatetere percutanea viene utilizzata per riparare la valvola mitrale e talvolta il setto. Nella valvuloplastica mitrale percutanea con palloncino, utilizzando un catetere, un palloncino come il palloncino Inoue viene posizionato nei vasi sanguigni nella zona inguinale e il palloncino guidato verso il cuore. Se non è già presente un foro, può essere necessario inserire un piccolo foro negli atri e inserirlo nella valvola mitrale attraverso l'atrio sinistro; il palloncino viene quindi gonfiato. Il palloncino all'interno della valvola mitrale verrà gonfiato e sgonfio più volte per allargare l'apertura della valvola fino a quando l'apertura sarà soddisfacente; il palloncino verrà quindi sgonfio e rimosso.[2][7]
Il vantaggio di utilizzare procedure percutanee invece della chirurgia a cuore aperto non è la necessità di anestesia generale, trasfusioni di sangue e il tempo di recupero è più rapido. Lo svantaggio di questa procedura è la mancanza di procedure ripetitive e transettali se sono necessarie in seguito. Inoltre, se il paziente sviluppa successivamente una ricaduta di SM, sarà necessario eseguire un intervento chirurgico dove si utilizzano tecniche più evasive.[2] Inoltre, se è necessario inserire un foro negli atri per ottenere l'accesso alla valvola mitrale, c'è il rischio di sviluppare ASD secondariamente.
Effetti collaterali[modifica | modifica wikitesto]
I possibili effetti collaterali di questa procedura non invasiva potrebbero essere:
- Febbre
- Dolore al petto
- Fiato corto
- Gonfiore insolito o aumento di peso
- Gonfiore, sanguinamento, cambiamento del colore della pelle nel sito di cateterizzazione iniziale all'inguine o dolore all'inguine.[7]
Se si verifica uno dei suddetti sintomi, è importante contattare il medico per prevenire un altro decadimento della stenosi mitralica. Per garantire una buona salute, si raccomandano visite mediche di routine, dieta, perdita di peso, esercizio fisico approvato dal medico e uso di antibiotici nelle procedure dentali e di altro tipo.[7]
Chiusura del dispositivo[modifica | modifica wikitesto]
Per trattare l'ASD può essere utilizzata una chiusura del dispositivo. In effetti, una chiusura ASD è spesso raccomandata per alcuni casi come con un paziente che ha uno shunt da sinistra a destra significativo con una frazione di flusso polmonare e/o sistemico di Qp/Qs>1,5. È meglio eseguire questa procedura/intervento chirurgico di età compresa tra 2 e 4 anni. La chiusura viene eseguita con due metodi: interventistico o chirurgico.
Procedura transcatetere percutanea[modifica | modifica wikitesto]
Questa procedura viene eseguita posizionando un dispositivo come Amplatzer "ombrello", CardioSEAL simile alla terapia transcatetere percutanea. Un catetere viene inserito nei vasi e infilato al cuore e inserito nell'ASD chiudendo il difetto. Altro dispositivo di chiusura che è stato utilizzato è il GORE HELEX Septal Occluder.[6] Dopo che il dispositivo è stato inserito e copre il difetto, nel tempo il tessuto crescerà sul dispositivo dell'impianto fino a farlo diventare parte del cuore. Al paziente verranno somministrati farmaci anticoagulanti per i primi sei mesi successivi all'intervento: aspirina, clopidogrel o warfarin (Coumadin).
Chirurgia[modifica | modifica wikitesto]
Questa procedura viene eseguita mediante chirurgia a cuore aperto (sternotomia o toracotomia) utilizzando un ECC in cui il cuore viene fermato per consentire l'inserimento di un sistema di cannule speciali. Il foro viene chiuso da una sutura diretta (cucitura) se il foro è abbastanza piccolo o se il foro è più grande, suturando (cucendo) un piccolo pezzo di pericardio (tessuto cardiaco o pelle) o tessuto per chiudere il foro.
Per aumentare la qualità della vita in seguito a procedure/interventi chirurgici ASD, i pazienti devono sottoporsi a un esame fisico ed ECG ogni 3, 6 e 12 mesi con il proprio cardiologo.[6] Per molti pazienti con riparazione della chiusura ASD secundum, possono tornare alle loro normali attività a meno che la loro procedura non sia stata il cateterismo cardiaco che in questo caso dovrebbero riposare per alcuni giorni.[8] Tutti i pazienti devono rimanere in terapia con anticoagulanti per almeno 6 mesi e fino a un anno, a meno che il paziente non abbia avuto un ictus in cui sarebbero sempre stati in terapia con anticoagulanti. I pazienti con malattia coronarica o ipertensione polmonare assumeranno medicinali aggiuntivi descritti dal proprio medico. Per i pazienti che hanno subito un intervento chirurgico al cuore per riparare il difetto o hanno ricevuto un dispositivo di chiusura transcatetere, dovranno assumere una qualche forma di antibiotici per prevenire infezioni come l'endocardite per almeno 6 mesi dopo la procedura.
Il successo con la chiusura dell'ASD è molto alto, il 96% per le procedure percutanee e il 100% degli interventi chirurgici ASD come rilevato da un gruppo di ricerca.[8] Nessun paziente è stato trovato morto per trattamenti interventistici o chirurgici e solo il 7,2% dei pazienti che hanno ricevuto un dispositivo e il 24,0% dei pazienti che hanno subito un intervento chirurgico hanno avuto complicanze. Anche la degenza ospedaliera per ciascun gruppo è variata, il gruppo chirurgico è stato di 3,4 ± 1,2 giorni e il gruppo di dispositivi 1,0 ± 0,3 giorni.Come visto da questo studio, la prognosi era buona e la qualità della vita potrebbe essere eccellente.
Effetti collaterali[modifica | modifica wikitesto]
Gli effetti collaterali con la chiusura del dispositivo interventistico non sono stati ancora ampiamente supportati.[8]
I possibili effetti collaterali della procedura di chiusura del dispositivo ASD potrebbero essere:
- Febbre
- Dolore al petto
- Rigonfiamento
- Gonfiore, sanguinamento, cambiamento del colore della pelle nel sito di cateterizzazione iniziale all'inguine o dolore all'inguine
Con la chiusura chirurgica, il normale rischio di infezione, febbre e coaguli di sangue è tra i rischi. Se sono presenti segni di infezione come gonfiore, dolore o febbre, il paziente deve consultare un medico. I pazienti che hanno ASD riparato più tardi nella vita sono anche a maggior rischio di sviluppare fibrillazione atriale, specialmente se il dispositivo non è stabile.[8]
Ricerca recente[modifica | modifica wikitesto]
Esaminando i vantaggi dell'utilizzo del trattamento percutaneo come alternativa ai mezzi chirurgici per correggere SM e ASD, si è scoperto che il trattamento percutaneo combinato (inclusa la valvuloplastica con palloncino per la SM e l'occlusore del setto Amplatzer per la chiusura dell'ASD) ha migliorato la valvola mitrale planimetrica del paziente area a 2.1 cm (rispetto al precedente 1.5 cm), gradiente diastolico massimo a 9 mmHg (rispetto ai precedenti 17 mmHg) e gradiente diastolico medio a 4 mmHg (rispetto ai precedenti 9 mmHg).[9]
In un altro studio, i chirurghi hanno sviluppato un modo per utilizzare la terapia percante in situazioni difficili. In questo studio hanno sviluppato una tecnica per utilizzare il palloncino Inoue in valvuloplastica ma per inserire un filo nell'atrio sinistro prima di inserire il palloncino. Ciò ha consentito ai chirurghi di essere più precisi nel trattamento della valvola mitrale e di non far scivolare il palloncino fuori posto; il filo serviva da guida per l'inserimento del palloncino.[10]
Sono state esaminate altre procedure percutanee oltre alla valvuloplastica con palloncino per la SM. La plicazione percutanea dei foglietti (riparazione dei foglietti da bordo a bordo) è in fase di esplorazione come un modo per aumentare l'apertura della valvola mitrale bloccando i lembi mitralici. I morsetti vengono consegnati alla mitrale attraverso un catetere come con il palloncino e quindi fissati alla valvola mitrale. Dei pazienti che hanno ricevuto questo trattamento, il 74% dei pazienti ha raggiunto il successo chirurgico e, a 1 anno, il 68% è stato salvato dalla morte, il 90% dal dover sottoporsi a un intervento chirurgico o dalla morte per mancanza di ciò, una prognosi del 76,3% a tre anni.[11]
Dati i numerosi trattamenti possibili che devono venire, la ricerca futura sta continuando a trovare metodi migliori per trattare i pazienti con Lutembacher in modo non invasivo come con la terapia percutanea. Senza trattare con successo le complicanze più gravi di Lutembacher possono verificarsi come l'insufficienza cardiaca o anche disturbi come la sindrome di Eisenmenger.[4]
Note[modifica | modifica wikitesto]
- ^ a b c d e f g (EN) Sandhya Kulkarni, Amit K. Sakaria, Sanket K. Mahajan e Kuldeep B. Shah, Lutembacher's syndrome, in Journal of Cardiovascular Disease Research, vol. 3, n. 2, 2012, pp. 179–181, DOI:10.4103/0975-3583.95381, PMID 22629045.
- ^ a b c d e (EN) Mostafa Behjatiardakani, Mansour Rafiei, Hossein Nough e Reza Rafiei, Trans-Catheter Therapy of Lutembacher Syndrome: A Case Report, in Acta Medica Iranica, vol. 49, n. 5, 2011, pp. 327–330, PMID 21713755.
- ^ a b c d e f g h (EN) Kamran Riaz, Lutembacher Syndrome Clinical Presentation, su emedicine.medscape.com, 26 marzo 2014.
- ^ a b c (EN) Johnatan D. Marmur, Atrial Septal Defects (ASD) and Patent Foramen Ovale (PFO), su marmur.com.
- ^ a b (EN) Kamran Riaz, Lutembacher Syndrome - Overview, febbraio 2019.
- ^ a b c (EN) Atrial Septal Defect (ASD), su my.clevelandclinic.org.
- ^ a b c (EN) Mitral Valve: Balloon Mitral Valvotomy, su my.clevelandclinic.org.
- ^ a b c d (EN) Richard A. Krasuski, When and how to fix a 'hole in the heart': approach to ASD and PFO, in Cleveland Clinic Journal of Medicine, vol. 74, n. 2, febbraio 2007, pp. 137–147, DOI:10.3949/ccjm.74.2.137, ISSN 0891-1150, PMID 17333641.
- ^ (EN) Aydan Ongun Ozdemir, Deniz Kumbasar e Irem Dinçer, Percutaneous treatment of Lutembacher syndrome: a case report, in Turk Kardiyoloji Dernegi Arsivi: Turk Kardiyoloji Derneginin Yayin Organidir, vol. 38, n. 1, gennaio 2010, pp. 47–49, ISSN 1016-5169, PMID 20215845.
- ^ (EN) Anupam Bhambhani e H. S. Somanath, Percutaneous treatment of Lutembacher syndrome in a case with difficult mitral valve crossing, in The Journal of Invasive Cardiology, vol. 24, n. 3, marzo 2012, pp. E54–56, ISSN 1557-2501, PMID 22388316.
- ^ (EN) Paul T. L. Chiam e Carlos E. Ruiz, Percutaneous transcatheter mitral valve repair: a classification of the technology, in JACC. Cardiovascular Interventions, vol. 4, n. 1, gennaio 2011, pp. 1–13, DOI:10.1016/j.jcin.2010.09.023, ISSN 1876-7605, PMID 21251623.
Bibliografia[modifica | modifica wikitesto]
- Lee Goldman, Goldman's Cecil Medicine, 24thª ed., Philadelphia, Elsevier Saunders, 2011, ISBN 978-1437727883.