Reazione di Ugi
La reazione di Ugi è una reazione multicomponente tra un chetone o un'aldeide, un'ammina, un isonitrile e un acido carbossilico che consente la preparazione di derivati α-acilamminoamidici.[1][2][3][4] La reazione prende il nome da Ivar Karl Ugi, che per primo riportò questa reazione nel 1959.

La reazione di Ugi è esotermica e di solito è completa pochi minuti dopo l'aggiunta dell'isonitrile. Una concentrazione maggiore (0,5 M - 2,0 M) fornisce rese più elevate. Sono ottimali per la reazione solventi polari e aprotici, come il DMF. Tuttavia, anche il metanolo e l'etanolo possono essere utilizzati. Questa reazione ha un'elevata economia atomica intrinseca poiché viene persa solo una molecola di acqua e la resa chimica è elevata. Sono state pubblicate diverse recensioni.[5][6][7][8][9][10][11][12]
Poiché i prodotti di reazione sono potenziali peptidomimetici, ci sono stati molti tentativi di sviluppare una reazione di Ugi enantioselettiva,[13] il cui primo rapporto di successo risale al 2018.[14]
Meccanismo di reazione[modifica | modifica wikitesto]
È illustrato di seguito un meccanismo di reazione plausibile:[15]

L'ammina 1 e il chetone 2 formano l'imina 3 con perdita di un equivalente di acqua. La reazione acido-base con l'acido carbossilico 4 attiva lo ione imminio 5, che subisce attacco nucleofilo dall'isonitrile 6 con formazione dello ione nitrilio 7 . Quest'ultimo subisce addizione nucleofila da parte dell'anione carbossilato, portando alla sintesi dell'intermedio 8 . Il passaggio finale è un riarrangiamento di Mumm, nel quale il gruppo acile R4 è trasferito dall'ossigeno all'azoto del gruppo amminico. Tutti gli step di reazione sono reversibili ad eccezione del riarrangiamento di Mumm, che porta la reazione a completezza.
L'ammina 1 e il chetone 2 formano l'imina 3 con perdita di un equivalente di acqua. La reazione acido-base con l'acido carbossilico 4 attiva lo ione imminio 5, che subisce attacco nucleofilo dall'isonitrile 6 con formazione dello ione nitrilio 7 . Quest'ultimo subisce addizione nucleofila da parte dell'anione carbossilato, portando alla sintesi dell'intermedio 8 . Il passaggio finale è un riarrangiamento di Mumm, nel quale il gruppo acile R4 è trasferito dall'ossigeno all'azoto del gruppo amminico. Tutti gli step di reazione sono reversibili ad eccezione del riarrangiamento di Mumm, che porta la reazione a completezza.
Nella reazione Passerini (in cui manca l'amina) l'isonitrile reagisce direttamente con il gruppo carbonilico ma gli altri step della reazione sono gli stessi. Questa reazione può avvenire in competizione con la reazione di Ugi, fungendo da fonte di impurità.
Variazioni[modifica | modifica wikitesto]
Componenti di reazione[modifica | modifica wikitesto]
L'uso di composti bifunzionali aumenta la diversità dei prodotti di reazione. Allo stesso modo, combinazioni di reagenti variamente sostituiti portano a prodotti strutturalmente diversificati. La reazione di Ugi è stata applicata in combinazione con una reazione intramolecolare di Diels-Alder[16].
Un altro tipo di reazione è quella di Ugi-Smiles, in cui l'acido carbossilico è sostituito da un fenolo. In questa reazione il riarrangiamento di Mumm nella fase finale è sostituito dal riarrangiamento di Smiles.[17]
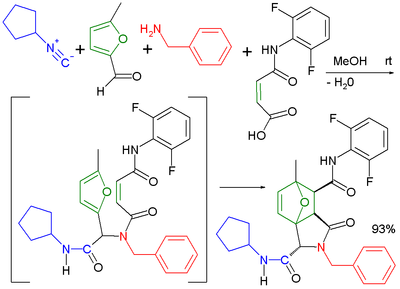

Un'altra combinazione è quella con la reazione di Buchwald-Hartwig .[18] Nella reazione di Ugi-Heck si verifica un accoppiamento arilico-arilico di Heck in un secondo step di reazione.[19]


Combinazione di ammina e acido carbossilico[modifica | modifica wikitesto]
Sono stati spesso usati β-aminoacidi nella reazione di Ugi per preparare composti β-lattamici.[20] In questo approccio il trasferimento di acile nel riarrangiamento di Mumm consente di formare l'anello a quattro termini. La reazione presenta una resa moderata a temperatura ambiente in metanolo usando formaldeide o aldeidi ariliche come reagenti. Ad esempio, la p -nitrobenzaldeide reagisce per formare il β-lattame mostrato con una resa del 71% come miscela diastereomerica di 4:1:
Sono stati spesso usati β-aminoacidi nella reazione di Ugi per preparare composti β-lattamici.[20] In questo approccio il trasferimento di acile nel riarrangiamento di Mumm consente di formare l'anello a quattro termini. La reazione presenta una resa moderata a temperatura ambiente in metanolo usando formaldeide o aldeidi ariliche come reagenti. Ad esempio, la p -nitrobenzaldeide reagisce per formare il β-lattame mostrato con una resa del 71% come miscela diastereomerica di 4:1:

Applicazioni[modifica | modifica wikitesto]
Biblioteche chimiche[modifica | modifica wikitesto]
La reazione di Ugi è una delle reazioni più usate per sviluppare librerie chimiche. Queste ultime sono insiemi di composti che possono essere testati ripetutamente. Utilizzando i principi della chimica combinatoriale, la reazione di Ugi offre la possibilità di sintetizzare un gran numero di composti variando semplicemente i sostituenti dei reagenti utilizzati. Queste librerie possono quindi essere testate con enzimi o organismi viventi per trovare nuove sostanze farmaceuticamente attive. L'uso della reazione di Ugi in combinazione con altre reazioni amplia la diversità chimica dei prodotti ottenibili.
Note[modifica | modifica wikitesto]
- ^ Ugi I, Meyr R, Fetzer U, Steinbrückner C, Versuche mit Isonitrilen, in Angew. Chem., vol. 71, n. 11, 1959, pp. 386, DOI:10.1002/ange.19590711110.
- ^ Ugi I, Steinbrückner C, Über ein neues Kondensations-Prinzip, in Angew. Chem., vol. 72, 7–8, 1960, pp. 267–268, DOI:10.1002/ange.19600720709.
- ^ Ugi, I., The α-Addition of Immonium Ions and Anions to Isonitriles Accompanied by Secondary Reactions, in Angewandte Chemie International Edition in English, vol. 1, n. 1, 1962, pp. 8–21, DOI:10.1002/anie.196200081.
- ^ Boltjes A, Liu H, Liu H, Dömling A, Ugi Multicomponent Reaction, in Org. Synth., vol. 94, pp. 54–65, DOI:10.15227/orgsyn.094.0054.
- ^ The Passerini and Ugi Reactions, in Comprehensive Organic Synthesis, vol. 2, Oxford, Pergamon, 1991, pp. 1083–1109, ISBN 0-08-040593-2.
- ^ vol. 8, 2003, DOI:10.3390/80100053, https://oadoi.org/10.3390/80100053.
- ^ The Passerini Reaction, in Organic Reactions, vol. 65, Wiley, 2005, ISBN 0-471-68260-8.)
- ^ vol. 8, PMID 16312152.
- ^ vol. 4, DOI:10.2174/1386207013331291, PMID 11281825, https://oadoi.org/10.2174/1386207013331291.
- ^ vol. 6, DOI:10.1002/1521-3765(20000915)6:18<3321::AID-CHEM3321>3.0.CO;2-A, PMID 11039522, <3321::AID-CHEM3321>3.0.CO;2-A https://oadoi.org/10.1002/1521-3765(20000915)6:18<3321::AID-CHEM3321>3.0.CO;2-A.
- ^ vol. 39, DOI:10.1002/1521-3773(20000915)39:18<3168::AID-ANIE3168>3.0.CO;2-U, PMID 11028061, <3168::AID-ANIE3168>3.0.CO;2-U https://oadoi.org/10.1002/1521-3773(20000915)39:18<3168::AID-ANIE3168>3.0.CO;2-U.
- ^ vol. 2020, DOI:10.1002/ejoc.202001157, ISSN 1434-193X, https://oadoi.org/10.1002/ejoc.202001157.
- ^ Wang Q, Wang DX, Wang MX, Zhu J, Still Unconquered: Enantioselective Passerini and Ugi Multicomponent Reactions, in Accounts of Chemical Research, vol. 51, n. 5, maggio 2018, pp. 1290–1300, DOI:10.1021/acs.accounts.8b00105, PMID 29708723.
- ^ Zhang J, Yu P, Li SY, Sun H, Xiang SH, Wang JJ, Houk KN, Tan B, Asymmetric phosphoric acid-catalyzed four-component Ugi reaction, in Science, vol. 361, n. 6407, settembre 2018, pp. eaas8707, DOI:10.1126/science.aas8707, PMID 30213886.
- ^ Denmark SE, Fan Y, Catalytic, enantioselective alpha-additions of isocyanides: Lewis base catalyzed Passerini-type reactions, in The Journal of Organic Chemistry, vol. 70, n. 24, novembre 2005, pp. 9667–76, DOI:10.1021/jo050549m, PMID 16292793.
- ^ Ilyin A, Kysil V, Krasavin M, Kurashvili I, Ivachtchenko AV, Complexity-enhancing acid-promoted rearrangement of tricyclic products of tandem Ugi 4CC/intramolecular Diels-Alder reaction, in The Journal of Organic Chemistry, vol. 71, n. 25, dicembre 2006, pp. 9544–7, DOI:10.1021/jo061825f, PMID 17137394.
- ^ El Kaim L, Gizolme M, Grimaud L, Oble J, Direct access to heterocyclic scaffolds by new multicomponent Ugi-Smiles couplings, in Organic Letters, vol. 8, n. 18, agosto 2006, pp. 4019–21, DOI:10.1021/ol061605o, PMID 16928063.
- ^ Bonnaterre F, Bois-Choussy M, Zhu J, Rapid access to oxindoles by the combined use of an Ugi four-component reaction and a microwave-assisted intramolecular Buchwald-Hartwig amidation reaction, in Organic Letters, vol. 8, n. 19, settembre 2006, pp. 4351–4, DOI:10.1021/ol061755z, PMID 16956224.
- ^ Ma Z, Xiang Z, Luo T, Lu K, Xu Z, Chen J, Yang Z, Synthesis of functionalized quinolines via Ugi and Pd-catalyzed intramolecular arylation reactions, in Journal of Combinatorial Chemistry, vol. 8, n. 5, 2006, pp. 696–704, DOI:10.1021/cc060066b, PMID 16961408.
- ^ a b Gedey S, Van der Eycken J, Fülöp F, Liquid-phase combinatorial synthesis of alicyclic beta-lactams via Ugi four-component reaction, in Organic Letters, vol. 4, n. 11, maggio 2002, pp. 1967–9, DOI:10.1021/ol025986r, PMID 12027659.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Reazione di Ugi
Wikimedia Commons contiene immagini o altri file su Reazione di Ugi
| Controllo di autorità | GND (DE) 4186673-3 |
|---|