Perossidi organici

In chimica organica, i perossidi organici sono composti organici contenenti il gruppo funzionale perossido (R-O-O-R' ). Se R' è un atomo di idrogeno, i composti sono chiamati idroperossidi. Il legame O−O dei perossidi si rompe facilmente, producendo radicali liberi della forma RO•, dove il punto rappresenta un elettrone spaiato. Pertanto, i perossidi organici sono utili come iniziatori per alcuni tipi di polimerizzazione, come le polimerizzazioni per addizione radicalica o la produzione di resine epossidiche utilizzate nelle vetroresina. Il metiletilchetonperossido e il perossido di benzoile sono i perssodi più comunemente usati per questo scopo. Tuttavia, questa stessa proprietà significa anche che i perossidi organici hanno un comportamento potenzialmente esplosivo. I perossidi organici, come le loro controparti inorganiche, sono spesso anche potenti agenti sbiancanti.[1]
Tipi di perossidi organici[modifica | modifica wikitesto]
- Esempi di perossidi organici
-
ter-Butil idroperossido, un idroperossido (di formula: ROOH) che è usato per epossidare gli alcheni.
-
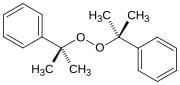
Perossido dicumarico, un dialchil perossido (formula: ROOR) che è utilizzato come iniziatore di polimerizzazioni.
-
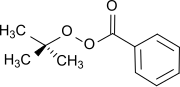
ter-butilperossibenzoato, un estere perossidico (formula: RCOO-OR) che è utilizzato come iniziatore radicalico.
-
Dibenzoil perossido, un perossido diacilico (formula: RCOO-RCOO) è utilizzato come iniziatore per polimerizzazioni
-
Acido peracetico, un acido perossicarbossilico (formula: RCOOOH), è un reagente comune in sintesi organica.
I perossidi organici sono classificati (i) in base alla presenza o assenza di un gruppo terminale ossidrilico (-OH) e (ii) in base alla presenza di sostituenti alchilici oppure acilici.[2] Un comportamento singolare all'interno dei perossidi organici è quello del perossido di difenile. Calcoli nell'ambito della meccanica quantistica prevedono che subisca una reazione quasi priva di barriera energetica simile al riarrangiamento benzidinico.[3]
Proprietà[modifica | modifica wikitesto]
La lunghezza del legame O−O nei perossidi è di circa 1,45Å, e gli angoli R−O−O (R = H, C) sono circa di 110°, e perciò simili a quelli dell'acqua. Tipicamente, gli angoli diedri C−O−O−R (R = H, C) sono, invece, di circa 120°. Il legame O-O è relativamente debole, con un'energia di dissociazione del legame di 45–50 kcal/mol (190–210 kJ/mol), che, per confronto, sono circa la metà delle forze dei legami C−C, C−H o C−O.[4][5]
Biologia[modifica | modifica wikitesto]

I perossidi svolgono un ruolo importante in biochimica. Molti aspetti della biodegradazione o dell'invecchiamento sono attribuiti alla formazione e al decadimento di perossidi formati dall'ossigeno nell'aria. Per contrastare questi effetti esistono una serie di antiossidanti, sia biologici che artificiali.
Sono noti centinaia di perossidi e idroperossidi, derivati da acidi grassi, steroidi e terpeni. Gli acidi grassi, in particolare, formano un buon numero di 1,2-diosseni. La biosintesi delle prostaglandine procede attraverso un endoperossido, che è una classe specifica di perossidi biciclici.[6] Nelle lucciole, l'ossidazione delle luciferine, che è catalizzata dall'enzima luciferasi, produce un composto perossidico, l'1,2-diossietano. Questa sostanza è instabile e degrada spontaneamente a CO2 e un chetone eccitato, che emette luce nel rilassamento (bioluminescenza).


Usi industriali[modifica | modifica wikitesto]
Nella chimica dei polimeri[modifica | modifica wikitesto]
Molti perossidi sono usati come iniziatori radicalici, nelle polimerizzazioni, ad esempio, per gli acrilati. Le resine industriali a base di esteri dell'acido acrilico e metacrilico sono prodotte per polimerizzazione radicalica ad alte temperature e l'iniziatore è proprio un perossido.[7] Il tipo di perossido e la temperatura aiuta a regolare la velocità del processo.[8]
Il MEKP, il perossido di benzoile e in misura minore il perossido di acetone sono usati come iniziatori per la polimerizzazione radicalica di alcune resine, come quelle di poliestere e i siliconi. Il pinano idroperossido è utilizzato nella produzione di SBR (gomma stirene-butadiene)
Agenti sbiancanti e disinfettanti[modifica | modifica wikitesto]
Il perossido di benzoile e il perossido di idrogeno sono usati come agenti sbiancanti e "maturanti" per trattare la farina. Lo scopo di questa lavorazione è quello di facilitare il rilascio del glutine dai grani di farina; l'alternativa è lasciare che la farina si ossidi lentamente con l'aria, che è un processo troppo lento per applicarlo nell'industria. Il perossido di benzoile è un farmaco efficace per il trattamento della maggior parte delle forme di acne.
Preparazione[modifica | modifica wikitesto]
I dialchil perossidi, ad esempio il dicumil-perossido, sono sintetizzati mediante aggiunta di perossido di idrogeno ad alcheni o mediante O-alchilazione di idroperossidi.
I perossidi diacilici sono tipicamente preparati per trattamento con perossido di idrogeno di cloruri acilici o anidridi in presenza di base
H2O2 + 2 RCOCl → (RCO2)2 + 2 HCl
H2O2 + 2 (RCO)2O → (RCO2)2 + 2 HCl
La reazione compete con l'idrolisi dell'agente acilante ma l'anione idroperossido è un nucleofilo migliore rispetto all'idrossido. I diacil perossidi asimmetrici possono essere prodotti trattando i cloruri acilici con un perossiacido.
I perossoesteri, come ad esempio il ter-butil-perossibenzoato, sono prodotti trattando anidridi acide o cloruri acilici con idroperossidi.
Questo metodo può anche produrre perossidi ciclici. I diossani a quattro membri possono essere ottenuti mediante cicloaddizione 2+2 di ossigeno agli alcheni.[9]
Reazioni[modifica | modifica wikitesto]
Omolisi[modifica | modifica wikitesto]
I perossidi organici sono ampiamente utilizzati per avviare la polimerizzazione delle olefine, ad es. la formazione di polietilene. Un passaggio chiave è l'omolisi:
- ROOR ⇌ 2 RO'
La tendenza all'omolisi viene sfruttata anche per modificare i polimeri mediante innesto di catene laterali (grafting), visbreaking, o per reticolare i polimeri termoindurenti. Quando viene utilizzato per questi scopi, il perossido è altamente diluito, quindi il calore generato dalla decomposizione esotermica viene assorbito dal mezzo circostante (ad esempio composto polimerico o emulsione).
Autoossidazione[modifica | modifica wikitesto]
Soprattutto quando sono in forma concentrata, i perossidi organici possono decomporsi per autoossidazione, poiché i perossidi organici contengono sia un ossidante (il legame O-O) sia un combustibile (legami C-H e C-C). Una "decomposizione autoaccelerata" si verifica quando la velocità di decomposizione del perossido genera calore a una velocità maggiore di quella che può essere dissipata dall'ambiente circostante. La temperatura è il fattore principale che fa aumentare il tasso di decomposizione. La temperatura più bassa alla quale un perossido organico subirà decomposizione autoaccelerata entro il tempo di una settimana è definita come temperatura di decomposizione autoaccelerata (SADT).
Processo al cumene[modifica | modifica wikitesto]
Gli idroperossidi sono intermedi e reagenti in diversi dei più diffusi processi commerciali. Nel processo al cumene, l'acetone e il fenolo sono prodotti dalla decomposizione dell'idroperossido di cumene
Riduzione[modifica | modifica wikitesto]
Gli organoperossidi possono essere ridotti ad alcoli con LAH, come descritto in questa equazione:
4 ROOH + LiAlH4 -> LiAlO2 + 2 H2O + 4 ROH
Anche gli esteri fosfitici e le fosfine terziarie possono subire riduzione:
- ROOH + PR3 -> OPR3 + ROH
Alcuni perossidi sono anche usati come farmaci. La loro azione si basa sulla formazione di radicali in punti specifici dell'organismo. Ad esempio, l'artemisinina ed i suoi derivati, come l'artesunato, possiedono l'azione più rapida, rispetto agli altri farmaci presenti in commercio, contro la malaria da falciparum.[10] L'artesunato è anche efficace nel ridurre la produzione di uova nell'infezione da Schistosoma haematobium.[11]
Analisi dei perossidi[modifica | modifica wikitesto]

Per la determinazione qualitativa e quantitativa dei perossidi sono utilizzati diversi metodi analitici.[12] Una semplice rilevazione qualitativa dei perossidi può essere effettuata con un metodo indiretto iodometrico.[13] I perossidi, idroperossidi e i peracidi ossidano lo ioduro di potassio in iodio, il quale reagisce con l'amido producendo un colore blu intenso. Sono disponibili cartine indicatrici che utilizzano questa reazione. Questo metodo è adatto anche per la valutazione quantitativa, ma non può distinguere tra i diversi tipi di perossidi. Per discriminare questi composti viene utilizzata la reazione che hanno i perossidi nella decolorazione di vari coloranti indigoidi.[14] Ad esempio, la perdita di colore blu nel blu di leucometilene è selettiva per il perossido di idrogeno.[15]
L'analisi quantitativa degli idroperossidi può essere eseguita mediante titolazione potenziometrica con litio alluminio idruro.[16] Un altro modo può essere la titolazione volumetrica con alcossidi, come per esempiol'etossido di sodio.[17]
Ossigeno attivo nei perossidi[modifica | modifica wikitesto]
Ogni gruppo perossidico è considerato avere un atomo di ossigeno attivo. Il concetto di contenuto di ossigeno attivo è utile per confrontare formulazioni contenenti diversi perossidi, anche perché il contenuto di ossigeno attivo è correlato al contenuto energetico. In generale, il contenuto energetico aumenta con il contenuto di ossigeno attivo, e quindi maggiore è il peso molecolare dei gruppi organici, minore è il contenuto energetico.
Il termine ossigeno attivo viene utilizzato per indicare la quantità di perossido presente in qualsiasi formulazione con del perossido organico. La quantità teorica di ossigeno attivo può essere descritta dalla seguente equazione:[18]
con p che rappresenta il numero di gruppi perossidici nella molecola e m la massa molecolare del perossido puro.
I perossidi organici sono spesso venduti come formulazioni che includono uno o più additivi stabilizzanti. Per motivi di sicurezza o vantaggi di prestazioni, infatti, conviene che le proprietà di una formulazione di perossido organico siano modificate mediante l'uso di additivi per desensibilizzare o stabilizzare il perossido organico per uso commerciale. Le formulazioni commerciali occasionalmente consistono in miscele di perossidi organici, che possono o meno essere stabilizzate.
Sicurezza[modifica | modifica wikitesto]

I perossidi sono forti ossidanti e reagiscono facilmente con la pelle, il cotone e la pasta di legno.[19] Per motivi di sicurezza, i composti perossidici vengono conservati in contenitore opachi e a bassa temperatura, poiché il riscaldamento e l'illuminazione accelerano la loro degradazione in reazioni chimiche potenzialmente pericolose in quanto possono potenzialmente sviluppare gas. Piccole quantità di perossidi, se fuoriescono dai recipienti di stoccaggio o di reazione, vengono neutralizzate con agenti riducenti come il solfato di ferro (II). Le misure di sicurezza negli impianti industriali che producono grandi quantità di perossidi includono:
1) I reattori si trovano all'interno di strutture in cemento armato con finestre a lamina, che, in caso di esplosione, alleviano la pressione e non si frantumano.
2) I prodotti vengono imbottigliati in piccoli contenitori per evitare reazioni a catena e trasferiti in un luogo freddo subito dopo la sintesi.
3) I contenitori sono realizzati con materiali non reattivi come acciaio inox, vetro scuro o alcune leghe di alluminio.[20]
Per un utilizzo sicuro dei perossidi organici concentrati, il parametro più importante è la temperatura, che deve essere mantenuta rigorosamente al di sotto della temperatura di decomposizione del composto, essendo una reazione autoaccelerata.[21]
La spedizione dei perossidi organici è limitata per questi motivi di sicurezza. Il Dipartimento dei trasporti degli Stati Uniti, ad esempio, elenca le restrizioni alla spedizione di perossido organico e i materiali proibiti nella tabella dei materiali pericolosi 49 CFR 172.101 in base alla concentrazione e allo stato fisico del materiale:
| Nome chimico | Numero CAS | Divieti |
|---|---|---|
| Acetil acetone perossido | 37187-22-7 | > 9% in massa di ossigeno attivo |
| Perossido di acetil benzoile | 644-31-5 | solido, o > 40% in soluzione |
| Ascaridolo | 512-85-6 | (perossido organico) |
| <i id="mwAVw">terz</i> -butil idroperossido | 75-91-2 | > 90% in soluzione (acquosa) |
| Di-(1-naftoil)perossido | 29903-04-6 | |
| Perossido di diacetile | 110-22-5 | solido, o > 25% in soluzione |
| Etil idroperossido | 3031-74-1 | |
| Composti iodossi | Asciutto | |
| Perossido di metiletilchetone | 1338-23-4 | > 9% in massa di ossigeno attivo in soluzione |
| Perossido di metilisobutilchetone | 37206-20-5 | > 9% in massa di ossigeno attivo in soluzione |
Note[modifica | modifica wikitesto]
- ^ Matthias Bohnet, Ullmann's encyclopedia of industrial chemistry, Sixth edition, 2002, ISBN 978-3-527-30673-2, OCLC 751968805. URL consultato il 24 gennaio 2023.
- ^ 1983, ISBN 9780470771730.
- ^ ch.imperial.ac.uk, https://www.ch.imperial.ac.uk/rzepa/blog/?p=10252.
- ^ A Reassessment of the Bond Dissociation Energies of Peroxides. An ab Initio Study, vol. 118, 1996, DOI:10.1021/ja961838i.
- ^ Otto Exner, 1983, pp. 85–96, DOI:10.1002/9780470771730.ch2, ISBN 9780470771730.
- ^ D. A. Casteel, Peroxy Natural Products, in Natural Product Reports, vol. 9, n. 4, 1992, pp. 289–312, DOI:10.1039/np9920900289, PMID 1522977.
- ^ Thomas Brock, Michael Groteklaes, Peter Mischke Lehrbuch der Lacktechnologie., Vincentz Network GmbH & Co KG, 2000, ISBN 3-87870-569-7 p. 67
- ^ Organische Peroxide für die Polymerisation (PDF) (archiviato dall'url originale il 29 giugno 2016).. pergan.com (in German)
- ^ Heinz G. O. Becker, Organikum organisch-chemisches Grundpraktikum, 21., neu bearb. und erw. Aufl, 2001, ISBN 978-3-527-29985-0, OCLC 52657057. URL consultato il 28 gennaio 2023.
- ^ White NJ, vol. 41, 1997, DOI:10.1128/AAC.41.7.1413, PMID 9210658, https://oadoi.org/10.1128/AAC.41.7.1413.
- ^ vol. 101, 2007, DOI:10.1016/j.trstmh.2006.03.003, PMID 16765398, http://hal.ird.fr/ird-00177064.
- ^ Detection of peroxides, hydroperoxides and peracids, in Microchimica Acta, vol. 58, 1970, pp. 119–122, DOI:10.1007/BF01218105.
- ^ The Effect of Light on the Oxidation of Fats, in Proceedings of the Royal Society B: Biological Sciences, vol. 108, 1931, pp. 175–189, DOI:10.1098/rspb.1931.0030.
- ^ Veibel, S. Analytik organischer Verbindungen, Akademie-Verlag, Berlin, 1960, p. 262
- ^ Colorimetric Determination of Organic Peroxides, in Analytical Chemistry, vol. 31, 1959, pp. 1558, DOI:10.1021/ac60153a038.
- ^ Behaviors of Several Compounds as Indicators in Lithium Aluminum Hydride Titration of Functional Groups, in Journal of the American Chemical Society, vol. 73, 1951, pp. 2676, DOI:10.1021/ja01150a073.
- ^ Potentiometric titration of hydroperoxide and peracid in Anhydrous Ethylenediamine, in Analytical Chemistry, vol. 29, 1957, pp. 79–81, DOI:10.1021/ac60121a022.
- ^ astm.org, http://www.astm.org/Standards/E298.htm.
- ^ Heinz G. O. Becker Organikum, Wiley-VCH, 2001, ISBN 3-527-29985-8 pp. 741–762
- ^ Ozonelab Peroxide compatibility.
- ^ American Chemistry Council, https://www.americanchemistry.com/industry-groups/organic-peroxide-producers-safety-division-oppsd/product-stewardship. URL consultato il 3 gennaio 2022.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su perossidi organici
Wikimedia Commons contiene immagini o altri file su perossidi organici
Collegamenti esterni[modifica | modifica wikitesto]
- Organic Peroxide Producers Safety Division.
- OSH Answers – organic peroxides.
- The Perils of Peroxides, in carolina.com, Burlington, NC, Carolina Biological Supply Company (archiviato dall'url originale il 18 dicembre 2007).
- Peroxide disposal. URL consultato il 2 febbraio 2023 (archiviato dall'url originale il 9 ottobre 2011).
- European Organic Peroxide Safety Group.
| Controllo di autorità | GND (DE) 4172773-3 |
|---|



![{\displaystyle A[\mathrm {O} ]_{\text{theoretical}}(\%)=16{\frac {p}{m}}\times 100,}](https://wikimedia.org/api/rest_v1/media/math/render/svg/176ebe20ba1c311442630b59225f66d03b08fe5f)