Neuroradiologia nelle patologie degenerative
La neuroradiologia delle patologie degenerative si avvale principalmente dell'imaging a risonanza magnetica ed, in seconda battuta quando questo non è fattibile, anche della tomografia computerizzata, che però di solito permette solo di evidenziare cause secondarie al quadro clinico come masse occupanti spazio o traumi, oltre a quantificare e localizzare l'atrofia associata al quadro morboso. Le metodiche radiologiche sono estesamente utilizzate nello studio delle demenze e dei disturbi del movimento come la sclerosi laterale amiotrofica, le sindromi extrapiramidali e quelle cerebellari[1].
Demenza di Alzheimer[modifica | modifica wikitesto]

La malattia di Alzheimer (AD) è la patologia neurodegenerativa più diffusa fra gli anziani, oltre ad essere anche la prima demenza per incidenza. La forma clinica più frequente è quella sporadica, ma sono note anche forme familiari dovute a difetti genetici nel metabolismo dell'amiloide. Alla imaging a risonanza magnetica (RM) convenzionale non esistono segni specifici di questa malattia, tuttavia la presenza di atrofia in sede ippocampale e della corteccia entorinale è considerata un marker di questa patologia, a cui si associa dilazione delle scissure silviane, dei corni temporali e delle fessure coroidee (saltuariamente in sede corticale è possibile osservare iperintensità nelle sequenze FLAIR) . Nei casi più avanzati l'atrofia cerebrale diventa diffusa.
L'atrofia ippocampale può anche essere quantificata medianti acquisizioni specifiche e sottili in RM della regione, e tali misure possono essere usate per stimare la probabilità di conversione da Mild Cognitive Impairment (MCI) a malattia conclamata. In particolare si misura l'altezza dell'ipppocampo, l'ampiezza della fessura coroidea e l'ampiezza del corno temporale (quest'ultima misura è la più attendibile). Esistono anche forme atipiche di malattia dove l'atrofia inizialmente si localizza in sedi differenti. Nell'atrofia corticale posteriore si ha atrofia in sede parietale, occipitale e del precuneo con risparmio dei lobi temporali, mentre nell'afasia logopenica l'atrofia è selettiva nell'emisfero sinistro a carico della porzione postero-superiore del lobo temporale, della giunzione temporo-parietale e della porzione inferiore del lobo parietale.
È anche possibile eseguire studi volumetrici in 3D per una quantificazione di tutto il volume cerebrale come anche di morfometria basata sui voxel (Voxel Based Morphometry o VBM), suddividendolo per singole regioni. Queste metodiche mostrano come il volume delle porzioni temporo-mesiali dei lobi temportali fisiologicamente si riduce con l'invecchiamento, tuttavia in presenza di malattia di Alzheimer questo declino è molto più rapido. Una riduzione del volume ippocampale due volte e mezzo più rapido della normalità in studi RM seriati è predittivo di malattia. Il volume del corno temporale invece incrementa di dimensioni col passare del tempo. Anche l'aumento del volume liquorale a livello della fessura ippocampale. della fessura trasversa di Bichat e di quella coroidea è predittivo di malattia. I principali limiti di questi studi sono l'alto costo, la necessità che siano eseguiti da neuroradiologi esperti per essere attendibili e l'assenza di valori di riferimento. Alla VBM si è osservato come l'area che meglio prevede la conversione da MCI a malattia comprende le regioni CA1 del subicolo.
L'uso della spettroscopia RM a livello dell'ippocampo ha evidenziato in tale sede riduzione del picco dell'NAA da perdita di neuroni associato ad incremento del mI da attivazione della glia. Gli studi hanno dimostrato come la perdita di NAA preceda nel tempo l'atrofia, tuttavia tale regione è difficilmente valutabile con le metodiche spettroscopiche sia per le esigue dimensioni sia per la vicinanza al liquor ed a regioni piene di aria. La valutazione spettroscopica del cingolo posteriore è decisamente più agevole e consente di ottenere praticamente gli stessi dati in una regione relativamente specifica per la malattia di Alzheimer, anche se un po' meno precocemente; in tale sede il rapporto NAA/Cr è stato correlato con la riduzione del numero di sinapsi e con la presenza di proteina tau fosforilata, tale rapporto non correla con la presenza di beta amiloide, cosa che invece fanno i rapporti mI/Cr e NAA/mI. La spettroscopia è utile per la diagnosi differenziale delle demenze in quanto differenti forme cliniche sono caratterizzate da alterazioni in sedi differenti. Gli sudi con sequenze pesate in diffusione mostrano nella malattia di Alzheimer incremento dei valori di ADC in sede ippocampale, e della sostanza bianca del cingolo posteriore, parietale ed occipitale. Utilizzando l'imaging al tensore di diffusione (DTI) si rilevano MD elevata ed FA bassa a livello del corpo calloso e della sostanza bianca frontale, parietale e temporale. L'anisotropia del fornice predice l'evoluzione del MCI ad AD. Di norma l'imaging di diffusione nella malattia di Alzheimer è normale a livello dei fasci di sostanza bianca sensitivi e motori. Nella forma a atrofia corticale posteriore l'imaging di diffusione mostra anomalie a livello del fascicolo longitudinale inferiore e frontoccipitale inferiore mentre nell'afasia logopenica le alterazioni coinvolgono la giunzione temporo-mesiale sinistra ed i fascicoli uncinato, longituinale inferiore e superiore.
Gli studi RM di perfusione forniscono dati simili a quelli ottenibili con la PET cerebrale con fluorodesossiglucosio (FDG) o la SPECT cerebrale perfusionale.
Gli studi di Risonanza Magnetica Funzionale (fMRI) sono di difficile esecuzione in questi pazienti poco collaboranti, tuttavia hanno evidenziato ridotta attivazione delle porzioni mediali del lobo temporale in seguito a compiti di memoria uditiva e della corteccia parietale destra in seguito a compiti di memoria visiva; a tale quadro si riscontra spesso l'attivazione di circuiti compensatori. Di solito gli studi fMRI in questi pazienti sono condotti in condizioni di riposo con l'intento di visualizzare l'attività del default network o "resting state". Il network di default comprende l'attivazione sincrona della corteccia del cingolo posteriore ed anteriore, dell'ippocampo e della corteccia parietale ed è alterato nei pazienti affetti da AD, con evidenza di connettività ridotta ed a volte di attivazioni compensatorie[2].
Demenza frontotemporale[modifica | modifica wikitesto]
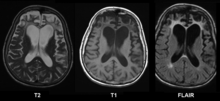
Colpisce soggetti di solito più giovani di 60 anni, è la seconda demenza idiopatica per incidenza ed è caratterizzata da interessamento spesso asimmetrico primariamente della corteccia frontale e temporale. Le forme cliniche più frequenti sono la demenza frontotemporale propriamente detta (anche detta variante frontale), la demenza semantica e l'afasia progressiva non fluente. Nella maggior parte dei casi tali patologie non hanno carattere familiare.
Alla RM è ben visibile l'atrofia asimmetrica causata dalla patologia nelle sedi già descritte. Nella demenza semantica interessa soprattutto la corteccia temporale anteriore, mentre nell'afasia non fluente interessa l'insula e la corteccia frontale di sinistra (specie opercolo e giro frontale inferiore). Le aree atrofiche possono inoltre mostrarsi iperintense nelle sequenze a tempo di eco lungo, cosa che aiuta nella diagnosi differenziale con l'AD. Tipicamente sono risparmiate le aree motorie e sensitive (giri pre e post centrali), la porte posteriore del giro temporale superiore, i lobi parietali e occipitali, il giro di Heschl ed il piano temporale. Anche la sostanza bianca dei lobi frontali è spesso coinvolta, con brusca interruzione a livello del centro semiovale al di sotto della corteccia motoria. Negli stadi avanzati viene coinvolta anche la sostanza bianca dei lobi parietali, ma le radiazioni ottiche sono sempre risparmiate attorno al margine laterale del trigono ventricolare. Gli studi di spettroscopia mostrano a livello delle aree colpite riduzione dell'NAA, aumento del mI, riduzione del picco glu-glm e presenza del picco del lattato. La concentrazione di NAA in sede frontale è il miglior marker per distinguere la demenza frontotemporale dall'AD[3].
Demenza a corpi di Lewy[modifica | modifica wikitesto]
Comprende il 15% delle demenze ad esordio pre senile. La diagnostica per immagini di questa patologia è primariamente di competenza medico-nucleare mediante la PET cerebrale e le tecniche di neuroimaging del sistema dopaminergico, tuttavia la RM può aiutare nella diagnosi differenziale con altre patologie e demenze (specie quella vascolare) ma di per sé non mostra segni tipici per questa malattia (a volte mostra atrofia in sede frontale, occipitale ed insulare). Le tecniche di Voxel Based Morphometry hanno evidenziato in questi pazienti atrofia del tegmento pontino e mesencefalico, della sostanza grigia attorno al terzo ventricolo e della sostanza innominata. Le sequenze pesate in diffusione mostrano inoltre diffusa riduzione della FA a carico della sostanza bianca, con minor interessamento dei lobi temporali[4].
Demenza vascolare[modifica | modifica wikitesto]


La malattia cerebrovascolare rappresenta la seconda causa più frequente di demenza nei soggetti anziani. La demenza vascolare può essere sottesa a diverse cause e quindi presentarsi in maniera differente sia alla clinica che all'imaging. In tutti i casi la malattia ha esordio, evoluzione e coinvolgimento all'imaging molto eterogeneo (la progressione clinica è spesso "a scalini" con peggioramenti imprtovvisi per successiva comparsa di nuovi eventi ischemici) e la RM è l'indagine più indicata sia nella diagnosi (anche differenziale) sia nel follow-up delle terapie. È possibile classificare le demenze vascolari nella modalità sottoindicata:
- demenza multinfartuale, causata da numerosi infarti estesi dati dall'occlusione di grossi vasi
- demenza da infarto "strategico" in cui una anche piccola lesione ischemica ha colpito una regione chiave nel causare il quadro clinico come il giro angolare, l'ippocampo, il ginocchio della capsula interna, la porzione anteromediale del talamo il lobo frontale o il caudato
- demenza da malattia dei piccoli vasi causata da numerose piccole lesioni ischemiche diffuse di origine microvascolare
- demenza da ipoperfusione causata da una brusca interruzione del flusso ematico data da un arresto cardiaco
- demenza post-emorragica in seguito ad emorragie intracraniche
- demenza da altri meccanismi non noti o da combinazione dei precedenti
La demenza da malattia dei piccoli vasi si manifesta alla RM come plurime minuscole aree iperintense visibili nelle sequenze a TE lungo e da ascrivere ad aree di gliosi riparativa su microinfarti. Tali regioni più spesso coinvolgono la sostanza bianca, i nuclei della base, i talami, il tronco encefalico ed il nucleo dentato. È possibile differenziare le lacune vascolari dagli spazi perivascolari è possibile usare le sequenze FLAIR e DP che mostrano iperintensità nelle aree lacunari, mentre gli spazi perivascolari hanno lo stesso segnale del liquor. Le lacune inoltre più spesso si rilevano estese fra i putamen ed i talami ed hanno forma irregolare, mentre gli spazi perivascolari di solito sono confinati ai due terzi inferiori dei putamen, di forma regolare e dimensioni inferiori ai 5 mm. L'atrofia diffusa in questi casi spesso è presente.
Le alterazioni della sostanza bianca visibili nelle sequenze DP e T2 pesate si riscontrano sia nell'invecchiamento fisiologico sia nelle demenze vascolari, mentre le iperintensità periventricolari sono presenti in tutti i soggetti anche non dementi oltre una certa età e possono avere morfologia "a cappuccio" se localizzate in periferia vicino ai corni frontali (da trasudazione locale di liquor) o ad "alone" (o "nastriformi") disposte attorno ai ventricoli e dovute ad accumulo di acqua interstiziale. Le iperintensità profonde localizzate nei centri semiovali sono invece di natura ischemica. Nella malattia di Binswanger le alterazioni della sostanza bianca profonda appaiono simmetriche, diffuse ed a chiazze confluenti e sono associate ad atrofia corticale ed a piccoli infarti lacunari a livello dei nuclei della base.
La CADASIL (Cerebral Autosomal Dominant Arteriopathy with Subcortical Infarct and Leukoencephalopathy, ovvero Arteriopatia Autosomica Dominante con Infarti Sottocorticali e Leucoencefalopatia) è una particolare forma di demenza vascolare causata da mutazioni del gene Notch 3. La malattia oltre al cervello colpisce anche cute , nervi periferici e muscoli ed in RM cerebrale mostra alterazioni ischemiche già in età giovanile associate a demenza precoce, che interessano in maniera molto più estesa delle altre forme la sostanza bianca sottocorticale e le capsule esterne a livello dei poli temporali e frontali (questi segni radiologici sono caratteristici di questa patologia)[5].
Idrocefalo normoteso[modifica | modifica wikitesto]

È una sindrome poco frequente nell'adulto di età maggiore di 65 anni ed è causata da ripetuti insulti ischemici associati ad alterazioni del riassorbimento del liquor a livello dell granulazioni di Pacchioni (una più rara variante è dovuta a megadolicobasilare, in tal caso l'apice ectasico dell'arteria basilare ad ogni onda sfigmica comprime il terzo ventricolo causando un effetto pompa inverso al flusso fisiologico in direzione cranio-caudale che riduce il flusso del liquor nelle regioni inferiori del corpo e provoca reflusso dello stesso nei ventricoli laterali). La diagnosi tempestiva, basata sulla triade demenza + incontinenza urinaria + disturbi dell'andatura deve essere il più precoce possibile in quanto il decorso della malattia può essere fermato mediante un intervento chirurgico di derivazione liquorale.
Alla RM la malattia si evidenzia con vistosa dilatazione dei ventricoli laterali non associata ad allargamento dei solchi cerebrali e predominante in sede frontale (anche se casi associati ad atrofia corticale sono possibili). È inoltre possibile osservare negli studi RM di flusso un artefatto tipico a livello dell'acquedotto di Silvio chiamato flow-void dovuto a flusso nettamente incrementato del liquor a tale livello dovuto alla rigidità eccessiva del tessuto cerebrale che trasmette nei ventricoli la forza dell'onda sfigmica. È anche possibile osservare alterazioni del segnale nelle sequenze a TR lungo in sede periventricolare dovuta all'accelerato flusso in tale sede nei pressi della sostanza bianca. Anche se poco utilizzato è possibile eseguire la scansione RM abbinata al gating cardiaco per valutare meglio l'inversione del flusso di liquor sincronizzato col polso a livello dell'acquedotto di Silvio; secondo alcuni Autori la stima di questo parametro potrebbe essere utilizzata per dare indicazione all'intervento di derivazione liquorale, che non è esente da rischi e che quindi di solito è indicato solo se ripetute rimozioni di liquor mediante puntura lombare danno beneficio al paziente[6].
Malattia di Creutzfeldt-Jakob[modifica | modifica wikitesto]
Sclerosi Laterale Amiotrofica[modifica | modifica wikitesto]

La Sclerosi Laterale Amiotrofica (SLA) è una malattia caratterizzata da morte del primo e del secondo motoneurone. La maggior parte dei casi la malattia è sporadica, ma sono descritte in letteratura anche forme familiari dovute a mutazioni del gene superossido dismutasi 1 (SOD1). La patogenesi è probabilmente eccitotossica dovuta all'eccessivo rilascio sinaptico di glutammato (l'unico farmaco attualmente disponibile come terapia per questa sindrome, il riluzolo, agisce inibendo questo meccanismo).
La diagnosi di SLA è clinica, tuttavia la RM può essere di aiuto nella diagnosi differenziale con altre patologie. Un segno RM patognomonico ma non sempre presente è l'iperintensità nelle sequenze T2 pesate e FLAIR del fascicolo cortico-spinale associata a contemporanea ipointensità a livello del giro precentrale dovuta ad accumulo di ferro in tale sede, più evidente con le sequenze GRE T2* pesate. Utilizzando sequenze T1 pesate è possibile più spesso rinvenire iperintensità a carico delle colonne midollari antero-laterali causata da accumulo di metalli e lipidi nelle sedi dei motoneuroni distrutti. Le acquisizioni T1 pesate possono essere anche impiegate per valutare lo spessore corticale delle aree motorie utilizzando la VBM. Le sequenze pesate in diffusione di solito mostrano aumentata diffusività e ridotta FA a livello dei fasci cortico-spinali, mentre gli studi col tensore di diffusione (DTI) mostrano assottigliamento del fascio stesso nei casi più gravi (con sensibilità intorno al 65-70%). Altre aree con ridotta FA includono il tronco, il corpo calloso e le regioni fronto-temporali. In spettroscopia reperti specifici per SLA si possono ricavare a livello del giro precentrale ove è possibile osservare riduzione dell'NAA e del rapporto NAA/Cr ed incremento del rapporto mI/NAA[7].
Corea di Huntington[modifica | modifica wikitesto]

È una malattia genetica autosomica dominante caratterizzata da movimenti coreici e disturbi cognitivi che evolvono verso alla demenza fino all'exitus del paziente. Alla RM si caratterizza per la tipica atrofia del nucleo caudato con associata sua ridotta impronta sul ventricolo laterale adiacente e quindi ampliamento del corno frontale (tale reperto è ben evidente nelle sezioni coronali). La forma clinica rigida ed in alcuni casi la forma ipercinetica si associano a lieve iperintensità nelle sequenze T2 pesate degli striati. A volte i nuclei della base possono in toto presentare iperintensità nelle sequenze T2 pesate per deposito nel loro contesto di ferro o altre sostanze paramagnetiche. L'atrofia nelle fasi più avanzate interessa anche gli emisferi cerebrali in toto, con marcata associata riduzione della sostanza bianca. Maggior coinvolgimento corticale si osserva a livello delle insule, della corteccia frontale basale ed opercolare, del lobulo paracentrale destro ed attorno al solco infraparietale; altre aree coinvolte sono il tetto del mesencefalo e l'ipotalamo. La Voxel Based Morphometry consente di caratterizzare al meglio queste perdite di volume ed anche di correlarle con il numero di triplette CAG presenti nel gene dell'Huntingtina. Uno studio fatto utilizzando le sequenze pesate in diffusione ha mostrato anomalie a carico del corpo calloso, della sostanza bianca sottocorticale frontale e della capsula interna, gli studi di perfusione hanno mostrato flusso ridotto a livello dei gangli della base mentre la spettroscopia ha mostrato ridotto NAA omosede; gli studi fMRI hanno mostrato minor attivazione dei nuclei della base[8].
Sindrome di Hallervorden-Spatz[modifica | modifica wikitesto]
Malattia di Parkinson[modifica | modifica wikitesto]
La malattia di Parkinson è la seconda malattia neurodegenerativa per incidenza nell'anziano dopo la malattia di Alzheimer. Si manifesta tipicamente con sintomi extrapiramidali (tremore, rigidità, bradicinesia, instabilità posturale) e risponde ai farmaci dopaminoagonisti (primo fra tutti la levodopa). La diagnosi è clinica, tuttavia l'imaging può essere d'aiuto nel discriminare con altre malattie con presentazione simile.
Il principale contributo alla diagnosi mediante imaging viene dato per questa malattia dalla medicina nucleare impiegando traccianti specifici per il sistema dopaminergico come lo 123I-FP-CIT o la 18F-DOPA e la PET cerebrale con FDG, tuttavia la RM, seppur non evidenziando segni specifici, può essere utile nella diagnosi differenziale, oltre a mostrare assottigliamento della pars compacta della sostanza nera mediante sequenze T2 pesate o sequenze IR fortemente T1 dipendenti con sottrazione del segnale della sostanza grigia e bianca. Sequenze T2* pesate possono anche evidenziare depositi di ferro in tale sede nei soggetti malati. Gli studi fatti col tensore di diffusione (DTI) mostrano riduzione della FA a carico dei fasci nigro-striatali. Nei soggetti giovani la RM permette di stimare l'atrofia corticale indotta dalla patologia, inoltre le caratteristiche del segnale a livello della sostanza bianca sembrano correlare con la clinica. La spettroscopia eseguita usando VOI posizionate sui peduncoli cerebrali mostra riduzione dei rapporti NAA/Cr, NAA/Cho ed NAA/(Cho+Cr) nei pazienti malati nel lato controlaterale a quello colpito dalla malattia se la malattia è monolaterale. L'uso di RM e TC insieme è fondamentale per la pianificazione dell'approccio chirurgico nei pazienti più gravi[9].
Paralisi sopranucleare progressiva[modifica | modifica wikitesto]

La Paralisi Sopranucleare Progressiva (PSP) si manifesta intorno ai 40 anni con paralisi dello sguardo nei movimenti di verticalità, parkinsonismo, instabilità posturale e più tardi demenza senza risposta alla levodopa. Alla RM il segno tipico è l'atrofia del mesencefalo che correla con la gravità della patologia. I margini laterali del tetto mesencefalico tipicamente mostrano un'abnorme concavità sul piano assiale (morning glory sign) Nelle proiezioni sagittali l'assottigliamento del tetto mesencefalico lo rende leggermente convesso superiormente mostrando il profilo geometrico patognomonico di questa patologia a livello del terzo ventricolo, che al confronto con il ponte di dimensioni normali produce il tipico segno del pinguino o del colibrì. Altro segno riconoscibile è l'ampliamento del terzo ventricolo. Nella PSP il diametro del mesencefalo varia dagli 11 ai 15 mm contro i 17-20 dei soggetti sani; nei pazienti affetti da parkinson sono possibili variazioni fra i 14 ed i 19 mm. In alcuni pazienti le sequenze a TR lungo mostrano segnale iperintenso in sede periacqueduttale da gliosi (questo è un altro segno patognomonico di questa patologia), oltre a modesta atrofia del nucleo lenticolare associata a lieve iperintensità del globo pallido nelle sequenze T2 pesate[10].
L'indice MR parkinsonism index si calcola facendo il rapporto fra l'area del ponte e quella del mesencefalo e mostra valori più bassi nella PSP rispetto ad altre patologie extrapiramidali come il parkinson e la degenerazione cortico-basale. Le sequenze pesate in diffusione mostrano valori di ADC incrementati a livello del putamen nella PSP, tale reperto è utile nella diagnosi differenziale col morbo di Parkinson.
Degenerazione corticobasale[modifica | modifica wikitesto]

La Degenerazione CorticoBasale (DCB) Si presenta come un parkinsonismo non responsivo alla levodopa asociata ad almeno uno dei seguenti sintomi, di norma asimmetrici: deficit sensoriali corticali, aprassia ideomotoria, Sindrome della mano aliena, mioclono e disturbi del cammino. In un terzo dei casi evolve in demenza. La malattia non da alterazioni del segnale RM, tuttavia è possibile mediante l'imaging dimostrare l'atrofia tipicamente monolaterale interessante sia la sostanza bianca sia la grigia a livello delle regioni frontali posteriori e parietali, con risparmio dei lobi temporali ed occipitali. Sono colpiti anche la testa del caudato ed il talamo. Tale malattia tuttavia non è sempre di facile distinzione tramite RM da altre malattie neurodegenerative[11].
Atrofia multisistemica[modifica | modifica wikitesto]


L'atrofia multisistemica (MSA) si differenzia in 3 forme cliniche ed è caratterizzata da parkinsonismo associato a degenerazione di altri sistemi. Si riconoscono la MSA-parkinsonismo, la sindrome di Shy-Dragher (MSA-disautonomia) la MSA-cerebellare (degenerazione olivopontocerebellare). Tali patologie sono spesso associate ad altre sindromi. Per fare diagnosi di MSA sono necessari 4 criteri: parkinsonismo, disturbi cerebellari, disturbi spinocerebellari e alterazioni urinarie/autonomiche.
La MSA-parkinsonismo può essere facilmente confusa con il morbo di Parkinson, specie nelle fasi iniziali. Alla RM si manifesta come atrofia dei gangli della base, con il nucleo caudato meno colpito rispetto al putamen. Utilizzando apparecchi ad alto campo è possibile evidenziare a carico del putamen ipointensità nelle sequenze T2 e T2* pesate, a volte associato ad un orletto iperintenso attorno al nucleo, questo segno è tipico dell'MSA-parkinsonismo, mentre l'iperintensità in T2 e T2* a carico della sostanza nera (e "fusione" della pars reticulata con il nucleo rosso) è in comune con il morbo di Parkinson. L'ampiezza del peduncolo cerebellare medio è di norma inferiore nei pazienti con MSA-parkinsonismo rispetto a quelli con PSP. In questa patologia le sequenze pesate in diffusione mostrano incremento della diffusività a livello dei putamen e dei peduncoli cerebellari medi, mentre la spettroscopia evidenzia riduzione del rapporto NAA/Cr nella stessa sede.
Nella Sindrome di Shy-Dragher il quadro è simile al precedente (a volte è presente segnale ipointenso in sede striatale ed atrofia a livello del fascio spinale intermedio-laterale), tuttavia nella sindrome disautonomica isolata la RM è normale.
Nella MSA-cerebellare la RM evidenzia atrofia, gliosi e demielinizzazione a livello dei nuclei del ponte e della corteccia cerebellare, con relativo risparmio del verme. Anche le olive bulbari sono interessate tramite il peduncolo cerebellare inferiore. La degenerazione delle fibre del ponte si evidenzia alle sequenze a TR lungo con il tipico aspetto "a croce",e si estende alle altre strutture già citate. La spettroscopia evidenzia riduzione di NAA, Cho e dei rapporti NAA/Cr e Cho/Cr a livello del cervelletto e del ponte (il rapporto NAA/Cr correla con la clinica). A tale quadro si associano alterazioni dei putamen, della sostanza nera e dei globi pallidi[12].
Parkinsonismi secondari[modifica | modifica wikitesto]
I parkinsonismi causati da lesioni ischemiche che coinvolgono i nuclei della base, i centri semiovali o la corteccia frontale possono essere diagnosticati osservando tali lesioni nelle sedi descritte. Anche lesioni neoplastiche che interessano i nuclei della base, il tronco encefalico e la corteccia motoria possono essere rilevate mediante la RM, così come eventuali conseguenze di traumi e l'idrocefalo. L'intossicazione da alcune sostanze chimiche come i neurolettici, il metanolo, il monossido di carbonio ed il manganese possono essere causa di parkinsonismo insieme alla mielinosi osmotica (per approfondimenti a riguardo si rimanda alla relativa voce)[13].
Atrofia corticale cerebellare[modifica | modifica wikitesto]
È dovuta ad una degenerazione della corteccia cerebellare a livello della porzione superiore del verme, associata ad atrofia anche delle porzioni laterali degli emisferi cerebellari, visibile in RM col tipico segno "a bocca di pesce", in questa sindrome i volumi di ponte e midollo sono conservati[14].
Atassia spinocerebellare[modifica | modifica wikitesto]
Le Atassie SpinoCerebellari (SCA) costituiscono un gruppo di 28 patologie ereditarie a trasmissione autosomica dominante, ognuna causata da una differente mutazione che porta a degenerazione in sede cerebellare. Queste malattie sinteticamente si possono presentare con 3 differenti pattern di atrofia: cerebellare pura, olivopontocerebellare (simile alla MSA) e diffusa cerebrale e cerebellare. La Voxel Based Morphometry in questi casi è particolarmente utile per la diagnosi se associata alle analisi genetiche. nelle SCA 1 e 3 si rileva atrofia del verme superiore e dei lobi cerebellari anteriori, nella SCA 2 il verme superiore è risparmiato, nella SCA 6 sono coinvolti i lobi cerebellari ed il verme. I peduncoli cerebellari medi sono colpiti nelle SCA 1, 2 e 3, ma non nelle SCA 6 e 17. Nella SCA 3 il coinvolgimento midollare correla con la gravità della malattia, ma non nella SCA 6. La SCA 1 non da alterazioni in sede sovratentoriale, cosa che invece fanno le SCA 2, 3 e 17. Nella SCA 3 il segnale è inoltre alterato a livello delle fibre pontine trasverse ed è presente atrofia dei peduncoli cerebellari superiori, della regione frontotemporale e dei globi pallidi[15].
Malattia di Friedreich[modifica | modifica wikitesto]
È causata da una mutazione genetica a carico del cromosoma 9 (a livello del gene della fratassina, proteina coinvolta nel metabolismo del ferro) ed è la più frequente fra le atassie ereditarie. Tipicamente colpisce i neuroni a T midollari con conseguente danno ascendente a livello del SNC. In tali casi la RM evidenzia atrofia del midollo cervicale e del verme cerebellare superiore, con conservato profilo nelle sezioni sagittali che consente di fare diagnosi differenziale con la degenerazione olivopontocerebellare. A livello cerebellare si evidenzia riduzione del rapporto NAA/Cr prima delle alterazioni morfologiche[16].
Malattie degenerative cerebellari acquisite[modifica | modifica wikitesto]
Possono essere causate da ogni meccanismo che danneggia la corteccia cerebellare fra cui sostanze tossiche, alcool, farmaci o da una sindrome paraneoplastica. In RM si evidenzia sempre atrofia cerebellare con relativo risparmio del verme e vie pontocerebellari intatte[16].
Note[modifica | modifica wikitesto]
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 261.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 262-269.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 269-272.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 269.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 272-277.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 277-278.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 281-284.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 284-286.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 287-288.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 288-289.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 289-290.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 290-292.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 292-293.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 294-295.
- ^ Manuale di Neuroradiologia, Poletto Editore, p. 295-296.
- ^ a b Manuale di Neuroradiologia, Poletto Editore, p. 296.
Bibliografia[modifica | modifica wikitesto]
- Massimo Gallucci, Cosma Andreula, Sossio Cirillo e Tommaso Scarabino, Manuale di Neuroradiologia, Poletto Editore, 2016, ISBN 978-88-95033-61-7.