Carbonile
| Nome | Struttura | Formula |
| Aldeidi | 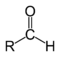
|
RCHO |
| Chetoni | 
|
RCOR' |
| Acidi carbossilici | RCOOH | |
| Esteri | RCOOR' | |
| Tioesteri | RSCOR | |
| Ammidi | 
|
RCONH2 |
| Alogenuri acilici | 
|
RCOX |
| Enoni | RCOC(R')=CR"R"' | |
| Anidridi | RCOOOCR' |
In chimica organica un carbonile o gruppo carbonilico è un gruppo funzionale bivalente costituito da un atomo di carbonio e uno di ossigeno legati da un doppio legame: >C=O.[1] Il corrispondente gruppo monovalente -CO−R, che da esso deriva per aggiunta di un gruppo R (R = H, alchile o arile), è detto genericamente "acile" o "gruppo acilico",[2] in quanto esso è ciò che resta di un acido carbossilico togliendo l'ossidrile, anche se in realtà il termine acile si applica a qualsiasi ossiacido ricavandone la struttura allo stesso modo.[3]
Il carbonile è un gruppo di fondamentale importanza in chimica organica perché è presente in svariate classi di composti e perché costituisce un modello al quale si possono ricondurre proprietà e reattività di altri gruppi funzionali formati da eteroatomi legati al carbonio con legame multiplo.[4]
Questo gruppo funzionale è presente come tale in aldeidi e chetoni e ne caratterizza proprietà e reattività; esso è anche presente, però come parte di altri gruppi funzionali, in diverse altre classi di composti organici: acidi carbossilici, esteri, tioesteri, alogenuri acilici, anidridi carbossiliche, ammidi, etc.[5][6] In questi ultimi al carbonile è unito in ogni caso a un atomo più elettronegativo del carbonio che inoltre porta su di sé una coppia elettronica libera che può interagire significativamente (o meno) con il carbonile stesso tramite effetto induttivo -I ed effetto mesomero +M, il cui effetto complessivo sulla reattività viene valutato caso per caso.[7]
Gruppi affini al carbonile con eteroatomo diverso da O sono: >C=S (tiocarbonile, generalmente poco stabile), >C=N- (gruppo imminico, nelle immine, enammine, cationi imminio, idrazoni, ossime), -C≡N (gruppo ciano, nei nitrili e fulminati).
Struttura elettronica e proprietà del gruppo[modifica | modifica wikitesto]
Nei composti carbonilici l'atomo di carbonio, oltre ai due legami σ con i due gruppi uniti al carbonile, forma un altro legame σ con l'ossigeno, in totale tre legami σ; non avendo coppie solitarie, il suo schema di ibridazione è di tipo sp2. Altrettanto per l'ossigeno, che forma un legame σ e che ha due coppie solitarie.[8] Ne consegue che il carbonio carbonilico viene a trovarsi in un ambiente tendenzialmente planare, salvo perticolari ingomri sterici dei gruppi, e con angoli di legame idealmente di 120°. Il carbonio e l'ossigeno, oltre che dal legame σ, sono inoltre legati da un legame π, derivante dalla sovrapposizione di un orbitale p di C con un orbitale p di O, in modo da completare la tetravalenza di C e la bivalenza di O.[9] L'ossigeno ha inoltre due coppie solitarie che occupano i due orbitali sp2 rimanenti su di esso, sulle quali può ricevere legami idrogeno.
Data la significativa differenza di elettronegatività tra C e O (Δχ ~ 0,9) il gruppo carbonilico è spiccatamente polare, con l'atomo di ossigeno che porta una parziale carica negativa e quello di carbonio una parziale carica positiva: >Cδ+=Oδ−.[10]
Meccanismi basilari[modifica | modifica wikitesto]
In tutti i composti contenenti questo gruppo è presente la caratteristica risonanza ionico-covalente tra le due seguenti forme limite:[10]
>C=O ↔ >C+−O−
dove la seconda forma limite ha peso minore nell'ibrido di risonanza dato che presenta una separazione di carica, sebbene di tipo favorevole,[11] ma comunque tende ad indebolire il legame π e di conseguenza favorire l'ddizione del nucleofilo su C. Questo aspetto contribuisce a spiegare la differenza di reattività verso i nucleofili tra un chetone da una parte (>C=O, che addiziona facilmente lo ione cianuro a dare cianidrine), e un chetale [>C(−OR)2] dall'altra (che con esso non reagisce), nonostante che la carica positiva parziale su C sia simile in entrambi i casi.[12]
Il carbonio è quindi suscettibile ad attacchi da parte di basi di Lewis o di nucleofili a seguito dei quali il legame π viene rotto, con la cessione della coppia elettronica del legame π all'ossigeno:
Nu− + R2C=O → NuR2C−O−
In tali casi la direzione di approccio del nucleofilo al carbonio carbonilico è esterna al piano del carbonile e tende ad avvenire seguendo l'angolo di Bürgi-Dunitz[13] e in generale da entrambi i lati di tale piano e questo può avere conseguenze sulla stereochimica.[14]
D'altra parte, l'atomo di ossigeno, per la sua parziale carica negativa e la presenza su di esso di coppie solitarie, è soggetto ad essere attaccato da acidi di Lewis o elettrofili ed anche ad essere protonato da acidi di Brønsted:[15][16]
R2C=O + H+ ⇄ [ R2C=O+−H ↔ R2C+−O−H ]
Qui, nel carbonile protonato, la seconda forma limite è quella che ha più peso nell'ibrido, poiché la carica formale positiva sta sull'atomo meno elettronegativo e questo accentua il carattere carbocationico ed elettrofilo del carbonio, che quindi reagirà più facilmente con un nucleofilo debole con il quale non avrebbe reagito senza protonazione:[17]
Nu− + R2C+−O−H → NuR2C−O−H
La protonazione del carbonile che permette un aumento dell'elettrofilia di un'aldeide o di un chetone è l'aspetto che sta alla base dell'uso della catalisi acida nelle reazioni di addizione nucleofila ai composti carbonilici.[18]
Il carbonile influenza il comportamento chimico di eventuali atomi di idrogeno in posizione alfa (H−Cα−C=O), rendendoli debolmente acidi e quindi facilmente attaccabili dalle basi in quanto dalla loro rimozione come H+ si genera un carbanione stabilizzato per risonanza, lo ione enolato:[19]
B− + H−C−C=O ⇄ BH + [ −C−C=O ↔ C=C−O− ]
In quanto carbanione, l'enolato è un ottimo nucleofilo e può attaccare altri carbonili formando così legami C−C, un'operazione importante in chimica organica sfruttata in una varietà di reazioni di condensazione: condensazione aldolica, di Knoevenagel, di Claisen, di Dieckmann, di Doebner, di Perkin, di Stobbe, di Thorpe, di Darzens, ed altre.[20]
Il gruppo carbonilico è presente in molte classi di composti organici, come evidenziato dalla tabella in alto. Data la sua alta reattività, esso è un gruppo funzionale fondamentale in chimica organica: può infatti essere utilizzato come punto di attacco per allungare o spezzare catene di atomi. L'applicazione più notevole si trova nelle proteine, lunghe catene dotate regolarmente di legami peptidici nei quali è contenuto il carbonile: molti enzimi agiscono proprio sul legame carbonile per spezzarlo e dividere le proteine in segmenti.
Reattività dei composti carbonilici con nucleofili[modifica | modifica wikitesto]
L'effetto del sostituente sul carbonio carbonilico è determinante per la reattività dei composti che contengono questo gruppo. Un sostituente elettron attrattore (che ha una elettronegatività maggiore del carbonio), tenderà ad aumentare la carica parziale positiva del carbonio. In pratica questo sostituente avrà un effetto -I e renderà il carbonio carbonilico più suscettibile all'attacco nucleofilo. I più reattivi sono quindi i cloruri acilici, e a seguire le anidridi. Questi di norma reagiscono senza bisogno di catalisi.
Nel caso delle aldeidi e dei chetoni dove i sostituenti hanno la stessa elettronegatività del carbonio carbonilico, l'effetto sarà diverso. L'ossigeno carbonilico attira la nuvola elettronica di legame col carbonio (essendo più elettronegativo del carbonio). Questo carbonio, però, ha dei sostituenti (gli altri carboni), che in qualche modo riescono a rifornire il carbonio carbonilico di una nuvola elettronica che gli permette di non essere così parzialmente positivo come il carbonio dei cloruri acilici. Anche se parzialmente positivo rimane comunque. Quindi aldeidi e chetoni reagiscono abbastanza agevolmente con nucleofili forti, mentre con nucleofili deboli hanno bisogno di un catalizzatore acido.
Se come sostituente è presente un atomo in grado di sostenere delle strutture di risonanza (è il caso di esteri e ammidi), questa struttura di risonanza stabilizza il carbonio carbonilico, che diventa quindi meno elettrofilo. Esteri e ammidi, per reagire con sostituzione nucleofila acilica, infatti, devono essere aiutati da un catalizzatore acido.
Infine gli acidi carbossilici reagiscono solo con un catalizzatore acido, perché con catalizzatore basico si forma il sale (il quale non può reagire con nucleofili sul carbonio carbossilico).
Proprietà fisiche e solubilità in acqua dei composti carbonilici[modifica | modifica wikitesto]
La polarizzazione presente nel legame C=O influenza anche le proprietà fisiche dei composti carbonilici, come per esempio il punto di ebollizione. Infatti in questo tipo di molecole i legami permanentemente polarizzati aumentano la tendenza delle molecole ad associarsi (interazioni dipolo-dipolo), che in chetoni e aldeidi causano temperature di ebollizione più alte degli idrocarburi con stesso peso molecolare ma più basse di quelle degli alcoli corrispondenti (poiché le interazioni dipolo-dipolo sono più deboli dei legami idrogeno).
La polarità del carbonile influenza anche la solubilità dei composti carbonilici: quelli con basso peso molecolare sono solubili in acqua perché, seppur non in grado di formare legami idrogeno tra di loro, tendono a formare legami idrogeno con altri tipi di composti aventi gruppi O-H o N-H.
Composti carbonilici α,β-insaturi[modifica | modifica wikitesto]
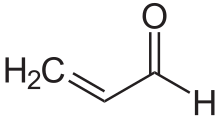
I composti carbonilici α,β-insaturi sono una classe importante di composti con struttura generale (O=CR)−Cα=Cβ-R; per esempio gli enoni e gli enali. Questi composti, nei quali il gruppo carbonile è coniugato con un alchene (quindi l'aggettivo insaturo), hanno particolari proprietà. Diversamente dal caso dei carbonilici semplici, i composti carbonilici α,β-insaturi sono spesso attaccati dai nucleofili al carbonio β. Questo schema di reattività viene detto vinilogia (da 'analogia vinilica').[21] Esempi di composti carbonilici α,β-insaturi sono l'acroleina (propenale), il metil vinil chetone, l'ossido di mesitile,[22] l'acido acrilico, e l'acido maleico. Tali composti si possono preparare in laboratorio tramite la reazione aldolica e la reazione di Perkin.
Il gruppo carbonile, essendo un gruppo ad effetto mesomero -M, richiama a sé densità elettronica dall'alchene, il quale risulta, quindi, disattivato verso un elettrofilo, come bromo molecolare o acido cloridrico. Come regola generale con elettrofili asimmetrici, l'idrogeno si attacca alla posizione α in un'addizione elettrofila. D'altra parte, questi composti sono attivati verso nucleofili in un'addizione nucleofila coniugata.
Poiché i composti carbonilici α,β-insaturi sono elettrofili, molti di essi sono tossici, mutagenici e carcinogenici. Il DNA può attaccare il carbonio β e quindi essere alchilato. Tuttavia, il composto spazzino endogeno glutatione protegge naturalmente dagli elettrofili tossici nel corpo. Alcuni farmaci (amifostina, N-acetilcisteina) contenenti gruppi tiolici possono proteggere le biomolecole da tale alchilazione dannosa.
Chimica inorganica[modifica | modifica wikitesto]
In chimica inorganica il termine carbonile è usato per indicare la molecola di monossido di carbonio (C≡O) quando funge da legante nei complessi metallici. Nei metallocarbonili, la molecola di CO non può essere considerata soltanto come una base di Lewis in quanto, oltre a cedere un doppietto elettronico, questa riceve un doppietto elettronico dalla retrodonazione π del metallo. Questo avviene in quanto la molecola CO ha orbitali antileganti vuoti di opportuna simmetria (t2g) e di energia non elevata, capaci di combinarsi con gli orbitali d pieni del metallo, anch'essi di simmetria t2g, per dare origine a un legame d-p π con l'atomo metallico (retrodonazione).[23] La retrodonazione ha come effetto la stabilizzazione del complesso dovuta a una maggiore separazione fra gli orbitali di non legame e di antilegame dell'atomo metallico.
Note[modifica | modifica wikitesto]
- ^ The International Union of Pure and Applied Chemistry (IUPAC), IUPAC - carbonyl compounds (C00844), su goldbook.iupac.org. URL consultato il 1º aprile 2024.
- ^ Illustrated Glossary of Organic Chemistry - Acyl group, su chem.ucla.edu. URL consultato il 31 marzo 2024.
- ^ The International Union of Pure and Applied Chemistry (IUPAC), IUPAC - acyl groups (A00123), su goldbook.iupac.org. URL consultato il 31 marzo 2024.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, p. 441.«Il gruppo carbonile costituisce la chiave di volta della chimica organica.»
- ^ (EN) The Carbonyl Group: Vol. 1 (1966), John Wiley & Sons, Ltd., 1º gennaio 1966, DOI:10.1002/9780470771051, ISBN 978-0-470-77105-1. URL consultato il 31 marzo 2024.
- ^ (EN) Jacob Zabicky (a cura di), The Carbonyl Group: Vol. 2 (1970), John Wiley & Sons, Ltd., 1º gennaio 1970, DOI:10.1002/9780470771228, ISBN 978-0-470-77122-8. URL consultato il 30 marzo 2024.
- ^ (EN) Ashutosh Kar, Advanced Organic Chemistry (Structure & Mechanisms), 1ª ed., Scientific International Publishers & Distributors, 2017, pp. 136-139, ISBN 978-93-87025-20-2.
- ^ William Henry Brown, Brent L. Iverson e Eric V. Anslyn, Organic chemistry, Eighth edition, Cengage Learning, 2018, p. 653, ISBN 978-1-305-58035-0.
- ^ Francis A. Carey, Organic Chemistry, 5ª ed., McGraw-Hill, 2004, pp. p.706, ISBN 0-07-252170-8.
- ^ a b Eric V. Anslyn e Dennis A. Dougherty, Modern physical organic chemistry, University science, 2006, pp. 42-43, ISBN 978-1-891389-31-3.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 156-157.
- ^ Chapter 6: pp. 27 and 28, su healy.create.stedwards.edu. URL consultato il 31 marzo 2024.
- ^ H.B. B:urgi, J.D. Dunitz e J.M. Lehn, Stereochemistry of reaction paths at carbonyl centres, in Tetrahedron, vol. 30, n. 12, 1974-01, pp. 1563–1572, DOI:10.1016/s0040-4020(01)90678-7. URL consultato il 30 marzo 2024.
- ^ Michael Smith e Jerry March, March's advanced organic chemistry: reactions, mechanisms, and structure, Eighth edition, John Wiley, 2020, pp. 1087-1089, ISBN 978-1-119-37179-3.
- ^ (EN) Andrzej Stanislaw Cieplak, Organic Addition and Elimination Reactions; Transformation Paths of Carbonyl Derivatives, 1ª ed., Wiley, 10 febbraio 1994, pp. 205–302, DOI:10.1002/9783527616091.ch06, ISBN 978-3-527-29042-0. URL consultato il 30 marzo 2024.
- ^ D. R. Bloch, Organic chemistry demystified, collana Demystified series, McGraw-Hill, 2006, p. 408, ISBN 978-0-07-145920-4, OCLC ocm62093051. URL consultato il 30 marzo 2024.
- ^ Peter Sykes, A guidebook to mechanism in organic chemistry, 6th ed, Longman ; Wiley, 1986, p. 204, ISBN 978-0-582-44695-3.
- ^ (EN) 19.5: Nucleophilic Addition of Water- Hydration, su Chemistry LibreTexts, 26 agosto 2015. URL consultato il 1º aprile 2024.
- ^ Jonathan Clayden, Nick Greeves e Stuart Warren, Organic chemistry, 2nd ed, Oxford university press, 2012, p. 452, ISBN 978-0-19-927029-3.
- ^ J.B. Hendrickson, D.J. Cram e G.S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 552-555.
- ^ J. B. Hendrickson, D. J. Cram e G. S. Hammond, CHIMICA ORGANICA, traduzione di A. Fava, 2ª ed., Piccin, 1973, pp. 444-446.
- ^ L'ossido di mesitile è il prodotto della condensazione aldolica dell'acetone con se stesso.
- ^ J. E. Huheey, E. A. Keiter e R. L. Keiter, Chimica Inorganica, Principi, Strutture, Reattività, 2ª ed., Piccin, 1999, pp. 437-442, ISBN 88-299-1470-3.
Bibliografia[modifica | modifica wikitesto]
- Harold Hart, Leslie E. Craine, David J. Hart Chimica organica, 2003, Zanichelli.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su carbonile
Wikimedia Commons contiene immagini o altri file su carbonile
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) carbonyl group, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | GND (DE) 4147314-0 |
|---|