Acido perfluoroottansolfonico
| Acido perfluoroottansolfonico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Acido eptadecafluoroottan-1-solfonico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C8HF17O3S |
| Massa molecolare (u) | 500,13 |
| Aspetto | solido |
| Numero CAS | |
| Numero EINECS | 217-179-8 |
| PubChem | 74483 |
| SMILES | C(C(C(C(C(F)(F)S(=O)(=O)O)(F)F)(F)F)(F)F)(C(C(C(F)(F)F)(F)F)(F)F)(F)F |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
   
| |
| pericolo | |
| Frasi H | 302+332 - 314 - 351 - 360D - 362 - 372 - 411 [1] |
| Consigli P | 201 - 263 - 273 - 281 - 308+313 [1] |
L'acido perfluoroottansolfonico è un composto chimico fluorurato di origine sintetica. Trattasi di un acido molto forte, che per ionizzazione forma l'anione perfluoroottansolfonato, noto con la sigla PFOS. Questi composti hanno proprietà tensioattive e sono inquinanti organici persistenti. Il PFOS era l'ingrediente chiave di vari prodotti antimacchia e idrorepellenti per tessuti, tra i quali lo Scotchgard, commercializzato dalla 3M. Nel 2009 il PFOS è stato aggiunto all'appendice B della Convenzione di Stoccolma sugli inquinanti organici persistenti.[2] La presenza di PFOS e simili prodotti fluorurati nell'ambiente deriva in parte dall'uso industriale, in parte dall'uso e consumo di prodotti che lo contengono, e in parte dalla degradazione abiotica o biotica di altri derivati e polimeri contenenti catene perfluoroalchiliche.[3][4] L'uso di PFOS e suoi derivati è ancora possibile in Europa in base al Regolamento (UE) 757/2010, che prevede una serie di deroghe per usi molto limitati, oggetto di riesami periodici, e norme specifiche per la gestione dei rifiuti contenenti PFOS.[5] PFOS e prodotti chimici correlati sono ancora prodotti in Cina.[4]
Storia[modifica | modifica wikitesto]
Nel 1949 la 3M iniziò a produrre tramite fluorurazione elettrochimica il fluoruro di perfluoroottansulfonile (POSF) e vari suoi derivati, tra i quali acido perfluoroottansolfonico e PFOS. Nel 1968 furono trovati composti organici fluorurati nel siero sanguigno di consumatori, e nel 1976 fu suggerito che si trattasse di acido perfluoroottanoico (PFOA) o composti correlati come il PFOS.[6][7][8] Nel 1997 la 3M trovò tracce di PFOS in campioni che si pensavano incontaminati, provenienti dalle banche del sangue in tutto il mondo.[9] Nel 1999 la US Environmental Protection Agency dopo aver ricevuto dati sulla tossicità e distribuzione globale del PFOS iniziò a studiare i composti perfluorurati. Nel maggio 2000 la 3M, principale produttore di PFOS, annunciò che la produzione di POSF sarebbe terminata nel 2002. È stato stimato che nel periodo 1970-2002 siano state prodotte 122500tonnellate di POSF e relativi derivati.[3] Nel 2001 fu dimostrato per la prima volta che il PFOS è un inquinante globale negli animali selvatici.[10]
Proprietà[modifica | modifica wikitesto]
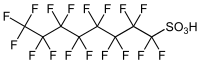
Il gruppo C8F17 è idrofobico e lipofobico, come nei fluorocarburi, mentre il gruppo acido solfonico/solfonato conferisce polarità. In virtù della natura e della forza del legame carbonio–fluoro, il PFOS è un composto di stabilità eccezionale sia per applicazioni industriali sia nell'ambiente. Il PFOS è un surfattante fluorurato che abbassa la tensione superficiale dell'acqua più dei normali surfattanti idrocarburici. L'attenzione è di solito focalizzata sull'isomero a catena lineare (n-PFOS) illustrato nella figura, che è la specie dominante nei prodotti commerciali e nei campioni ambientali, ma esistono numerosi congeneri lineari o ramificati che hanno differenti proprietà fisiche, chimiche e tossicologiche.[11][12][13]
Applicazioni[modifica | modifica wikitesto]
PFOS è in genere commercializzato come sale sodico o potassico. È stato usato soprattutto per materiali come tessuti, tappeti e carta al fine di renderli resistenti a grasso, olio e acqua. Inoltre, è stato ed è ancora utilizzato in modo limitato in galvanostegia, in fotografia, fotolitografia, nell'industria dei semiconduttori, in schiume antincendio e in fluidi idraulici per l'industria aerospaziale.[3]
Effetti sulla salute umana e sugli animali selvatici[modifica | modifica wikitesto]
In base ad uno studio condotto nel 2002 dalla Direzione ambientale dell'Organizzazione per la cooperazione e lo sviluppo economico, PFOS risulta persistente, bioaccumulabile e tossico (PBT) per i mammiferi.[14] Nel 2008 è stato mostrato che una concentrazione di PFOS ~90 ppb (parti per miliardo) nel siero sanguigno di topi maschi influenza il sistema immunitario, facendo nascere la possibilità che persone molto esposte e animali selvatici sviluppino immunodeficienza.[15] Uova di gallina trattate con 1 milligrammo per chilogrammo (pari a 1000 ppb) di PFOS hanno sviluppato pulcini che ne avevano ~150 ppb nel siero sanguigno, e hanno mostrato asimmetria cerebrale e ridotti livelli di immunoglobulina.[16] I valori di PFOS sono stati misurati in varie specie selvatiche; alcuni dei valori più alti registrati fino al gennaio 2006 sono riportati nella tabella successiva:[17]
| Specie | Luogo | Anno | Campione | PFOS (ppb) |
|---|---|---|---|---|
| Aquila calva | Midwest USA | 1990–93 | plasma | 2 200 |
| Cormorano di Brandt | California, USA | 1997 | fegato | 970 |
| Uria | Mar Baltico | 1997 | uovo | 614 |
| Cornacchia | Baia di Tokyo, Giappone | 2000 | fegato | 464 |
| Strolaga minore | Carolina del Nord, USA | 1998 | fegato | 861 |
| Orso polare | Sanikiluaq, Nunavut | 2002 | fegato | 3 100 |
| Foca comune | Mare dei Wadden, Danimarca | 2002 | muscoli | 2 725 |
| Tursiopi | Charleston (Carolina del Sud), USA | 2003 | plasma | 1 315 |
| Delfino comune | Mar Mediterraneo, Italia | 1998 | fegato | 940 |
| Visone americano | Michigan, USA | 2000–01 | fegato | 59 500 |
I livelli osservati negli animali selvatici sono considerati sufficienti ad "alterare i parametri della salute".[18] Da studi su animali risulta che il PFOS può causare tumori, ritardi dello sviluppo fisico, ritardi della crescita, alterazioni del sistema endocrino e mortalità neonatale; quest'ultima potrebbe essere il risultato più drammatico dei test su animali di laboratorio.[19] Femmine di topi con livelli sanguigni di PFOS comparabili a quelli trovati negli animali selvatici e nell'uomo hanno mostrato un'accresciuta mortalità se infettati da Influenzavirus A.[20] Il PFOS riduce la dimensione alla nascita degli uccelli.[21]
Per quanto riguarda l'uomo, ricerche svolte negli USA hanno mostrato che il PFOS è presente nel siero sanguigno di tutta la popolazione USA, e la sua concentrazione sta calando nel tempo, mentre sembra che in Cina stia crescendo.[22] Lavoratori esposti possono avere un livello medio di PFOS di oltre 1000 ppb, e una parte della popolazione generale è oltre 90 ppb.[15] I valori più elevati di PFOS sono stati 114000ppb per lavoratori esposti,[23] e 1656ppb per un donatore di sangue americano.[24]
La presenza di PFOS in donne in gravidanza è stata associata con preeclampsia.[25][26] Non ci sono correlazioni consistenti tra livelli modesti di PFOS e un ridotto sviluppo del feto.[27] Livelli maggiori sono stati associati a un'alterazione dei livelli dei ormoni tiroidei in Inuit adulti[28] e ad un maggior rischio di valori elevati di colesterolo.[29][30] Nei giovani statunitensi di 12–15 anni l'esposizione a PFOS è stata correlata con un maggior rischio di sindrome da deficit di attenzione e iperattività (ADHD).[31]
A partire dal 2016, la Regione Veneto ha avviato uno studio epidemiologico e un piano di monitoraggio delle acque e della popolazione nelle province di Vicenza, Verona e Padova[32], che costituisce una novità di rilievo rispetto alla limitata letteratura scientifica disponibile in merito ai loro effetti sulla salute umana[33]. In data 10 ottobre 2019 sono stati pubblicati i primi risultati sugli studi condotti sugli pfos ed è emerso che il loro utilizzo interferisce con i normali valori di Vitamina D nel corpo, favorendo dunque l’osteoporosi[34].
Note[modifica | modifica wikitesto]
- ^ a b GESTIS.
- ^ Stockholm Convention Secretariat 2009
- ^ a b c Paul et al. 2009
- ^ a b Buck et al. 2011
- ^ Gazzetta ufficiale U.E. 2010
- ^ Giesy e Kannan 2002
- ^ Kennedy et al. 2004
- ^ Lau et al. 2004
- ^ Environmental Working Group 2009
- ^ Giesy e Kannan 2001
- ^ Rayne et al. 2008
- ^ Rayne et al. 2009
- ^ Rayne e Forest 2009
- ^ OCSE 2002
- ^ a b Betts 2008
- ^ Peden-Adams 2009
- ^ Houde et al. 2006
- ^ Peden-Adams et al. 2009
- ^ Betts 2007
- ^ Guruge et al. 2009
- ^ Betts 2007
- ^ Renner 2008
- ^ Fromme et al. 2009
- ^ Olsen et al. 2003
- ^ Stein et al. 2009
- ^ Association of Perfluoroalkyl Substances With Gestational Hypertension and Preeclampsia in the MIREC Study, in Environment international, DOI:10.1016/j.envint.2020.105789, PMID 32408216.
- ^ Washino et al. 2009
- ^ Dallaire et al. 2009
- ^ Steenland et al. 2009
- ^ Nelson et al. 2009
- ^ Hoffman et al. 2010
- ^ Sostanze perfluoro alchiliche (PFAS), su regione.veneto.it, 7 giugno 2018. URL consultato il 30 gennaio 2019 (archiviato il 21 giugno 2018).
- ^ A. Tornago, Pfas Veneto, l’assessore alla Sanità: “Più di 60mila persone contaminate dalle sostanze cancerogene nelle acque”, in Il Fatto Quotidiano, 21 aprile 2016 (archiviato il 4 ottobre 2018).
- ^ V. Corvino, Pfas, la ricerca: interferiscono con la vitamina D favorendo l’osteoporosi, 10 ottobre 2019.
Bibliografia[modifica | modifica wikitesto]
- (EN) K. S. Betts, Perfluoroalkyl acids: what is the evidence telling us?, in Environ. Health Perspect., vol. 115, n. 5, 2007, pp. A250–6, PMID 17520044.
- (EN) K. Betts, PFOS and PFOA in humans: new study links prenatal exposure to lower birth weight, in Environ Health Perspect., vol. 115, n. 11, 2007, pp. A550, PMID 18007977.
- (EN) K. S. Betts, Not immune to PFOS effects?, in Environ. Health Perspect., vol. 116, n. 7, 2008, pp. A290, PMID 18629339.
- (EN) R. C. Buck, J. Franklin, U. Berger, J. M. Conder e altri, Perfluoroalkyl and Polyfluoroalkyl Substances in the Environment: Terminology, Classification, and Origins, in Integrated Environmental Assessment and Management, vol. 7, n. 4, 2011, pp. 513-541, DOI:10.1002/ieam.258.
- (EN) R. Dallaire, E. Dewailly, D. Pereg, S. Dery e P. Ayotte, Thyroid function and plasma concentrations of polyhalogenated compounds in Inuit adults, in Environ. Health Perspect., vol. 117, n. 9, 2009, pp. 1380-6, DOI:10.1289/ehp.0900633.
- The Inside Story: 3M and Scotchgard, in Chemical Industry Archives, Environmental Working Group, 2009. URL consultato il 3 dicembre 2015 (archiviato dall'url originale il 25 aprile 2009).
- (EN) H. Fromme, S. A. Tittlemier, W. Völkel, M. Wilhelm e D. Twardella, Perfluorinated compounds—exposure assessment for the general population in Western countries, in Int. J. Hyg. Environ. Health, vol. 212, n. 3, 2009, pp. 239-270, DOI:10.1016/j.ijheh.2008.04.007.
- Pharmacokinetic Bias Analysis of an Association Between Clinical Thyroid Disease and Two Perfluoroalkyl Substances, in Environment international, DOI:10.1016/j.envint.2020.105784, PMID 32408218.
- Persistent Organic Pollutant Exposure and Celiac Disease: A Pilot Study, in Environmental research, DOI:10.1016/j.envres.2020.109439, PMID 32409013.
- Regolamento (UE) N. 757/2010 della Commissione (PDF), in Gazzetta ufficiale dell'Unione europea, 2010. URL consultato il 3 dicembre 2015 (archiviato dall'url originale il 6 marzo 2016).
- GESTIS, Perfluorooctane sulfonic acid [collegamento interrotto], su gestis-en.itrust.de. URL consultato il 2 dicembre 2015.
- (EN) J. P. Giesy e K. Kannan, Global distribution of perfluorooctane sulfonate in wildlife, in Environ. Sci. Technol., vol. 35, n. 7, 2001, pp. 1339-1342, DOI:10.1021/es001834k.
- (EN) J. P.Giesy e K. Kannan, Perfluorochemical surfactants in the environment, in Environ. Sci. Technol., vol. 36, n. 7, 2002, pp. 146A–152A, DOI:10.1021/es022253t.
- (EN) K. S. Guruge, H. Hikono, N. Shimada, K. Murakami e altri, Effect of perfluorooctane sulfonate (PFOS) on influenza A virus-induced mortality in female B6C3F1 mice, in J. Toxicol. Sci., vol. 34, n. 6, 2009, pp. 687-691, DOI:10.2131/jts.34.687.
- (EN) K. Hoffman, T. F. Webster, M. G. Weisskopf, J. Weinberg e V. M. Vieira, Exposure to Polyfluoroalkyl Chemicals and Attention Deficit Hyperactivity Disorder in U.S. Children Aged 12-15 Years, in Environ. Health Perspect., vol. 118, n. 12, 2010, pp. 1762-7, DOI:10.1289/ehp.1001898.
- (EN) M. Houde, J. W. Martin, R. J. Letcher e altri, Biological monitoring of polyfluoroalkyl substances: A review, in Environ. Sci. Technol., vol. 40, n. 11, 2006, pp. 3463-73, DOI:10.1021/es052580b.
- (EN) G. L. Kennedy, J. L. Butenhoff, G. W. Olsen e altri, The toxicology of perfluorooctanoate, in Crit. Rev. Toxicol., vol. 34, n. 4, 2004, pp. 351-384, DOI:10.1080/10408440490464705.
- (EN) C. Lau, J. L. Butenhoff e J. M. Rogers, The developmental toxicity of perfluoroalkyl acids and their derivatives, in Toxicol. Appl. Pharmacol., vol. 198, n. 2, 2004, pp. 231-241, DOI:10.1016/j.taap.2003.11.031.
- (EN) J. W. Nelson, E. E. Hatch e T. F. Webster, Exposure to Polyfluoroalkyl Chemicals and Cholesterol, Body Weight, and Insulin Resistance in the General U.S. Population, in Environ. Health Perspect., vol. 118, n. 2, 2009, pp. 197-202, DOI:10.1289/ehp.0901165.
- Hazard assessment of perfluorooctane sulfonate (PFOS) and its salts (PDF), su oecd.org, OCSE, 2002. URL consultato il 3 dicembre 2015.
- (EN) G. W. Olsen, T. R. Church, Miller J. P., J. M. Burris e altri, Perfluorooctanesulfonate and other fluorochemicals in the serum of American Red Cross adult blood donors, in Environ. Health Perspect., vol. 111, n. 16, 2003, pp. 1892-1901, DOI:10.1289/ehp.6316.
- (EN) A. G. Paul, K. C. Jones e A. J. Sweetman, A First Global Production, Emission, And Environmental Inventory For Perfluorooctane Sulfonate, in Environ. Sci. Technol., vol. 43, n. 2, 2009, pp. 386-392, DOI:10.1021/es802216n.
- (EN) M. Peden-Adams, J. Stuckey, K. Gaworecki e altri, Developmental toxicity in white leghorn chickens following in ovo exposure to perfluorooctane sulfonate (PFOS), in Reproductive toxicology, vol. 27, n. 3-4, 2009, pp. 307-318, DOI:10.1016/j.reprotox.2008.10.009.
- (EN) M. M. Peden-Adams, D. E. Keil, T. Romano, M. A. M. Mollenhauer e altri, Health effects of perfluorinated compounds—What are the wildlife telling us?, in Reproductive Toxicology, vol. 27, n. 3-4, 2009, pp. 414-415, DOI:10.1016/j.reprotox.2008.11.016.
- (EN) S. Rayne, K. Forest e K. J. Friesen, Congener-specific numbering systems for the environmentally relevant C1 through C8 perfluorinated homologue groups of alkyl sulfonates, carboxylates, telomer alcohols, olefins, and acids, and their derivatives, in Journal of Environmental Science and Health, Part A, vol. 43, n. 12, 2008, pp. 1391-1401, DOI:10.1080/10934520802232030.
- (EN) S. Rayne, K. Forest e K. J. Friesen, Estimated congener specific gas phase atmospheric behavior and fractionation of perfluoroalkyl compounds: Rates of reaction with atmospheric oxidants, air-water partitioning, and wet/dry deposition lifetimes, in Journal of Environmental Science and Health, Part A, vol. 44, n. 10, 2009, pp. 936-954, DOI:10.1080/10934520902996815.
- (EN) S. Rayne e K. Forest, Perfluoroalkyl sulfonic and carboxylic acids: A critical review of physicochemical properties, levels and patterns in waters and waste waters, and treatment methods, in Journal of Environmental Science and Health, Part A, vol. 44, n. 12, 2009, pp. 1145-1199, DOI:10.1080/10934520903139811.
- (EN) R. Renner, PFOS phaseout pays off, in Environ. Sci. Technol., vol. 42, n. 13, 2008, p. 4618, DOI:10.1021/es0871614.
- (EN) K. Steenland, S. Tinker, S. Frisbee, A. Ducatman e V. Vaccarino, Association of perfluorooctanoic acid and perfluorooctane sulfonate with serum lipids among adults living near a chemical plant, in Am. J. Epidemiol., vol. 170, n. 10, 2009, pp. 1268-78, DOI:10.1093/aje/kwp279.
- (EN) C. R. Stein, D. A. Savitz e M. Dougan, Serum levels of perfluorooctanoic acid and perfluorooctane sulfonate and pregnancy outcome, in Am. J. Epidemiol., vol. 170, n. 7, 2009, pp. 837-46, DOI:10.1093/aje/kwp212.
- Governments unite to step-up reduction on global DDT reliance and add nine new chemicals under international treaty, su chm.pops.int, Stockholm Convention Secretariat, 2009. URL consultato il 3 dicembre 2015.
- (EN) N. Washino, Y. Saijo, S. Sasaki, S. Kato e altri, Correlations between prenatal exposure to perfluorinated chemicals and reduced fetal growth, in Environ. Health Perspect., vol. 117, n. 4, 2009, pp. 660-7, DOI:10.1289/ehp.11681.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su acido perfluoroottansolfonico
Wikimedia Commons contiene immagini o altri file su acido perfluoroottansolfonico
| Controllo di autorità | LCCN (EN) sh2017003851 · J9U (EN, HE) 987007407407505171 |
|---|