Nitrometano
| Nitrometano | |
|---|---|
 | |
| Nome IUPAC | |
| nitrometano | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH3NO2 |
| Massa molecolare (u) | 61,04 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 200-876-6 |
| PubChem | 6375 |
| SMILES | C[N+](=O)[O-] |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,14 |
| Temperatura di fusione | −29 °C (244 K) |
| Temperatura di ebollizione | 101 °C (374 K) |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −112,6 |
| ΔfG0 (kJ·mol−1) | −14,4 |
| S0m(J·K−1mol−1) | 171,8 |
| C0p,m(J·K−1mol−1) | 106,6 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 35,6 °C (308,8 K) |
| Limiti di esplosione | 7,3 - 63% vol. |
| Temperatura di autoignizione | 418 °C (691 K) |
| Simboli di rischio chimico | |
 
| |
| attenzione | |
| Frasi H | 226 - 302 |
| Consigli P | 210 [1] |
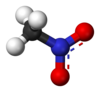
Il nitrometano è un composto organico di formula CH3NO2. È il più semplice dei nitrocomposti alifatici R-NO2 (R = alchile). Nella molecola i due atomi di ossigeno sono uguali grazie alla risonanza (una delle due forme è mostrata in figura, a destra) che li fa scambiare di ruolo. Come si può già intuire da queste due strutture limite la sua molecola risulta considerevolmente polare (μ = 3,54 D)[2].
Allo stato liquido va soggetto a tautomeria di tipo cheto-enolico che comporta uno spostamento di protone (H+) dal carbonio a uno degli ossigeni (e viceversa), ma l’equilibrio risultante è comunque molto spostato a sinistra; la presenza di un -OH nella seconda forma tautomera, pur se largamente minoritaria, rende il nitrometano un solvente polare sì, ma non del tutto aprotico. Un solvente simile, ma di uso più generale, è l'acetonitrile; anch'esso notevolmente polare e con buona costante dielettrica.
Il nitrogruppo -NO2 è tra i gruppi maggiormente stabilizzanti dei carbanioni in α, più del carbonile (e questo più del cianogruppo -CN), per cui gli idrogeni del metile sono qui decisamente più acidi che nei chetoni o aldeidi; infatti il suo pKa è 10,21[3], contro 19,16[4] per l’acetone; il nitrometano può quindi essere facilmente deprotonato; l’anione che così ne deriva è un buon nucleofilo al carbonio; come tale, che può essere utilmente impiegato nelle reazioni di addizione nucleofila al carbonile e questo anche a scopo sintetico, per formare legami C-C ed estendere così la catena.
A temperatura ambiente si presenta come un liquido incolore, leggermente oleoso, dall'intenso odore caratteristico; bolle a 101 °C ed è solo parzialmente solubile in acqua.
Viene comunemente usato in svariate applicazioni industriali come solvente, come intermedio di sintesi, come mezzo di reazione e per estrazioni liquido-liquido in campo farmaceutico, per le produzioni di pesticidi, esplosivi, fibre e solvente di vernici o rivestimenti[5].
La sua costante dielettrica relativamente elevata (εr = 39,40)[6] lo rende adatto anche per solubilizzare complessi metallici e composti inorganici in genere.
Usi
[modifica | modifica wikitesto]Un uso di un certo rilievo è connesso al mondo del modellismo dinamico a motore endotermico, dove esso viene miscelato con alcol metilico, olio di ricino di alta qualità e una miscela di 8 tipi diversi di olio sintetico per produrre una miscela carburante.
L'ossigeno presente nella molecola viene rilasciato ad una certa temperatura permettendo di bruciare una quantità maggiore di combustibile di quanto permetterebbe il solo ossigeno presente nell'aria, ottenendo così una combustione più energetica di quella che si avrebbe immettendo una miscela di solo alcool metilico nella camera di combustione del micromotore, sia esso a due o quattro tempi.
Viene impiegato nel mondo quattro ruote pista e fuoristrada ma è anche utilizzato, in percentuali minori, in aerei ed elicotteri in scala.
I dragster sono un esempio di macchine da corsa alimentate a nitrometano, infatti quando si alimentano motori con nitrometano molto concentrato si notano le caratteristiche "fiammate" (date dalla parziale combustione del nitrometano nella camera di scoppio) che escono dagli scarichi.
Le percentuali maggiori, si ottengono nell'1/8 pista 25% ma si può arrivare anche a percentuali di 30-33% per i fuoristrada o rally per poi scendere al 10-16% per la 1/10.
Il nitrometano, in maniera analoga ad altri nitrocomposti come la nitroglicerina, ad alte temperature si disgrega e gli atomi di ossigeno vengono liberati agevolando così una forte detonazione; tuttavia, il nitrometano, generando ossigeno, va ad ossidare le delicate parti meccaniche prevalentemente fatte di alluminio ma anche di acciaio del micromotore.
Il nitrometano è impiegato nelle industrie come solvente e per altre applicazioni.
Precauzioni d'uso
[modifica | modifica wikitesto]Puro o ad alte concentrazioni, il nitrometano è esplosivo per riscaldamento o compressione. Se contaminato con ammine o idrocarburi, può formare composti esplosivi sensibili agli urti (l'esplosivo liquido Picatinny Liquid explosive - PLX viene ottenuto proprio miscelando 95% di nitrometano e 5% di etilendiammina).
In particolar modo è pericolosissimo miscelare il nitrometano con l'idrazina, perché formano un sale che può esplodere spontaneamente anche in assenza di ossigeno.
A partire dal 1º marzo 2016 le normative europee vietano la vendita di nitrometano ai privati in quanto precursore di esplosivo.[7]
Note
[modifica | modifica wikitesto]- ^ scheda del nitrometano su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ Dipole moments, su stenutz.eu. URL consultato il 10 luglio 2020.
- ^ John A. Riddick, Theodore Sakano e William B. Bunger, Organic solvents: physical properties and methods of purification, collana Techniques of chemistry, 4th ed, Wiley, 1986, ISBN 978-0-471-08467-9. URL consultato il 10 luglio 2020.
- ^ (EN) Yvonne Chiang, A. Jerry Kresge e Yui S. Tang, The pKa and keto-enol equilibrium constant of acetone in aqueous solution, in Journal of the American Chemical Society, vol. 106, n. 2, 1984-01, pp. 460–462, DOI:10.1021/ja00314a055. URL consultato il 10 luglio 2020.
- ^ Markofsky, S. B., Nitro Compounds, Aliphatic, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2000, DOI:10.1002/14356007.a17_401.pub2, ISBN 978-3527306732.
- ^ Dielectric constants and refractive index, su stenutz.eu. URL consultato il 10 luglio 2020.
- ^ Reg. (CE) 15-1-2013 n. 98/2013 REGOLAMENTO DEL PARLAMENTO EUROPEO E DEL CONSIGLIO relativo all'immissione sul mercato e all'uso di precursori di esplosivi (Testo rilevante ai fini del SEE). (PDF), su earmi.it, G.U.U.E. 9 febbraio 2013, n. L 39.. URL consultato il 10 febbraio 2016.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su nitrometano
Wikimedia Commons contiene immagini o altri file su nitrometano
| Controllo di autorità | LCCN (EN) sh98000189 · GND (DE) 4253374-0 · J9U (EN, HE) 987007554130105171 |
|---|