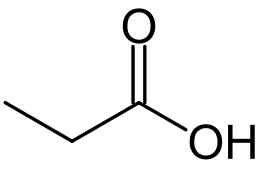
Acido propionico
| Acido propionico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| acido propanoico | |
| Nomi alternativi | |
| acido etancarbossilico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C3H6O2 |
| Massa molecolare (u) | 74,08 |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 201-176-3 |
| PubChem | 1032 |
| DrugBank | DB03766 |
| SMILES | CCC(=O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 0,99 |
| Costante di dissociazione acida a 298,15 K | 1,32×10−5 |
| Solubilità in acqua | miscibile |
| Temperatura di fusione | −21 °C (252,15 K) |
| Temperatura di ebollizione | 141 °C (414,15 K) |
| Tensione di vapore (Pa) a 393,15 K | 500 Pa |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | −510,8 |
| S0m(J·K−1mol−1) | 191 |
| Indicazioni di sicurezza | |
| Punto di fiamma | 54 °C (327,15 K) |
| Temperatura di autoignizione | 485 °C (758,15 K) |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 226 - 314 |
| Consigli P | 210 - 241 - 303+361+353 - 305+351+338 - 405 - 501 [1][2] |
L'acido propionico, nome IUPAC acido propanoico, è un acido carbossilico con formula condensata CH3CH2COOH. È un composto ampiamente diffuso in natura, è un liquido corrosivo, incolore e dall'odore pungente.
L'acido propionico fu descritto per la prima volta da Johann Gottlieb nel 1844, che lo isolò dai prodotti di degradazione dello zucchero. Negli anni successivi molti chimici sintetizzarono in vario modo l'acido propionico, senza rendersi però conto del fatto che stessero producendo la stessa sostanza. Fu il chimico francese Jean-Baptiste Dumas, nel 1847, a stabilire che gli acidi precedentemente ottenuti erano in realtà la stessa sostanza, che egli chiamò acido propionico (protos=primo + pion=grasso); il nome indica che il composto è il primo della serie degli acidi grassi, possedendone la più semplice struttura.
Proprietà[modifica | modifica wikitesto]
L'acido propionico possiede proprietà chimico-fisiche intermedie tra quelle degli acidi carbossilici a catena più corta, quali l'acido formico e l'acido acetico, e gli acidi grassi a catena più lunga. È miscibile con l'acqua ma diviene immiscibile per aggiunta di sali formando una fase oleosa. Analogamente al caso dell'acido formico e dell'acido acetico, i suoi vapori non rispettano la legge dei gas ideali, esistendo sotto forma di coppie di molecole legate da legame idrogeno. Anche allo stato liquido l'acido propionico tende a formare tali coppie.
Le proprietà chimiche dell'acido propionico rispecchiano le caratteristiche generali degli acidi carbossilici, tendendo ad esempio a formare ammidi, esteri, anidridi e loro derivati. Per reazione con bromo in presenza del catalizzatore PBr3 subisce α-alogenazione formando CH3CHBrCOOH.
Sintesi industriale[modifica | modifica wikitesto]
Industrialmente l'acido propionico viene sintetizzato principalmente attraverso la sintesi di Reppe oppure tramite l'ossidazione della propionaldeide.
La sintesi di Reppe consiste in una reazione di carbonilazione in cui l'etilene viene fatto reagire con monossido di carbonio (CO) e acqua (H2O), in presenza del catalizzatore tetracarbonilnichel. La reazione, condotta a pressione di 100-300 bar e temperatura di 250-320 °C, è la seguente:
- H2C=CH2 + H2O + CO → CH3CH2COOH
L'ossidazione della propionaldeide viene invece realizzata usando l'aria, in presenza di cobalto o ioni manganese, e la reazione procede rapidamente anche a temperature non molto elevate. Solitamente viene condotta alla temperatura di 40-50 °C e implica la reazione
- CH3CH2CHO + 1/2 O2 → CH3CH2COOH
Una terza via sintetica si basa sull'ossidazione diretta degli idrocarburi, come ad esempio la nafta. In questo caso l'acido propionico rappresenta uno dei sottoprodotti della sintesi dell'acido acetico.
Biochimica[modifica | modifica wikitesto]
L'acido propionico è prodotto biologicamente sotto forma di estere del coenzima A, dal catabolismo degli acidi grassi contenenti numero dispari di atomi di carbonio e anche dal catabolismo di alcuni amminoacidi come isoleucina e valina.
I batteri del genere Propionibacterium producono acido propionico come prodotto finale del loro metabolismo anaerobico. Questa classe di batteri colonizza comunemente gli stomaci dei ruminanti e le ghiandole sudoripare umane, risultando una delle principali cause che determinano l'odore del sudore e uno dei maggiori fattori all'origine della eziopatogenesi dell'acne. Propionibacterium è anche il principale responsabile dell'odore e aroma caratteristico del formaggio svizzero, ottenuto dopo opportuna fermentazione batterica.
Usi[modifica | modifica wikitesto]
Essendo l'acido propionico un inibitore della crescita di muffa e di alcuni batteri, viene utilizzato come conservante per cibi destinati al consumo umano e animale. Nei cibi per l'uomo, in particolare per il pane e altri prodotti da forno, viene utilizzato in forma di sale di sodio o di calcio. Nei cibi animali viene invece utilizzato direttamente o sotto forma di sale d'ammonio.
Gli additivi alimentari a base di acido propionico sono i seguenti:
- E280 - Acido propionico
- E281 - Propionato di sodio
- E282 - Propionato di calcio
- E283 - Propionato di potassio
L'acido propionico è anche un utile intermedio di sintesi. Può essere utilizzato per modificare fibre sintetiche di cellulosa. Trova anche impiego nella sintesi di pesticidi e farmaci, in particolare FANS derivati dell'acido propionico (es. ibuprofene, ketoprofene, naprossene, flurbiprofene). Gli esteri dell'acido propionico sono talvolta utilizzati come solventi o come aromi artificiali.
Note[modifica | modifica wikitesto]
- ^ scheda del composto su IFA-GESTIS (archiviato dall'url originale il 16 ottobre 2019).
- ^ Smaltire in accordo alle leggi vigenti.
Bibliografia[modifica | modifica wikitesto]
- Rainer Samel, Walter Kohler, Armin O. Gamer e et al., Propionic Acid and Derivatives, in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, 2002, DOI:10.1002/14356007.a22_223.pub3.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su acido propionico
Wikimedia Commons contiene immagini o altri file su acido propionico
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) propionic acid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 47320 · LCCN (EN) sh85107535 · GND (DE) 4175947-3 · J9U (EN, HE) 987007541099005171 |
|---|