Glicole metilenico
| Glicole metilenico | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| metandiolo | |
| Nomi alternativi | |
| Glicole metilenico Formaldeide monoidrata | |
| Caratteristiche generali | |
| Formula bruta o molecolare | CH4O2 |
| Massa molecolare (u) | 48,041 g/mol |
| Aspetto | liquido incolore |
| Numero CAS | |
| Numero EINECS | 207-339-5 |
| PubChem | 79015 |
| SMILES | C(O)O |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1.199 g/cm−3 (a −19 °C) |
| Costante di dissociazione acida (pKa) a {{{Ka_temperatura}}} K | 13.29 |
| Temperatura di ebollizione | 193 °C () |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
  
| |
| pericolo | |
| Frasi H | 350 - 341 - 301+311+331 - 314 - 317 - 335 - 370 |
| Consigli P | 201 - 280 - 304+310+340 - 303+361+353 - 305+351+338 - 308+310 [1] |
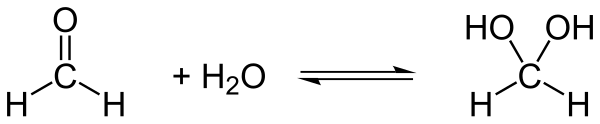
Il glicole metilenico, in breve GM , con nome sistematico metandiolo, è un composto organico descritto con formula strutturale HO-CH2-OH oppure H2C(OH)2 oppure H(H2CO)OH. È il più semplice diolo geminale. Il metandiolo è considerato la forma idrata della formaldeide H2CO. A temperatura ambiente non si incontra in forma pura, ma come soluzioni acquose, dove coesiste con minime concentrazioni di formaldeide, in breve FA, e vari oligomeri e polimeri. Il composto è chimicamente ben caratterizzato ma come è tipico per i dioli geminali è chimicamente instabile e reattivo pur essendo termodinamicamente stabile a temperatura ≤ 300 K.[2] Nell'acqua è stabilizzato dai legami idrogeno delle molecole d'acqua circostanti. A causa della sua intrinseca instabilità esso non può essere isolato come composto originario dalle sue soluzioni acquose. Anche per questo è equivocamente considerato dalla comunità scientifica come "soluzione di formaldeide" in acqua.[3][4]
Il chiarimento sulla vera natura delle "soluzioni di formaldeide" in acqua e la netta distinzione tra glicole metilenico e formaldeide sono emersi quando tra il 2007 ed il 2010 per non sottostare alle restrizioni normative[5] relative alla presenza di formaldeide nei cosmetici, per la stiratura dei capelli, alcuni produttori hanno dichiarato come ingrediente il glicole metilenico, con nome INCI: METHYLENE GLYCOL.[6][7][8][9][10]
La difficoltà nell'isolare il composto oltre che la sovrapposizione analitica con la formaldeide ha determinato ambiguità anche nel definirne le caratteristiche chimico fisiche. La sua temperatura di ebollizione calcolata teoricamente è di 193.7±8.0 °C a 760 mmHg o 131,16 a seconda del metodo di calcolo, a fronte di 94÷100 °C rilevati sperimentalmente nella sua soluzione satura in acqua, senza metanolo.
Le soluzioni acquose di GM sono incolori e posseggono un pungente odore caratteristico. Sono commercializzate col nome "formalina" e convenzionalmente classificate come soluzioni di formaldeide in acqua; erroneamente, visto che la formaldeide in acqua non è propriamente una soluzione e che la solubilità della formaldeide in acqua è effettivamente minima. Il motivo di questo errore è che la formaldeide, fortemente elettrofila, a causa della bassa densità di elettroni sull'atomo di carbonio reagisce facilmente anche con nucleofili deboli e, in assenza di altri partner nucleofili, reagisce molto rapidamente con l'acqua formando GM che si dissolve molto meglio in acqua rispetto alla formaldeide.
La formalina, tecnicamente prodotta dall'ossidazione catalitica del metanolo, contiene tipicamente circa il 59% di glicole metilenico, prodottosi idratando circa il 37% (p/p) di formaldeide (gassosa). La differente percentuale dipende dal diverso peso molecolare dei 2 composti, 48 per il GM contro 30 per la FA.
La reazione di idratazione della formaldeide è molto rapida: l'emivita della formaldeide gassosa a contatto con l'acqua è di 70 millisecondi.[11][12]
Qualsiasi rimozione di formaldeide da una soluzione acquosa di GM, ad esempio con il metodo analitico comune basato sull'intrappolamento con 2,4-dinitrofenilidrazina (2,4-DNPH) che ha un'alta affinità con la formaldeide e nessuna affinità con il GM, sposta immediatamente l'equilibrio forzando il rilascio di formaldeide dal glicole metilenico producendo una riduzione della concentrazione di quest'ultimo. La reazione di disidratazione del GM, con la conseguente cessione di formaldeide, è simultanea ma molto più lenta.[13][14] Può essere accelerata, a temperature più alte e pH più bassi.[14][15][16][17]
Equilibrio[modifica | modifica wikitesto]
Il GM è un prodotto dell'idratazione della formaldeide e funge da serbatoio di formaldeide in acqua visto che la sua idratazione è reversibile in una varietà di condizioni.
La costante di equilibrio per l'idratazione della formaldeide è stata calcolata in varie ricerche, da 1000 a 2400 a temperatura ambiente.[6][18][12][19][20][21][22] L'ampia varianza nei risultati è attribuita alle difficoltà analitiche nel rilevare la concentrazione di FA in acqua, calcolata prima dell'anno 2000 soprattutto con il picco di assorbimento del gruppo carbonile nella banda UV. Tutte le ricerche più recenti e con misurazioni spettroscopiche NMR hanno riportato valori della costante di equilibrio Kh ≥ 2000 a 20 °C.[23][24]
L'equilibrio metandiolo/formaldeide è dinamico e dipende, in particolare, dalla temperatura, dalla densità della soluzione, dal pH e dalla presenza di altri soluti o solventi.
| Equilibrio formaldeide/metandiolo in acqua in funzione della temperatura.[11] | |||||
|---|---|---|---|---|---|
| Temperatura (°C) | 20 | 30 | 40 | 50 | 60 |
| Formaldeide (%) | 0,06 | 0,1 | 0,14 | 0,21 | 0,3 |
| Metandiolo (%) | 99,94 | 99,9 | 99,86 | 99,79 | 99,7 |
| note: - Kh costante di equilibrio chimico calcolata come rapporto tra la velocità di idratazione e quella di disidratazione. | |||||
Polimerizzazione[modifica | modifica wikitesto]
Nelle soluzioni acquose, il glicole metilenico H(H2CO)OH, più lentamente, polimerizza formando oligomeri relativamente solubili e polimeri insolubili in acqua.
Considerando la reattività della FA più alta di quella della GM è probabile che la FA partecipi alle reazioni di oligomerizzazione del GM
La formazione di oligomeri e polimeri dipende dalla concentrazione di GM in acqua. Nelle soluzioni con basse concentrazioni non si formano polimeri.[27]
L'oligomero prevalente è il glicole di-ossimetilenico[28]: .
La costante di equilibrio nella dimerizzazione del GM è stata stimata pari a: 5÷7.[29]
In ambiente acido questi oligomeri lineari possono ciclizzare.
Le forme cicliche sarebbero stabilizzate da legami idrogeno intramolecolari senza richiedere la partecipazione delle molecole d'acqua circostanti.
Il triossano (H2CO)3 sarebbe frutto della ciclizzazione intramolecolare di un trimero lineare del glicole metilenico.[30][31][32]
Per inibire la polimerizzazione in acqua del GM, generalmente si utilizza metanolo e sali tampone.
Il sistema (formaldeide, glicole metilenico, oligomeri, acqua) è complesso e regolato da multipli equilibri tra i diversi composti e le diverse fasi. L'aggiunta del metanolo comporta la formazione di altri composti e altri equilibri.
Analitica[modifica | modifica wikitesto]
È stato affermato che i metodi analitici ufficiali per la determinazione della formaldeide libera produrrebbero risultati artificialmente elevati, visto che durante l'analisi il GM viene convertito in FA, e quindi i valori misurati non riflettono gli effettivi livelli di formaldeide libera.
Nei sistemi acquosi, le normali tecniche dove la FA viene intrappolata con un reagente producendo composti rilevabili con spettrofotometria forniscono sostanzialmente valori di FA rilasciata dal GM.
I dati in letteratura sulla costante di equilibrio chimico dell'idratazione della formaldeide sono stati ottenuti dall'assorbimento UV specifico del gruppo carbonile a circa 290 nm[18][21], polarografia a impulsi[33][34], dati termochimici[22] o dal rapporto delle costanti di velocità di idratazione e disidratazione che sono stati determinati con metodi indipendenti.[14] Il tasso di disidratazione del GM è stato misurato da diversi gruppi mediante intrappolamento chimico della formaldeide, mediante derivati dell'idrazina, e misurando spettrofotometricamente i prodotti dell'idrazina.
Per misurare l'effettiva conversione percentuale di GM in FA, le esatte concentrazioni di GM, la FA "libera", così come i dimeri, trimeri e oligomeri a catena più lunga nelle soluzioni in acqua di GM si può utilizzare la spettroscopia 13C-NMR e 1H-NMR, così come viene standardizzata per la titolazione con formiato di sodio.[35][36][37][38]
Questa tecnica analitica che non disturba l'equilibrio chimico, oltre a richiedere costi e tempi elevati, per l'analisi 13C-NMR sono necessarie alcune ore, produce nelle soluzioni ad alta concentrazione spettri relativamente confusi, pertanto per rilevare picchi relativamente chiari e distinti si utilizzano soluzioni diluite.
L'esistenza di formaldeide libera nella fase vapore in soluzione acquosa non è stata segnalata ma non può essere esclusa a causa delle limitazioni analitiche.[39]
Formalina[modifica | modifica wikitesto]
La formalina, generalmente descritta e denominata come una soluzione al 35/37% di formaldeide in acqua, a temperatura ambiente è in realtà un sistema complesso con più sostanze in equilibrio dove la formaldeide è a concentrazioni minime, inferiori allo 0,5%. Per ridurre la formazione di polimeri insolubili tipicamente si aggiunge al sistema formaldeide/acqua un 7/15% di metanolo. La formalina senza metanolo deve essere conservata a temperature >30 °C per inibire la polimerizzazione.
Non esiste una specifica definizione della composizione della formalina dove la presenza e concentrazione del metanolo è arbitraria. Diverse farmacopee (USP, PhEU, BP ecc.) hanno inserito la "soluzione di formaldeide" tra le monografie dei reagenti, con test di identificazione basati sul nitrato di argento e ammoniaca.
La formaldeide reagisce oltre che con l'acqua anche con il metanolo formando ulteriori sostanze di cui la principale è l'emiformale.[40][41][42]
La presenza del metanolo riduce la polimerizzazione del GM in acqua ma introduce nuovi oligomeri metossilati.
Per ridurre la polimerizzazione in acqua sono stati utilizzati anche altri alcoli a catena corta.[43][4]
In funzione di specifici utilizzi, ad esempio come fissativo, la formalina può essere diluita e tamponata con sali tampone, es. idrogenofosfato di disodio + diidrogenofosfato di sodio. La formalina, oltre ad essere uno dei più importanti prodotti intermedi dell'industria chimica è ampiamente utilizzata: nell'industria della carta per migliorare la resistenza e la qualità della carta; in conceria, per la concia delle pelli; nell'industria tessile, per aumentare la resistenza dei prodotti a pieghe e restringimenti; nella produzione di resine e fertilizzanti, in agricoltura, per la lavorazione di semi e radici, disinfezione del suolo e degli allevamenti; in medicina e per l'imbalsamatura come disinfettante e per la conservazione di preparati anatomici o tessuti biologici.
Composizione[modifica | modifica wikitesto]
L'effettiva composizione della tipica formalina non è facilmente definibile. Con concentrazioni di metanolo dal 7 al 15%, si stabiliscono multipli equilibri tra la FA e monomeri e oligomeri che si formano nella miscela acqua / metanolo. La presenza del metanolo inibisce la polimerizzazione in acqua ma favorisce la formazione di specie metossilate.
Questi multipli equilibri sono dinamici e la concentrazione di oligomeri rilevabile senza turbare l'equilibrio con spettrometria NMR varia con la temperatura, il pH e la concentrazione di GM. Il tasso di polimerizzazione sia in acqua che in metanolo cala diluendo la formalina.
I principali componenti sono glicole metilenico, acqua, metanolo, emiformale, glicole di-ossimetilenico, metossidiglicole, glicoli poli-ossimetilenici, poli-metossiglicole.[44][45][46][47][48][49]
| Concentrazioni (mol/dm3) nella formalina diluita in acqua a diverse temperature[44] | |||||||
|---|---|---|---|---|---|---|---|
| diluizione formalina/acqua | 1:3 | 1:6 | |||||
| Temperatura | 20 °C | 283 K | 293 K | 303 K | 313 K | 323 K | |
| Acqua | H2O | 47,4 | 50,6 | 50,7 | 50,6 | 50,3 | 50,4 |
| Glicole metilenico | OH-CH2-OH | 1,67 | 1,306 | 1,182 | 1,343 | 1,393 | 1,518 |
| Metanolo | CH3OH | 0,356 | 0,203 | 0,273 | 0,215 | 0,226 | 0,258 |
| Emifomale | CH3O-CH2-OH | 0,590 | 0,281 | 0,295 | 0,215 | 0,216 | 0,241 |
| Glicole di-ossimetilenico | HO-CH2-O-CH2-OH | 0,339 | 0,130 | 0,157 | 0,090 | 0,389 | 0,207 |
| Di-metossiglicole | CH3O-CH2-O-CH2-OH | 0,0965 | 0,025 | 0,025 | 0,019 | 0,021 | 0,018 |
Presenza in natura[modifica | modifica wikitesto]
Il GM è praticamente ubiquitario nel mondo animale e vegetale; trovandosi in tutte le specie dove è stata rilevata la presenza di formaldeide in acqua. Si ritiene che il dianion, metandiolato, sia un intermedio nella reazione incrociata di Cannizzaro .
Il composto ha una certa rilevanza per l'astrochimica. Nello spazio è termodinamicamente stabile.[2][50]
Controversie tossicologiche[modifica | modifica wikitesto]
La definizione di un profilo tossicologico del glicole metilenico distinto da quello della formaldeide è stata oggetto di controversia. In conclusione, il glicole metilenico e la formaldeide sono molecole diverse e possono essere chiaramente distinte; una a temperatura ambiente è un gas, l'altra un liquido; una appartiene alla famiglia delle aldeidi, l'altra a quella dei glicoli; una è altamente reattiva, l'altra è relativamente stabile sia chimicamente che termodinamicamente[14]; una è classificata come cancerogena per una specifica forma di cancro alle vie nasali, l'altra no.
Fino al 2019, nella UE ed in tanti paesi al mondo che hanno adottato restrizioni analoghe a quelle del regolamento europeo dei cosmetici, la formaldeide era espressamente proibita come ingrediente cosmetico, mentre Il glicole metilenico no. Il glicole metilenico non doveva sottostare neppure alle restrizioni previste per i conservanti "cessori di formaldeide".
Tra il 2010 ed il 2014 vari enti regolatori per la sicurezza del cosmetico, a causa della stretta interrelazione tra formaldeide e glicole metilenico e la loro rapida conversione reciproca in un equilibrio dinamico, hanno definito il glicole metilenico e vari oligomeri presenti nella formalina come "formaldeide equivalenti" dal punto di vista tossicologico, perché immediatamente disponibili per qualsiasi reazioni tipica della formaldeide in soluzioni acquose, compreso qualsiasi sistema biologico che contiene acqua. Quindi, da un punto di vista pratico e precauzionario, è giustificato considerare qualsiasi miscela acquosa di formaldeide gassosa e glicole metilenico come contenente “formaldeide equivalenti”, preferibilmente espressi come concentrazione di formaldeide.[7][6][3] Il termine “formaldeide equivalenti” descriverebbe adeguatamente il fatto che il glicole metilenico viene convertito continuamente a formaldeide gassosa in soluzione acquosa, e viceversa, e che l'equilibrio può essere facilmente spostato mediante riscaldamento, vaporizzazione e qualsiasi altra condizione che aumenti o diminuisca la quantità di formaldeide gassosa.[7][3][6]
Solo nel 2019 il giicole metilenico e la paraformaldeide sono stati introdotti tra le sostanze espressamente proibite nel cosmetico UE[9], mentre la FDA negli USA non ha adottato nessuna restrizione specifica.[51]
L'"equivalenza" tossicologica tra glicole metilenico e formaldeide dipenderebbe praticamente dalla difficoltà analitica nel distinguere le due sostanze senza turbare l'equilibrio che le lega e dal fatto che moltissimi test tossicologici in passato sono stati eseguiti con soluzioni in acqua di glicole metilenico, considerate però soluzioni di formaldeide.
La contestazione del concetto di equivalenza si basa sulla sostanziale differenza chimico-fisica tra le due sostanze, oltre che per la reattività minore del GM rispetto a quella della FA. Anche in fase vapore a 200 °C solo il 49% del GM si disidrata formando FA.[52] Inoltre vari studi concluderebbero che sarebbe proprio l'umidità e l'assorbimento in acqua della formaldeide a ridurre alcuni dei rischi specifici della sostanza gassosa.[53][54]
Note[modifica | modifica wikitesto]
- ^ scheda della formalina satura con almeno il 10% di metanolo su [Gestis https://gestis-database.dguv.de/data?name=010520]
- ^ a b David R. Kent, Susanna L. Widicus e Geoffrey A. Blake, A theoretical study of the conversion of gas phase methanediol to formaldehyde, in The Journal of Chemical Physics, vol. 119, n. 10, 8 settembre 2003, pp. 5117-5120, DOI:10.1063/1.1596392. URL consultato il 14 febbraio 2021.
- ^ a b c Position Statement of the American Chemistry Council’s Formaldehyde Panel on the Formaldehyde Content of Certain Hair-Care Products (PDF), su americanchemistry.com. URL consultato il 19 febbraio 2021 (archiviato dall'url originale il 25 gennaio 2021).
- ^ a b Walker, J. Frederic (Joseph Frederic), (1903- ...)., Auteur., Formaldehyde, Robert E. Krieger, 1975, OCLC 491563407. URL consultato il 18 febbraio 2021.
- ^ CosIng - Cosmetics - FORMALDEHYDE- European Commission, su ec.europa.eu. URL consultato il 16 febbraio 2021.
- ^ a b c d (EN) Ivan J. Boyer, Bart Heldreth e Wilma F. Bergfeld, Amended Safety Assessment of Formaldehyde and Methylene Glycol as Used in Cosmetics, in International Journal of Toxicology, vol. 32, 6_suppl, 1º novembre 2013, pp. 5S–32S, DOI:10.1177/1091581813511831. URL consultato il 13 febbraio 2021.
- ^ a b c (EN) (PDF) Scientific Committee on Consumer Safety. SCCS Opinion on Methylene Glycol to be Considered Equivalent to Formaldehyde, su ResearchGate. URL consultato il 13 febbraio 2021.
- ^ (EN) Center for Food Safety and Applied Nutrition, Hair-Smoothing Products That Release Formaldehyde When Heated, in FDA, 8 settembre 2020. URL consultato il 13 febbraio 2021.
- ^ a b CosIng - Cosmetics - METHYLENE GLYCOL - European Commission, su ec.europa.eu. URL consultato il 18 febbraio 2021.
- ^ Unione Europea- Comitato scientifico: Methylene glycol in hair straighteners (PDF), su ec.europa.eu.
- ^ a b (NL) Absorption of Formaldehyde in Water - [PDF Document], su fdocuments.nl. URL consultato il 9 febbraio 2021.
- ^ a b J.G.M Winkelman, O.K Voorwinde e M Ottens, Kinetics and chemical equilibrium of the hydration of formaldehyde, in Chemical Engineering Science, vol. 57, n. 19, 2002-10, pp. 4067-4076, DOI:10.1016/s0009-2509(02)00358-5. URL consultato il 9 febbraio 2021.
- ^ S. Inaba, Theoretical study of decomposition of methanediol in aqueous solution., in The journal of physical chemistry. A, 2015, DOI:10.1021/acs.jpca.5b02846. URL consultato l'8 febbraio 2021.
- ^ a b c d (EN) J. G. M Winkelman, M Ottens e A. A. C. M Beenackers, The kinetics of the dehydration of methylene glycol, in Chemical Engineering Science, vol. 55, n. 11, 1º giugno 2000, pp. 2065-2071, DOI:10.1016/S0009-2509(99)00498-4. URL consultato l'8 febbraio 2021.
- ^ M. G. Burnett, The mechanism of the formaldehyde clock reaction: Methylene glycol dehydration, in Journal of Chemical Education, vol. 59, n. 2, 1982-02, p. 160, DOI:10.1021/ed059p160. URL consultato l'8 febbraio 2021.
- ^ (EN) Michael Albert, Baudilio Coto García e Cornelius Kreiter, Vapor-liquid and chemical equilibria of formaldehyde-water mixtures, in AIChE Journal, vol. 45, n. 9, 1999-09, pp. 2024-2033, DOI:10.1002/aic.690450919. URL consultato l'11 febbraio 2021.
- ^ N. Matubayasi, Saiko Morooka e M. Nakahara, Chemical equilibrium of formaldehyde and methanediol in hot water : Free-energy analysis of the solvent effect, 2007, DOI:10.1016/J.MOLLIQ.2006.12.002. URL consultato l'8 febbraio 2021.
- ^ a b c Iliceto, A. (1954). Sul sistema acque-formaldeide. Nota VI. Equilibri della fasi liquida e gassosa. Gazz.Chim. Ital., 84, 536-552.
- ^ W.A.E. McBryde, Spectrophotometric determination of equilibrium constants in solution☆, in Talanta, vol. 21, n. 10, 1974-10, pp. 979-1004, DOI:10.1016/0039-9140(74)80130-x. URL consultato il 12 febbraio 2021.
- ^ H. C. Sutton e T. M. Downes, Rate of hydration of formaldehyde in aqueous solution, in Journal of the Chemical Society, Chemical Communications, n. 1, 1972, p. 1, DOI:10.1039/c39720000001. URL consultato il 12 febbraio 2021.
- ^ a b Andreas A. Zavitsas, Mark Coffiner e Thomas Wiseman, Reversible hydration of formaldehyde. Thermodynamic parameters, in The Journal of Physical Chemistry, vol. 74, n. 14, 1970-07, pp. 2746-2750, DOI:10.1021/j100708a003. URL consultato il 14 febbraio 2021.
- ^ a b (EN) W. M. D. Bryant e John B. Thompson, Chemical thermodynamics of polymerization of formaldehyde in an aqueous environment, in Journal of Polymer Science Part A-1: Polymer Chemistry, vol. 9, n. 9, 1971, pp. 2523-2540, DOI:10.1002/pol.1971.150090909. URL consultato il 14 febbraio 2021.
- ^ Edwards, J., 2013. Quantitative 1 H NMR Analysis Formalin – Observation of Free Formaldehyde as Methanal, Process NMR Associates LLC.
- ^ a b Michal Rivlin, Uzi Eliav e Gil Navon, NMR Studies of the Equilibria and Reaction Rates in Aqueous Solutions of Formaldehyde, in The Journal of Physical Chemistry B, vol. 119, n. 12, 12 marzo 2015, pp. 4479-4487, DOI:10.1021/jp513020y. URL consultato il 14 febbraio 2021.
- ^ J.Masamoto, K.Matsuzaki - A Study of Vapor-Liquid Equilibrium of Formaldehyde-Water Mixtures Using Chemical Theory, su jstage.jst.go.jp.
- ^ Michael Ott, Reaktionskinetik und Destillation formaldehydhaltiger Mischungen, 2004, ISBN 978-3-8322-3336-5, OCLC 76544476. URL consultato il 16 febbraio 2021.
- ^ Raphael Kircher, Niklas Schmitz e Jürgen Berje, Generalized Chemical Equilibrium Constant of Formaldehyde Oligomerization, in Industrial & Engineering Chemistry Research, vol. 59, n. 25, 24 giugno 2020, pp. 11431-11440, DOI:10.1021/acs.iecr.0c00974. URL consultato l'8 febbraio 2021.
- ^ Chiamato anche glicole dimetilenico da alcuni autori
- ^ (EN) Michal Rivlin, Uzi Eliav e Gil Navon, NMR Studies of the Equilibria and Reaction Rates in Aqueous Solutions of Formaldehyde, in The Journal of Physical Chemistry B, vol. 119, n. 12, 26 marzo 2015, pp. 4479-4487, DOI:10.1021/jp513020y. URL consultato il 14 febbraio 2021.
- ^ (EN) A. L. Balashov, V. L. Krasnov e S. M. Danov, Formation of Cyclic Oligomers in Concentrated Aqueous Solutions of Formaldehyde, in Journal of Structural Chemistry, vol. 42, n. 3, 1º maggio 2001, pp. 398-403, DOI:10.1023/A:1012408904389. URL consultato il 12 febbraio 2021.
- ^ Thomas Grützner, Hans Hasse e Neven Lang, Development of a new industrial process for trioxane production, in Chemical Engineering Science, vol. 62, n. 18-20, 2007-09, pp. 5613-5620, DOI:10.1016/j.ces.2007.01.047. URL consultato il 12 febbraio 2021.
- ^ (EN) Michael Maiwald, Thomas Grützner e Eckhard Ströfer, Quantitative NMR spectroscopy of complex technical mixtures using a virtual reference: chemical equilibria and reaction kinetics of formaldehyde–water–1,3,5-trioxane, in Analytical and Bioanalytical Chemistry, vol. 385, n. 5, pp. 910-917. URL consultato il 16 febbraio 2021.
- ^ Nils Landqvist, Agnar P. Nygaard e Roger Bonnichsen, On the Polarography of Formaldehyde., in Acta Chemica Scandinavica, vol. 9, 1955, pp. 867-892, DOI:10.3891/acta.chem.scand.09-0867. URL consultato il 16 febbraio 2021.
- ^ Valenta, P. Oszillographischestrom-Spannungs-Kurven III.Un- tersuchung Des Formaldehyds in Gepuffertem Milieu. Collect. Czech.Chem. Commun. 1960,25, 853−86
- ^ Michal Rivlin, Uzi Eliav e Gil Navon, NMR studies of proton exchange kinetics in aqueous formaldehyde solutions, in Journal of Magnetic Resonance, vol. 242, 2014-05, pp. 107-112, DOI:10.1016/j.jmr.2014.02.021. URL consultato il 12 febbraio 2021.
- ^ (EN) 1-(13)-C-SODIUM-FORMATE - 13C NMR - Chemical Shifts - SpectraBase, su spectrabase.com. URL consultato il 16 febbraio 2021.
- ^ NMR Spectroscopy, su organicchemistrydata.org. URL consultato il 16 febbraio 2021.
- ^ Detlef Emeis, Willem Anker e Klaus-Peter Wittern, Quantitative13C NMR Spectroscopic Studies on the Equilibrium of Formaldehyde with Its Releasing Cosmetic Preservatives, in Analytical Chemistry, vol. 79, n. 5, 2007-03, pp. 2096-2100, DOI:10.1021/ac0619985. URL consultato il 16 febbraio 2021.
- ^ (EN) Michael Albert, Baudilio Coto García e Cornelius Kreiter, Vapor-liquid and chemical equilibria of formaldehyde-water mixtures, in AIChE Journal, vol. 45, n. 9, 1999, pp. 2024-2033, DOI:10.1002/aic.690450919. URL consultato l'8 febbraio 2021.
- ^ (EN) Liuyi Yin, Yongbo Li e Yanlin He, Modeling vapour-liquid phase equilibrium for the aqueous solutions of formaldehyde and electrolyte, in The Journal of Chemical Thermodynamics, vol. 150, 2020-11, p. 106181, DOI:10.1016/j.jct.2020.106181. URL consultato l'11 febbraio 2021.
- ^ (EN) Xianming Zhang, Yufeng Hu e Weiting Ma, Vapor–liquid and chemical equilibria model for formaldehyde + 1,3,5-trioxane + methanol + salt + water system, in Fluid Phase Equilibria, vol. 507, 2020-03, p. 112434, DOI:10.1016/j.fluid.2019.112434. URL consultato l'11 febbraio 2021.
- ^ (EN) M. Detcheberry, P. Destrac e X. -M. Meyer, Phase equilibria of aqueous solutions of formaldehyde and methanol: Improved approach using UNIQUAC coupled to chemical equilibria, in Fluid Phase Equilibria, vol. 392, 25 aprile 2015, pp. 84-94, DOI:10.1016/j.fluid.2015.02.011. URL consultato il 18 febbraio 2021.
- ^ (EN) Jürgen Berje, Jakob Burger e Hans Hasse, NMR spectroscopic study of chemical equilibria in solutions of formaldehyde, water, and butynediol, in AIChE Journal, vol. 63, n. 10, 2017-10, pp. 4442-4450, DOI:10.1002/aic.15788. URL consultato il 16 febbraio 2021.
- ^ a b Katarzyna Z. Gaca, John A. Parkinson e Leo Lue, Equilibrium Speciation in Moderately Concentrated Formaldehyde–Methanol–Water Solutions Investigated Using13C and1H Nuclear Magnetic Resonance Spectroscopy, in Industrial & Engineering Chemistry Research, vol. 53, n. 22, 18 febbraio 2014, pp. 9262-9271, DOI:10.1021/ie403252x. URL consultato l'8 febbraio 2021.
- ^ Stanley J. Green e Raymond E. Vener, Vapor-Liquid Equilibria of Formaldehyde-Methanol-Water, in Industrial & Engineering Chemistry, vol. 47, n. 1, 1955-01, pp. 103-109, DOI:10.1021/ie50541a037. URL consultato il 9 febbraio 2021.
- ^ Michael Ott, Hartmut Schoenmakers e Hans Hasse, Distillation of formaldehyde containing mixtures: laboratory experiments, equilibrium stage modeling and simulation, in Chemical Engineering and Processing: Process Intensification, vol. 44, n. 6, 2005-06, pp. 687-694, DOI:10.1016/j.cep.2003.09.011. URL consultato l'11 febbraio 2021.
- ^ (EN) Stefano Brandani, Vincenzo Brandani e Gabriele Di Giacomo, The system formaldehyde-water-methanol: thermodynamics of solvated and associated solutions, in Industrial & Engineering Chemistry Research, vol. 31, n. 7, 1992-07, pp. 1792-1798, DOI:10.1021/ie00007a026. URL consultato l'11 febbraio 2021.
- ^ (EN) Michael Albert, Baudilio Coto García e Christian Kuhnert, Vapor–liquid equilibrium of aqueous solutions of formaldehyde and methanol, in AIChE Journal, vol. 46, n. 8, 2000-08, pp. 1676-1687, DOI:10.1002/aic.690460818. URL consultato l'11 febbraio 2021.
- ^ Niklas Schmitz, Fabian Homberg e Jürgen Berje, Chemical Equilibrium of the Synthesis of Poly(oxymethylene) Dimethyl Ethers from Formaldehyde and Methanol in Aqueous Solutions, in Industrial & Engineering Chemistry Research, vol. 54, n. 25, 1º luglio 2015, pp. 6409-6417, DOI:10.1021/acs.iecr.5b01148. URL consultato l'11 febbraio 2021.
- ^ (EN) Robin T. Garrod, Susanna L. Widicus Weaver e Eric Herbst, Complex Chemistry in Star‐forming Regions: An Expanded Gas‐Grain Warm‐up Chemical Model, in The Astrophysical Journal, vol. 682, n. 1, 20 luglio 2008, pp. 283-302, DOI:10.1086/588035. URL consultato il 13 febbraio 2021.
- ^ (EN) FDA Emails: Scientists Pushed To Ban Formaldehyde-Based Hair-Smoothing Treatments as Early as 2015, su EWG. URL consultato il 18 febbraio 2021.
- ^ (EN) R. Golden e M. Valentini, Formaldehyde and methylene glycol equivalence: Critical assessment of chemical and toxicological aspects, in Regulatory Toxicology and Pharmacology, vol. 69, n. 2, 2014-07, pp. 178-186, DOI:10.1016/j.yrtph.2014.03.007. URL consultato il 12 febbraio 2021.
- ^ E. Priha, J. Liesivuori e H. Santa, Reactions of hydrated formaldehyde in nasal mucus, in Chemosphere, vol. 32, n. 6, 1996-03, pp. 1077-1082, DOI:10.1016/0045-6535(96)00015-x. URL consultato il 14 febbraio 2021.
- ^ Jeffry D. Schroeter, Jerry Campbell e Julia S. Kimbell, Effects of endogenous formaldehyde in nasal tissues on inhaled formaldehyde dosimetry predictions in the rat, monkey, and human nasal passages, in Toxicological Sciences: An Official Journal of the Society of Toxicology, vol. 138, n. 2, 2014-04, pp. 412-424, DOI:10.1093/toxsci/kft333. URL consultato il 14 febbraio 2021.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Metandiolo
Wikimedia Commons contiene immagini o altri file su Metandiolo
![{\displaystyle {\ce {H2CO +H2O<=>[1:2000] H2C(OH)2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7f00bf5aca3ff2cf6c7ee0bb92bb394b2ca46b6f)





![{\displaystyle {\ce {H(H2CO)OH + H(H2CO)OH <<=>[6:1] H(OCH2)2 OH + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/617ffdf9525610770aac5d0088d7075f780946cb)
![{\displaystyle {\ce {H(H2CO)_3OH <=>[H+] (H2CO)_3 + H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/20e5053027d726c27c8143b87b3913e6c91e71e3)

