Tigeciclina
| Tigeciclina | |
|---|---|
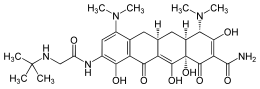 | |
| Nome IUPAC | |
| N-[(5aR,6aS,7S,9Z,10aS)-9-[ammino(idrossi)metilidene]-4,7-bis(dimetilammino)-1,10a,12-triidrossi-8,10,11-triosso-5,5a,6,6a,7,8,9,10,10a,11-decaidrotetracen-2-yl]-2-(tert-butilammino)acetammide | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C29H39N5O8 |
| Massa molecolare (u) | 585,65 g/mol |
| Numero CAS | |
| Numero EINECS | 685-736-6 |
| Codice ATC | J01 |
| PubChem | 5282044 CID 5282044 |
| DrugBank | DB00560 |
| SMILES | CC(C)(C)NCC(=O)NC1=CC(=C2C(=C1O)C(=O)C3=C(C4(C(CC3C2)C(C(=C(C4=O)C(=O)N)O)N(C)C)O)O)N(C)C |
| Dati farmacologici | |
| Categoria farmacoterapeutica | Glicilcicline |
| Teratogenicità | classe D (valutazione ADEC) |
| Modalità di somministrazione | endovena |
| Dati farmacocinetici | |
| Biodisponibilità | NA |
| Metabolismo | Non metabolizzato |
| Emivita | 42.4 ore |
| Escrezione | biliare, renale |
| Indicazioni di sicurezza | |
La tigeciclina è un antibiotico glicilciclinico[1][2] sviluppato da Francis Tally e prodotto dalla casa farmaceutica Wyeth con il nome di Tygacil.[3] Ha ricevuto l'approvazione della Food and Drug Administration (FDA) il 17 giugno 2005. È stato sviluppato in seguito agli episodi di resistenza agli antibiotici di alcuni batteri che sviluppano pompe di efflusso, quali Staphylococcus aureus e Acinetobacter baumannii.[4]
Meccanismo d'azione[modifica | modifica wikitesto]
La tigeciclina è un batteriostatico che interferisce con la sintesi delle proteine batteriche legandosi in modo reversibile alla subunità ribosomiale 30S, bloccando l'entrata dell'ammino-acil tRNA nel sito A del ribosoma.[5]
Dosaggi[modifica | modifica wikitesto]
La tigeciclina è somministrata per infusione venosa lenta (da 30 a 60 minuti). La dose iniziale è di 100 mg, seguita da dosi di 50 mg ogni dodici ore. I pazienti con funzioni vitali compromesse possono necessitare di dosaggi più bassi. Ai pazienti con disfunzioni epatiche è solitamente prescritta una dose di mantenimento di 25 mg ogni dodici ore in luogo degli usuali 50 mg, l'alterazione renale non è invece motivo di variazione. Non sono previste dosi pediatriche, non essendo consigliata per i bambini, e non esistono forme di somministrazione orale.[6]
Usi clinici[modifica | modifica wikitesto]
La tigeciclina è attiva contro i batteri Gram positivi e Gram negativi, compresi batteri resistenti alle tetracicline, e contro alcuni anaerobi. È attiva anche contro Staphylococcus aureus resistente alla meticillina e contro gli enterococchi resistenti alla vancomicina, anche se molti ceppi di Proteus e di Pseudomonas aeruginosa ne sono resistenti. È impiegata inoltre nelle terapie sperimentali contro il C. difficile. L'uso della tigeciclina deve essere riservato al trattamento delle infezioni complicate della cute e dei tessuti molli e delle infezioni complicate dell'addome causate da microrganismi resistenti a più antibiotici.[7]
Effetti collaterali[modifica | modifica wikitesto]
La tigeciclina ha effetti collaterali simili a quelli delle tetracicline.
I più comuni tra questi sono diarrea, nausea e vomito. Nausea e vomito si protraggono solitamente per i primi due giorni della terapia.
Altri effetti indesiderati includono dolore nel sito di iniezione, gonfiore e irritazione.
È vietato l'utilizzo su bambini e donne in stato di gravidanza a causa dei danni provocati su ossa e denti.
Come per tutti gli antibiotici è possibile un aumento del numero di batteri resistenti.[8]
Note[modifica | modifica wikitesto]
- ^ Rose W, Rybak M, Tigecycline: first of a new class of antimicrobial agents., in Pharmacotherapy, vol. 26, n. 8, 2006, pp. 1099–110, DOI:10.1592/phco.26.8.1099, PMID 16863487.
- ^ Kasbekar N, Tigecycline: a new glycylcycline antimicrobial agent., in Am J Health Syst Pharm, vol. 63, n. 13, 2006, pp. 1235–43, DOI:10.2146/ajhp050487, PMID 16790575.
- ^ Steven J Projan, Francis Tally and the discovery and development of tigecycline: a personal reminiscence, in Clin. Infect. Dis., 50 Suppl 1, Jan. 2010, pp. S24–5, DOI:10.1086/647941, PMID 20067389.
- ^ Kumarasamy et. al., Mark A Toleman, Timothy R Walsh, Jay Bagaria, Fafhana Butt, Ravikumar Balakrishnan, Uma Chaudhary, Michel Doumith e Christian G Giske, Emergence of a new antibiotic resistance mechanism in India, Pakistan, and the UK: a molecular, biological, and epidemiological study, in The Lancet Infectious Diseases, vol. 10, n. 9, 2010, pp. 597–602, DOI:10.1016/S1473-3099(10)70143-2, PMC 2933358, PMID 20705517.
- ^ Tigecycline: A Novel Broad-Spectrum Antimicrobial: Pharmacology and Mechanism of Action Christine M. Slover, PharmD, Infectious Diseases Fellow, Keith A. Rodvold, PharmD and Larry H. Danziger, PharmD, Professor, Department of Pharmacy Practice, University of Illinois at Chicago, Chicago, IL
- ^ Riassunto caratteristiche del prodotto, su torrinomedica.it. URL consultato il 5 febbraio 2012.
- ^ Il nuovo antibiotico a largo spettro Tygacil[x] (tigeciclina) riceve oggi l'approvazione all'uso in Europa, su prnewswire.co.uk. URL consultato il 5 febbraio 2012.
- ^ (EN) FDA Drug Safety Communication: Increased risk of death with Tygacil (tigecycline) compared to other antibiotics used to treat similar infections, su fda.gov. URL consultato il 5 febbraio 2012.
Bibliografia[modifica | modifica wikitesto]
- Opinion of the Committee for Medicinal Products for Human Use on the Granting of a Marketing Authorisation for Tygacil(TM) (tigecycline) - Annex I: Summary of Product Characteristics. London, UK: European Medicines Agency, February 23, 2006.
- Goosens H, Ferech M, Stichele RV, et al, for the ESAC Project Group. Outpatient antibiotic use in Europe and association with resistance; a cross-national database study. Lancet. 2005; 365: 579-587.
- Shlaes DM, Gerding DN, John JF Jr, et al. Society for Healthcare Epidemiology of America and Infectious Diseases Society of America Joint Committee on the Prevention of Antimicrobial Resistance: Guidelines for the Prevention of Antimicrobial Resistance in Hospitals. Clin Infec Dis. 1997; 25: 584-599.
- Cosgrove SE, Carmeli Y. The impact of antimicrobial resistance on health and economic outcomes. Clin Infect Dis. 2003; 36: 1433-1437.
- Levy SB. Active efflux, a common mechanism for biocide and antibiotic resistance. J App Microbiol. 2002; 92: 65S-71S.
- Poole K. Mechanisms of bacterial biocide and antibiotic resistance. J App Microbiol. 2002; 92: 55S-64S.
- Paolo Romanelli, Kerdel Franciso A, Trent Jennifer T, Manuale di terapia dermatologica, Milano, McGraw-Hill, 2006, ISBN 88-386-3913-2.
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Tigeciclina
Wikimedia Commons contiene immagini o altri file su Tigeciclina
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) Tygacil ( tigecycline iv ): Antibiotic for Skin Infections, su tygacil.com. URL consultato il 3 febbraio 2012 (archiviato dall'url originale il 6 luglio 2008).
- informazionisuifarmaci.it, http://www.informazionisuifarmaci.it/database/fcr/sids.nsf/stampa/482D8EC38C560D70C12573AA002E4FE6?OpenDocument.