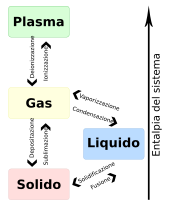
Solido

Si definisce solido una porzione di materia che si trova in uno stato condensato caratterizzato da resistenza a deformazione e a variazioni di volume. La branca della fisica che si occupa dei solidi è detta fisica dello stato solido, mentre la chimica dello stato solido si concentra principalmente sulla natura e sulle proprietà chimiche e chimico-fisiche dei solidi. Lo studio dei materiali solidi rientra nella Scienza dei materiali e nella Tecnologia dei materiali. Lo studio del comportamento meccanico del corpo solido è oggetto della meccanica dei solidi.
Caratteristiche dei solidi[modifica | modifica wikitesto]
Alla scala microscopica, le particelle (atomi, molecole o ioni) che compongono un solido:
- sono fortemente stipate tra loro
- oscillano attorno a posizioni relative fisse nello spazio[1] (moto di agitazione termica)
- reagiscono ai cambiamenti di forma e di volume con sforzi che sono funzione dell'entità della deformazione subita.
Dal punto di vista macroscopico, il concetto di solido si identifica con il concetto di materiale solido e di corpo solido.
Nel modello di corpo solido rientrano gran parte degli elementi strutturali più comuni (travi, piastre, membrane, ecc.) di cui la meccanica delle strutture fornisce una rappresentazione semplificata del comportamento. I solidi hanno una struttura molto rigida e sono incomprimibili.
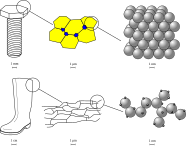
Cristallinità dei solidi[modifica | modifica wikitesto]
I solidi possono essere distinti in cristallini e amorfi a seconda che sia individuabile o no una struttura regolare nella disposizione delle particelle che li compongono.[2]
La struttura cristallina di un solido ne influenza profondamente le proprietà: per esempio, come andremo a vedere successivamente nel paragrafo dedicato ai solidi covalenti, la grafite pura e il diamante sono entrambi costituiti da atomi di carbonio che differiscono tra di loro solo per il reticolo cristallino, eppure tali materiali presentano valori di durezza e caratteristiche esteriori (colore e indice di rifrazione) assai differenti.
Solidi cristallini[modifica | modifica wikitesto]

I solidi cristallini hanno un valore del punto di fusione ben definito[3] e spesso presentano comportamenti differenti in diverse direzioni di misurazione, cioè sono generalmente anisotropi.[4] In presenza di un solvente molto polare (come l'acqua) danno luogo a soluzioni in cui gli ioni esistono solvatati in fase liquida. Sia tali soluzioni, sia i solidi ionici fusi sono in grado di condurre la corrente elettrica, mentre allo stato solido ciò non è possibile perché gli elettroni sono implicati rigidamente nel legame ionico così come lo sono gli ioni.
I solidi cristallini presentano facce ed angoli ben definiti e visibili ad occhio nudo. Le loro particelle possiedono una disposizione assai ordinata a massimo impacchettamento, con periodicità a lungo raggio. In questo modo favoriscono il più possibile le interazioni cercando di ottenere la minima energia.[5]
I solidi cristallini possono essere ulteriormente classificati in base alla disposizione spaziale assunta dalle particelle che li compongono, ossia dal loro reticolo cristallino e dall'essere formati da un singolo cristallo (monocristalli) o da più cristalli (policristalli) aggregati tra loro. I monocristalli sono sfruttati in laboratorio per la caratterizzazione dei solidi cristallini tramite metodiche quali la diffrazione dei raggi X, la spettroscopia di diffrazione elettronica e la spettroscopia fotoelettronica.
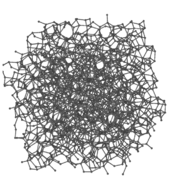
Solidi amorfi[modifica | modifica wikitesto]
I solidi amorfi non presentano né facce né angoli e le loro molecole sono disposte in modo estremamente caotico, senza periodicità a lungo raggio.
I solidi amorfi, come conseguenza della loro struttura casuale, sono caratterizzati da maggior contenuto entropico rispetto ai solidi ionici e non hanno punto di fusione ben definito[3](i legami tra le particelle non hanno tutti la stessa forza) e costante nel tempo. Hanno la caratteristica di essere materiali isotropi[3] e non sono solubili nei comuni solventi.
Sono liquidi con una viscosità talmente elevata da non poter fluire.
Spesso i materiali amorfi sono paragonati a liquidi sottoraffreddati,[6] aventi valori estremamente elevati di viscosità.
Solidi semicristallini[modifica | modifica wikitesto]
Un discorso a parte meritano i materiali polimerici, nei quali generalmente zone a struttura regolare (cristallina) coesistono frammiste con zone a struttura irregolare (amorfa), per cui tali materiali sono detti "semicristallini" e in essi il rapporto tra fase amorfa e fase cristallina è variabile a seconda del particolare campione preso in esame.
La fase amorfa e la fase cristallina possono cambiare a seconda della temperatura a cui il materiale è sottoposto. La fase amorfa può diventare fase amorfa VETROSA dove la fase cristallina non cambia, oppure si può avere una fase AMORFA GOMMOSA (la temperatura cambia a seconda del materiale) in cui anche qui la fase cristallina non cambia. Infine si può avere una fase dove cambiano entrambe che è chiamata fase FLUIDA.
Solidi covalenti[modifica | modifica wikitesto]
Ci sono poi i solidi covalenti, sono sostanze insolubili in qualsiasi solvente polare e apolare. Sono caratterizzati da alti punti di fusione e da un’elevata resistenza alle sollecitazioni. Gli atomi di questi solidi, come si può intuire dal nome, sono uniti tra di loro da legami covalenti.
Alcuni esempi di solidi covalenti sono il diamante (C) o il quarzo (SiO2).
I solidi covalenti sono le eccezioni più notevoli alla regola del massimo impacchettamento. Il legame covalente infatti è direzionale per cui l'impacchettamento non è ideale. La stabilità del composto viene raggiunta quando gli atomi sforano il numero permesso di legami covalenti e non quando sono circondati dal maggior numero possibile di altri atomi.
I solidi covalenti quando si legano formano reticoli di atomi. A seconda di quale conformazione abbiano questi ultimi e del tipo di legame che instaurano, creano strutture più deboli o più forti. Ciò si può notare ad esempio nel diamante e nella grafite che sono entrambe composti da atomi di carbonio legati però in modo diverso rendendo il primo estremamente duro e uno scarso conduttore, mentre la seconda facilmente sfaldabile, tenera al tatto e un buon conduttore.
Un altro esempio di solido covalente, come abbiamo detto prima, è il quarzo che presenta un reticolo esteso in cui ogni ossigeno è a ponte con un altro silicio. Questo perché l’ossigeno non trova guadagno a formare doppi legami che sono invece caratteristici degli elementi del secondo periodo.
Solidi molecolari: Legami deboli[modifica | modifica wikitesto]
I solidi molecolari sono sostanze le cui molecole sono attratte tra di loro grazie a quattro tipi di legami o forze:
- al legame dipolo-dipolo
- al legame a idrogeno
- alle forze di London.
- alle forze di Van Der Walls
I nodi del loro reticolo sono tenuti assieme da legami chimici secondari e visto che quest’ultimi sono generalmente deboli le sostanze che compongono hanno un basso punto di fusione.
I solidi molecolari sono poco duri (hanno una bassa energia di legame intramolecolare) e sono deformabili per via del legame adirezionale.
I solidi molecolari si possono anche distinguere a seconda che le loro molecole siano polari o apolari.
- le sostanze costituite da molecole apolari presentano legami deboli fra le molecole e forti legami all’interno della molecola. A condizioni normali si trovano in genere allo stato gassoso. Se invece si presentano allo stato solido sono teneri e hanno un punto di fusione basso. Si possono trovare anche in forma liquida come il bromo (Br2) che ha un punto di fusione assai modesto. In generale sono tutti solubili in solventi apolari come il benzene e il cloroformio e non sono conduttori di corrente né allo stato solido, perché hanno elettroni localizzati sulle molecole, né allo stato liquido dato che le molecole sono neutre.
- le sostanze caratterizzate da molecole polari hanno legami intermolecolari più forti di quelli delle sostanze apolari. Presentano temperature di fusione e ebollizione molto più alte e sono solubili solo in solventi polari. A questo gruppo appartengono molti solidi come il comune zucchero da cucina e, sotto forma di ghiaccio, anche l’acqua stessa.[7]
Solidi Metallici[modifica | modifica wikitesto]
Nei solidi metallici i cationi si posizionano secondo un reticolo ordinato e il più possibile in contiguità tra loro limitando gli spazi vuoti che assumono il nome di lacune. Essi si ritrovano immersi in una nube di elettroni mobile e delocalizzata. Le caratteristiche dei metalli sono dunque dovute alla mancanza di direzionalità delle cariche. I blocchi di cariche ad esempio possono scivolare gli uni sugli altri non rompendo i legami. Anche successivamente ad una traslazione rimangono invariate le forze attrattive esercitate dagli elettroni.
Le caratteristiche dei solidi metallici sono:
- La lucentezza→ è una proprietà osservabile quando una radiazione colpisce la nube di elettroni che si eccitano e emettono a loro volta luce.
- La duttilità→ è la capacità dei metalli di potere essere ridotti in lamine.
- La malleabilità→ è la capacità dei metalli di poter essere ridotti in fili.
- La conducibilità elettrica→ diminuisce all'aumentare della temperatura dato che accresce il numero di oscillazioni degli atomi.
- La conducibilità termica
- L’effetto fotoelettrico→ è un fenomeno consistente nell’emissione di elettroni da parte del metallo. È scaturito dal fatto che la superficie metallica è colpita da una radiazione elettromagnetica avente una frequenza superiore ad un valore soglia caratteristico di ciascun metallo.
- L’effetto termoionico→ è un fenomeno per cui il metallo a causa di un riscaldamento, superiore ad una certa temperatura soglia, rilascia elettroni.
Quando gli orbitali atomici si combinano tra loro portano alla formazione di orbitali molecolari. Questi ultimi hanno energie così ravvicinate da formare delle bande. Quando molti orbitali molecolari sono compresi in una stessa banda gli elettroni non sono più limitati dai propri nuclei, ma possono passare da un orbitale molecolare all’altro appartenente alla stessa banda di energia.

Le bande possono essere divide in:
- Banda di valenza: è data dall’interazione tra orbitali atomici esterni ad energia più bassa. Può essere riempita interamente o parzialmente da elettroni.
- Banda di conduzione: è originata dall’interazione di orbitali atomici a più alta energia. È solitamente vuota.
I due tipi di bande possono essere adiacenti, parzialmente sovrapposti o separati da un'altra banda detta proibita.
I metalli suddividono in:
- Conduttori: l'ampia sovrapposizione degli orbitali di valenza dei singoli atomi determina la formazione di orbitali molecolari delocalizzati e ravvicinati. La banda di valenza e quella di conduzione sono adiacenti o parzialmente sovrapposte. Gli elettroni vengono facilmente promossi da una banda all’altra generando con il loro movimento una corrente elettrica. La resistenza nei conduttori cresce all'aumentare della temperatura.
- Semiconduttori: si ha un intervallo tra la banda di valenza e la banda di conduzione, vuota o semipiena, esiguo, ma maggiore di quella di un metallo. Basta fornire poca energia per causare il salto energetico. I semiconduttori hanno una resistenza che si riduce all'aumentare della temperatura.
Il drogaggio di un materiale è l’inserimento controllato di sostanze con eccesso o mancanza di elettroni in modo da aumentare la conduttività dei semiconduttori.
- Isolanti: il salto energetico tra la banda di valenza e quella di conduzione è troppo ampio. Hanno una resistenza tanto elevata da non condurre elettricità.[8]
Solidi ionici[modifica | modifica wikitesto]
I solidi ionici sono uniti tra loro dalla forza elettrostatica dei legami ionici, più precisamente sono reticoli cristallini composti da ioni di carica opposta.
La struttura dei solidi ionici è caratterizzata da anioni che si dispongono il più vicino possibile tra loro fino a formare una struttura coesa dove nelle cavità si dispongono i cationi che hanno dimensioni minori. Ogni ione deve essere circondato dal maggior numero possibile di ioni con segno opposto e la distanza tra lo ione positivo e quello negativo deve essere minima. Si vanno a creare dunque le cosiddette celle elementari ripetute in sequenza.
La differenza nell’impaccamento nei solidi ionici rispetto a quelli metallici consta nel fatto che gli anioni ed i cationi non hanno le stesse dimensioni e devono oltretutto rispettare la stechiometria.[9]
Ad esempio, in NaCl la ripetizione spaziale coinvolge un elevato numero di strati. Ogni ione Na+ ha sotto uno ione Cl- e la distanza tra di loro è uguale in ogni strato. Ciascuno ione Na+ è pertanto circondato da 6 ioni Cl- che si ritrovano ad una stessa distanza r.
Il numero di coordinazione costituisce il maggior numero di anioni che è possibile mettere in contatto con i cationi (nel caso precedente di NaCl il numero di coordinazione è 6).
La valenza ionica invece indica quale è il numero di elettroni ceduti, oppure acquisiti nella formazione di un composto ionico da una sostanza.[10]
La costante di Madelung è un fattore geometrico che cambia a seconda della struttura cristallina del composto ionico ed è indipendente dalla natura chimica. È utilizzata con lo scopo di misurare il potenziale elettrostatico di uno ione all’interno di un cristallo. L’energia reticolare di un composto ionico può essere calcolata anche dai dati di entalpia sfruttando un ciclo termodinamico: il ciclo di Born-Haber. Sono da sommare l’energia di vaporizzazione, l’energia di ionizzazione e l’affinità elettronica ottenendo cosí l'energia reticolare sperimentale. Se il valore di quest’ultima, ricavata dal ciclo di Born Haber, corrisponde a quella teorica di un reticolo di cui sia nota il tipo di struttura e perciò anche la costante di Madelung, si può affermare che l'approssimazione che il legame sia puramente ionico è corretta.
Le proprietà dei solidi ionici sono:

- la durezza è la resistenza che le sostanze contrappongono alla scalfitura e quindi alla tenacia che gli atomi oppongono al loro reciproco allontanamento nel punto di incisura. Tale resistenza dipende dall’energia di legame tra gli atomi. Possiamo visualizzare la durezza dei vari composti sulla scala di Mohs dove il diamante sta al posto numero 10 che è il limite superiore della scala, mentre il talco occupa il limite inferiore ovvero il posto numero 1 (minima durezza).
- la fragilità consiste nella possibilità di frattura di un cristallo della sostanza. Essa è determinata dall’azione di sollecitazioni meccaniche esterne applicate sui legami direzionali propri dei solidi covalenti. Infatti la direzione dei legami covalenti non può variare in funzione della deformazione.
- la buona conduzione é presente solo quando i solidi ionici si trovano allo stato liquido (fusi o in soluzione acquosa). Allo stato liquido infatti gli ioni diventano in grado di muoversi acquisendo la capacità di condurre corrente.
- l’alta costante dielettrica
- gli elevati punti di fusione[11]
Note[modifica | modifica wikitesto]
- ^ (en) A. Goel, Crystallography, Discovery Publishing House, 2006, ISBN 81-8356-170-5 p.1.
- ^ L. Rolla, Chimica e mineralogia per le scuole superiori, 29a ed., dante alighieri, 1987 p. 90.
- ^ a b c (en) A. Goel, Crystallography, Discovery Publishing House, 2006, ISBN 81-8356-170-5 p.3.
- ^ Borchardt-Ott, p.4.
- ^ F.A. Bettelheim, W.H. Brown, M.K. Campbell, S.O. Farell, O.J. Torres, Chimica e Propedeutica a Biochimica, II edizione, Edises capitolo 5.9, ISBN 8879598414.
- ^ (en) A. Goel, Crystallography, Discovery Publishing House, 2006, ISBN 81-8356-170-5 p.2.
- ^ P. Atkins, L. Jones e L. Laverman, Principi di Chimica, IV edizione, Via Irnerio 34 40126 Bologna, Zanichelli, 2022., ISBN 9788808320971.
- ^ P. Atkins, L. Jones e L. Leverman, Principi di Chimica, IV edizione, Via Irnerio 34 40126 Bologna, Zanichelli, 2022 p. 240.
- ^ Andrea Manini, https://www.andreaminini.org/chimica/solidi/solidi-ionici#:~:text=I%20solidi%20ionici%20sono%20reticoli,atomiche%20con%20elettronegativit%C3%A0%20molto%20differente (Consultato il 31/05/2023), su andreaminini.org.
- ^ I. Bertini, C.Luchinat, F. Mani, Chimica, II edizione, viale Romagna 5 20089 Rozzano (Mi), Casa Editrice Ambrosiana, 2011 p.167.
- ^ G.Valitutti, A.Tifi, A. Gentile, Lineamenti di chimica, III edizione, Via Irnerio 34 40126 Bologna, Zanichelli, 2012, ISBN 9788808159328.
Bibliografia[modifica | modifica wikitesto]
- P. Atkins, L. Jones e L. Laverman, Principi di Chimica, IV edizione, Via Irnerio 34 40126 Bologna, Zanichelli, 2022 ISBN 9788808320971
- I. Bertini, C. Luchinat, F. Mani, Chimica, II edizione, viale Romagna 5 20089 Rozzano (Mi), Casa Editrice Ambrosiana, 2011
- F.A. Bettelheim, W.H. Brown, M.K. Campbell, S.O. Farell, O.J. Torres, Chimica e Propedeutica a Biochimica, II edizione, Edises
- Andrea Manini, I solidi ionici, caratteristiche e tipi di reticoli (Consultato il 31/05/2023)
- G.Valitutti, A.Tifi, A. Gentile, Lineamenti di chimica, III edizione, Via Irnerio 34 40126 Bologna, Zanichelli, 2012 ISBN 9788808159328
- Luigi Rolla, Chimica e mineralogia. per le scuole superiori, 29ª ed., dante alighieri, 1987
- (en) A. Goel, Crystallography, Discovery Publishing House, 2006, ISBN 81-8356-170-5
- (en) Walter Borchardt-Ott, Crystallography: An Introduction, Springer, 2011, ISBN 3-642-16452-8
Voci correlate[modifica | modifica wikitesto]
- Stato della materia
- Temperatura di transizione vetrosa
- Corpo continuo
- Meccanica del continuo
- Meccanica dei solidi
Altri progetti[modifica | modifica wikitesto]
 Wikizionario contiene il lemma di dizionario «solido»
Wikizionario contiene il lemma di dizionario «solido» Wikimedia Commons contiene immagini o altri file sul solido
Wikimedia Commons contiene immagini o altri file sul solido
Collegamenti esterni[modifica | modifica wikitesto]
- solido, su Treccani.it – Enciclopedie on line, Istituto dell'Enciclopedia Italiana.
- (EN) solid, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- Solido, in Treccani.it – Enciclopedie on line, Roma, Istituto dell'Enciclopedia Italiana.
| Controllo di autorità | Thesaurus BNCF 7835 · LCCN (EN) sh85124647 · GND (DE) 4016918-2 · BNF (FR) cb119358497 (data) · J9U (EN, HE) 987007556081205171 · NDL (EN, JA) 00566774 |
|---|