Teoria dei quanti
In fisica, con teoria dei quanti o vecchia teoria dei quanti (in inglese old quantum theory) si indica un insieme di teorie fisiche sviluppatesi nel primo quarto del XX secolo per spiegare una serie di fenomeni evidenziati dagli esperimenti, altrimenti inspiegabili nel quadro della meccanica classica.
Anticipatrice della meccanica quantistica, è definita una teoria semiclassica perché descrive fenomeni di natura quantistica sulla base dei postulati della meccanica classica, assieme ad alcune ipotesi formulate ad hoc.[1] Tra le più importanti di queste ipotesi vi sono la quantizzazione dell'energia per tutti i sistemi fisici, la quantizzazione della radiazione elettromagnetica sulla base di un comportamento particellare (il fotone), la dualità onda-particella.
La teoria dei quanti ha fornito una spiegazione euristica a vari fenomeni, tra i quali la radiazione di corpo nero, l'effetto fotoelettrico, l'effetto Compton, il calore specifico dei solidi, gli spettri atomici, la stabilità dell'atomo di idrogeno e la diffrazione di elettroni.
Radiazione di corpo nero[modifica | modifica wikitesto]

Nel 1859 il fisico tedesco Gustav Kirchhoff iniziò lo studio della radiazione elettromagnetica emessa da un corpo nero, ossia un corpo capace di assorbire tutta la radiazione incidente su di esso. Se il corpo è in equilibrio termico con l'ambiente circostante esso dovrà emettere a sua volta energia sotto forma di radiazione elettromagnetica. Successivamente alcuni esperimenti provarono che lo spettro elettromagnetico emesso da un corpo nero è una caratteristica indipendente dal materiale di cui è composto il corpo ed è legato solo alla temperatura del corpo stesso. Possiamo renderci conto del fatto che i corpi caldi emettano radiazione elettromagnetica a seconda della loro temperatura guardando, ad esempio, un pezzo di ferro rovente (di colore rosso) o il filamento di una lampadina (che emette luce bianca). Nel 1894 Wilhelm Wien mostrò a partire dalle leggi della termodinamica classica che la distribuzione dell'energia emessa da un corpo nero per unità di tempo e di area (radianza) in un certo intervallo di lunghezza d'onda deve essere descritto dalla legge:
L'energia irradiata è infatti dovuta ad onde stazionarie (o modi stazionari) della cavità emettente[2], ed in particolare è il risultato dell'equilibrio termodinamico fra tutti i modi possibili, le frequenze. Secondo l'elettromagnetismo classico, dunque, l'equilibrio termodinamico su tutte le frequenze ha come diretta conseguenza che per lunghezze d'onda molto piccole la radianza emessa dovrebbe essere infinita, dando luogo alla cosiddetta catastrofe ultravioletta. Ovviamente gli esperimenti confermarono che l'energia si mantiene finita anche nel limite di lunghezze d'onda piccole.
Nel 1900 Max Planck riuscì a derivare la forma corretta della distribuzione ipotizzando che l'energia assunta dagli oscillatori potesse essere solo un multiplo intero di una frequenza fondamentale.[3] Lo scambio di energia tra gli oscillatori e l'ambiente esterno era quindi discretizzato e doveva avvenire attraverso pacchetti di energia chiamati quanta (dal latino, quantus - quantità). L'ipotesi assunta da Planck non era giustificabile secondo la meccanica classica. Il fisico tedesco introdusse una costante , chiamata poi in suo onore costante di Planck (con le dimensioni fisiche di energia per tempo ), che lega il valore dell'energia elettromagnetica alla sua frequenza attraverso la formula
Tale formula descrive un quanto di energia, ovvero una quantità minima non ulteriormente suddivisibile.
Effetto fotoelettrico[modifica | modifica wikitesto]
Nel 1887, Heinrich Hertz scoprì l'effetto fotoelettrico mentre stava eseguendo gli esperimenti riguardanti le onde elettromagnetiche. L'effetto fotoelettrico consiste nell'emissione di elettroni da parte di metalli che vengono irraggiati con della luce ultravioletta. Esperimenti successivi delinearono le caratteristiche di queste effetto che consistono in:
- I metalli emettono sempre elettroni, non vengono mai emessi ioni positivi
- L'emissione degli elettroni dipende dalla lunghezza d'onda (o equivalentemente[4] dalla frequenza) della radiazione incidente. Si osserva che per ogni metallo esiste una frequenza di soglia caratteristica. L'emissione è possibile solo se la frequenza della luce incidente è superiore a quella di soglia)
- L'intensità della corrente prodotta per effetto fotoelettrico in un circuito (fotocorrente) è proporzionale all'intensità della radiazione incidente
- Non si osserva alcuni ritardo temporale tra l'irraggiamento e l'emissione degli elettroni (ossia, i fotoelettroni vengono rilevati non appena si inizia a irraggiare il corpo).
Nonostante il fenomeno fosse spiegabile a partire dalle leggi dell'elettromagnetismo classico alcuni caratteristiche di quest'effetto non potevano essere spiegate. In particolare, per l'elettromagnetismo classico l'energia trasportata da un'onda elettromagnetica è direttamente proporzionale alla sua intensità. Non era quindi spiegabile la dipendenza dell'emissione dei fotoelettroni dalla frequenza della radiazione incidente. Allo stesso modo, l'elettromagnetismo classico prevedeva che l'energia trasportata da un'onda elettromagnetica fosse distribuita sulla regione di incidenza della luce: era quindi previsto che l'emissione degli elettroni dovesse richiedere molto tempo prima di avvenire nel caso di radiazioni di bassa intensità, questa ipotesi era in contraddizione con quanto osservato.
Nel 1905 Einstein propose che la radiazione stessa consistesse di quanti di energia e che l'energia di ogni quanto fosse legata alla frequenza della radiazione tramite la legge di Planck . La luce interagisce con la materia a livello atomico sotto forma di particelle dette quanti di luce, poi ribattezzati fotoni nel 1926. Quando un fotone è assorbito da un elettrone, questo acquista tutta la sua energia e se questa è abbastanza grande può anche sfuggire all'attrazione dell'atomo a cui è legato. Se l'energia del fotone dipende linearmente dalla sua frequenza e vale , a frequenze troppo basse l'energia è insufficiente affinché questo processo sia possibile. L'effetto fotoelettrico quindi sparisce del tutto, indipendentemente dal numero di fotoni incidenti (che determinano solo l'ampiezza dell'onda classica). L'interazione fra radiazione e materia è quindi spiegata in termini di processi puntuali che coinvolgono particelle elementari.
Effetto Compton[modifica | modifica wikitesto]
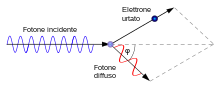
Nel 1916, Einstein ipotizzò che i fotoni dovessero trasportare anche quantità di moto, oltre che energia. Gli esperimenti che fornirono la più diretta conferma del comportamento particellare della luce furono eseguiti da Arthur Compton nel 1923-24. Compton scoprì che la radiazione di una data lunghezza d'onda (nella regione dei raggi X) inviata attraverso una lamina metallica veniva diffusa in due componenti: una della stessa lunghezza d'onda di quella incidente e un'altra componente di lunghezza d'onda leggermente superiore. Secondo la teoria classica la riemissione di radiazione era spiegabile a causa del fatto che l'onda elettromagnetica inviata sul corpo metteva in oscillazione forzata gli elettroni contenuti nella lamina metallica che a loro volta irradiavano nuovamente radiazione con frequenza pari a quelli di oscillazione e quindi uguale a quella incidente. Tuttavia la presenza della componente di lunghezza d'onda maggiore non era spiegabile. Compton fu in grado di spiegare l'esistenza di questa componente trattando la radiazione incidente come composta da fotoni di energia [hυ] che si comportavano come particelle classiche nell'urto con gli elettroni. Nell'urto una parte dell'energia del fotone veniva ceduta all'elettrone dando origine a fotoni di energia diversa e quindi di frequenza (e lunghezza d'onda) diversa, rispettando comunque le leggi di conservazione dell'energia e di conservazione della quantità di moto.
Modello atomico di Bohr-Sommerfeld[modifica | modifica wikitesto]
Modello atomico di Bohr[modifica | modifica wikitesto]
Grazie alla scoperta della radioattività alfa da parte di Henri Becquerel nel 1896 iniziò uno studio dell'atomo attraverso il bombardamento di diversi materiali con particelle alfa. In particolare l'esperimento di Rutherford mostrò che la maggior parte della materia atomica doveva essere concentrata in un volume ristretto rispetto alle dimensioni atomiche, detto nucleo, attorno alla quale si trovavano gli elettroni. Fu così proposto un modello planetario dell'atomo.
Tuttavia, secondo le leggi dell'elettromagnetismo classico una carica elettrica accelerata, come un elettrone che compie un'orbita circolare attorno al nucleo sottoposto alla forza centripeta, dovrebbe irradiare onde elettromagnetiche, perdendo così energia e precipitando sul nucleo in un tempo brevissimmo (circa 1 nanosecondo o 10−9 s)[5], cioè non esisterebbero atomi stabili.
Contemporaneamente si iniziò l'indagine degli spettri atomici grazie all'affinamento delle tecniche di spettroscopia, ossia mediante l'analisi della luce emessa da un gas a bassa pressione nel quale viene fatta scorrere della corrente elettrica. Contrariamente alle previsioni della meccanica classica lo spettro osservato consisteva di righe anziché di bande continue. Furono formulate alcune leggi empiriche, tra le quali possiamo citare il principio di combinazione di Ritz o la formula di Balmer, che ottennero un buon accordo con i risultati sperimentali ma che erano inspiegabili dal punto di vista classico.
Nel 1913 il fisico danese Niels Bohr propose una nuova teoria per l'atomo di idrogeno, essa si fondava sui seguenti postulati:
- Un sistema atomico può assumere soltanto alcuni stati discreti detti stati stazionari. Cambiamenti nell'energia (inclusi emissione e assorbimento di radiazione) possono avvenire solo tra stati stazionari
- La radiazione emessa o assorbita nella transizione tra due stati stazionari è data da:
- Gli stati stazionari corrispondono ciascuno ad una precisa orbita circolare permessa nel modello atomico di Rutherford per le quali il momento angolare sia un multiplo intero di
La nuova teoria permetteva di calcolare quali fossero le orbite permesse e da esse di risalire ai valori attesi per le lunghezze d'onda osservate che risultarono essere in accordo con i valori sperimentali.
La quantizzazione di Sommerfeld[modifica | modifica wikitesto]
Arnold Sommerfeld introdusse una regola più generale per la quantizzazione: essa affermava che l'integrale dell'azione su un cammino chiuso nello spazio delle fasi dovesse essere un multiplo intero della costante di Planck che assumeva il ruolo di unità fondamentale per il quanto di azione. Da questa regola, applicabile solo a sistemi periodici, risultava che la lunghezza della traiettoria dovesse essere un multiplo integrale della lunghezza d'onda di De-Broglie, quindi:
Il principio di corrispondenza e l'osservazione che le quantità quantizzate dovessero essere invarianti adiabatici sono il fondamento di questa regola di quantizzazione.
Dualismo onda-particella[modifica | modifica wikitesto]
L'ipotesi di de Broglie[modifica | modifica wikitesto]
Nel 1924 Louis Victor de Broglie, per la propria tesi di dottorato, formulò l'ipotesi che le particelle dovessero avere anche un comportamento ondulatorio così come era stato evidenziato il comportamento particellare della luce. Usando la nuova costante di Planck propose che la lunghezza d'onda di una particella che possiede quantità di moto dovesse essere:
L'introduzione della costante di Planck nella fisica ha reso possibile evidenziare nuove relazioni tra grandezze, prima non chiare proprio per la mancanza di una costante che avesse le dimensioni necessarie. Prove sperimentali di queste relazioni furono fornite da Clinton Davisson e Lester Germer attraverso un esperimento nel 1927 e indipendentemente da George Thomson. Successivamente Akira Tonomura eseguì l'esperimento della doppia fenditura mettendo in evidenza la diffrazione degli elettroni e confermando completamente l'ipotesi di De Broglie.[6] Un effetto collegato al dualismo onda-particella è l'effetto Kapitza-Dirac proposto nel 1933 da Petr Kapitza e Paul Dirac.
L'esperimento delle due fenditure[modifica | modifica wikitesto]


L'esperimento delle due fenditure fu ideato originariamente da Thomas Young nel 1803 e Augustin Fresnel agli inizi del XIX secolo per mostrare la natura ondulatoria della luce.[7] Una sorgente di luce viene diretta verso due sottili fenditure e produce su di uno schermo una figura di interferenza, già osservata nel medesimo esperimento condotto con onde sulla superficie dell'acqua. Questa figura consiste in una sequenza di bande più luminose intervallate da regioni più scure prive di luce. Questo permise di concludere che la luce ha sicuramente una natura ondulatoria; con particelle classiche infatti si formerebbero solamente due bande in corrispondenza dei due fori delle fenditure.
Lo stesso esperimento è stato condotto nel XX secolo con particelle subatomiche, come gli elettroni.[8] In questo caso una sorgente emette un singolo elettrone per volta di fronte alle due fenditure e uno schermo dietro di queste segnala con un punto la posizione finale raggiunta. Dopo molti elettroni emessi è possibile osservare la distribuzione dei punti sullo schermo, distribuzione che si presenta analoga a quella di interferenza, con sequenze di bande ricche di punti intervallate da regioni in cui questi sono assenti.[9] In questo caso tuttavia, trattandosi del passaggio di singoli elettroni, si deve concludere che in qualche modo l'elettrone stesso auto-interferisce, come se passasse allo stesso tempo per le due fenditure come un'onda. L'onda in questo caso ha natura probabilistica, in quanto, per poter essere messa in evidenza, richiede la ripetizione dello stesso processo fisico, il passaggio di un singolo elettrone attraverso le due fenditure, un numero di volte grande, riproducendo esattamente la natura ondulatoria nel limite in cui è infinito.
Questo risultato lascia tuttavia aperta la questione di come sia possibile che un singolo elettrone si propaghi nello stesso momento attraverso due distinte fenditure. Si può quindi tentare di osservare l'elettrone fisicamente attraversare le due fenditure illuminando queste ultime con della luce. I fotoni che costituiscono la luce colpiranno l'elettrone e permetteranno di capire se un elettrone è passato attraverso una fenditura. In questo esperimento tuttavia si trova che l'elettrone viene rilevato passare solo attraverso una singola fenditura alla volta, ma nello stesso momento non si osserva più la figura di interferenza sullo schermo, ma solo le due bande previste dalla meccanica classica[10]. La misura stessa della posizione e del passaggio dell'elettrone disturba quindi drasticamente il suo stato originario, sulla base del principio di indeterminazione. Non vi è alcun modo di stabilire come si comporti l'elettrone nei pressi delle fenditure che non distrugga al tempo stesso l'interferenza ondulatoria.[11] Come scrisse Richard Feynman illustrando questo esperimento, in qualche modo è come se il principio di indeterminazione protegga la meccanica quantistica e la natura dal mostrare nello stesso momento l'elettrone in un comportamento ondulatorio e in uno classico corpuscolare:
«[Heisenberg] proposed, as a general principle, his uncertainty principle, which we can state in terms of our experiment as follows: "It is impossible to design an apparatus to determine which hole the electron passes through, that will not at the same time disturb the electron enough to destroy the interference pattern"»
«[Heisenberg] propose, come principio generale, il suo principio di indeterminazione, che noi possiamo formulare in termini del nostro esperimento come segue: "È impossibile progettare un apparato per determinare attraverso quale fenditura l'elettrone passa, che allo stesso tempo non disturbi abbastanza l'elettrone da distruggere la figura di interferenza."»
Si tratta di una manifestazione del principio di complementarità: entrambe le descrizioni sono necessarie in una descrizione del mondo quantistico, ma non possono essere evidenziate entrambe nello stesso momento. Non vi è quindi modo di osservare allo stesso tempo l'elettrone come corpuscolo e come onda. Inoltre, fatto essenziale evidenziato da Bohr, la natura corpuscolare o ondulatoria mostrata di volta in volta è determinata strettamente dall'apparato sperimentale e non direttamente dal sistema fisico oggetto di sperimentazione.
Note[modifica | modifica wikitesto]
- ^ I risultati si sono rivelati in seguito correzioni quantistiche alla teoria classica: per esempio, un metodo semiclassico è l'approssimazione WKB.
- ^ Blackbody Radiation, su hyperphysics.phy-astr.gsu.edu. URL consultato il 22 ottobre 2008 (archiviato dall'url originale il 6 novembre 2006).
- ^ (EN) Max Planck, The Genesis and Present State of Development of the Quantum Theory, su nobelprize.org, 2 giugno 1920. URL consultato il 10 dicembre 2012.
- ^ La velocità della luce nel vuoto, indicata con , è una costante (come predetto dalla teoria delle relatività ristretta) e quindi indicando la lunghezza d'onda di una radiazione elettromagnetica se ne fissa anche la frequenza e viceversa. Infatti .
- ^ S. Gasiorowicz, Supplement 1-B, in Quantum Physics[collegamento interrotto], 3ª ed., John Wiley and Sons.
- ^ (EN) A. Tonomura, J. Endo, T. Matsuda, T. Kawasaki e H. Ezawa, Demonstration of single-electron buildup of an interference pattern, in American Journal of Physics, vol. 57, n. 2, febbraio 1989, pp. 117-120, DOI:10.1119/1.16104.
- ^ (EN) Augustin Jean Fresnel, su www-history.mcs.st-andrews.ac.uk. URL consultato il 3 gennaio 2012.
- ^ (EN) Science's 10 Most Beautiful Physics Experiments, su physics-animations.com. URL consultato il 3 gennaio 2012.
- ^ (EN) Double-slit experiment, su hitachi.com. URL consultato il 2 gennaio 2013 (archiviato dall'url originale il 14 gennaio 2011).
- ^ (EN) Wave-Particle Duality, su faculty.gvsu.edu. URL consultato il 2 gennaio 2013.
- ^ (EN) The Feynman Double Slit, su upscale.utoronto.ca. URL consultato il 3 gennaio 2013.
Bibliografia[modifica | modifica wikitesto]
- (EN) Paul A. Tipler, Elementary Modern Physics, W. H. Freeman & Co, 1992, ISBN 978-08-79-01576-3.
- (EN) Robert M. Eisberg e Robert Resnick, Quantum Physics of Atoms, Molecules, Solids, Nuclei, and Particles, Hoboken, John Wiley & Sons Inc, 1985, ISBN 978-04-71-87373-0.
- (EN) Marcelo Alonso e Edward J. Finn, Fundamental University Physics, Quantum and Statistical Physics (Vol. 3), Boston, Addison Wesley, 1968, ISBN 978-02-01-00262-1.
- (EN) Stephen G. Gasiorowicz, Quantum Physics, Hoboken, John Wiley & Sons Inc, 2003, ISBN 978-04-71-05-700-0.


![{\displaystyle [h]=[E][t]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7e4cb6072f7c98437a4b403a593c231111145ff0)











