Calcolosi delle vie urinarie
| Calcolosi delle vie urinarie | |
|---|---|
 | |
| Specialità | urologia e nefrologia |
| Classificazione e risorse esterne (EN) | |
| ICD-9-CM | 592.0, 592.1 e 592.9 |
| ICD-10 | N20 |
| MeSH | D007669 |
| MedlinePlus | 000458 |
| eMedicine | 437096 |
| Sinonimi | |
| Urolitiasi | |
La calcolosi delle vie urinarie, o urolitiasi, è una condizione clinica caratterizzata dalla presenza di uno o più calcoli di dimensioni variabili, contenuti all’interno delle cavità escretrici del sistema urinario, dai calici, all'interno del rene, all’uretra[1][2].
Quando è formata da cristalli di dimensioni molto ridotte, come granelli di sabbia, prende il nome di renella, ed è formata soprattutto da urati e fosfati[1][3][4].
I calcoli urinari si formano tipicamente nel rene e possono spostarsi all'interno del apparato urinario fino a lasciare l'organismo insieme al flusso di urina. Un piccolo calcolo può passare senza causare sintomi.[5] Se un calcolo diventa più grande di 5 millimetri, può causare il blocco dell'uretere con un conseguente forte dolore nella parte bassa della schiena o dell'addome.[5][6] Un calcolo può anche essere causa di sangue nelle urine, vomito e minzione dolorosa.[5] Circa la metà delle persone che hanno sofferto di questa condizione, avrà un altro calcolo entro i successivi dieci anni.[7]
La maggior parte dei calcoli si formano a causa di una combinazione di fattori genetici e ambientali.[5] I fattori di rischio includono elevati livelli di calcio nell'urina, l'obesità, l'assunzione di alcuni alimenti, alcuni farmaci, gli integratori di calcio, l'iperparatiroidismo, la gotta e non bere liquidi a sufficienza.[5][7] La diagnosi solitamente si basa sui sintomi, sull'esame delle urine e con tecniche di imaging biomedico. Anche gli esami del sangue possono essere utili.[1][2][5]
In coloro che hanno avuto calcoli urinari, la prevenzione consiste nel bere liquidi in modo tale che si producano circa due litri di urina al giorno. Se questo non fosse sufficientemente efficace, possono essere prescritti diuretici tiazidici, citrati o l'allopurinolo. Si raccomanda di evitare bevande analcoliche contenenti acido fosforico (tipicamente le cole).[8] Quando un calcolo non provoca sintomi, non è necessario alcun trattamento.[5] In caso contrario, la prima misura consiste nel controllo del dolore, grazie all'impiego di farmaci oppioidi o FANS.[1][6][9] I calcoli più grandi possono richiedere procedure come la litotrissia extracorporea o intracorporea.[1][2][5]
Tra l'1% e il 15% delle persone nel mondo sono state colpite da calcolosi urinaria, in un certo punto della loro vita.[7] Nel 2013, si sono verificati 49 milioni di casi,[10] causando circa 15.000 decessi.[11] A partire dal 1960, sono diventati più comuni nel mondo occidentale.[7] In generale, gli uomini sono più colpiti rispetto alle donne.[5] La calcolosi urinaria ha colpito gli esseri umani nel corso della storia; vi è una descrizione di un intervento chirurgico per rimuoverli risalente al 600 a.C.[12]
Storia[modifica | modifica wikitesto]
L'esistenza di calcoli nelle vie urinarie è stata scoperta migliaia di anni fa e la litotomia è una delle prime procedure chirurgiche note.[13] Nel 1901, un calcolo venne scoperto nel bacino di un'antica mummia egiziana datata al 4.800 a.C. Testi medici dell'antica Mesopotamia, dell'India, della Cina, della Persia, della Grecia e di Roma, menzionano tutti la condizione. Parte del giuramento di Ippocrate suggerisce che nella Grecia antica vi fossero chirurghi ai quali i medici inviavano i pazienti per la litotomia. Il trattato medico romano De medicina di Aulo Cornelio Celso conteneva una descrizione della procedure[14] e servì come base per la sua messa in pratica fino al XVIII secolo.[15]
Personaggi famosi che soffrirono di calcolosi urinaria includono: Napoleone I, Epicuro, Napoleone III, Pietro il Grande, Luigi XIV, Giorgio IV, Oliver Cromwell, Lyndon Johnson, Benjamin Franklin, Michel de Montaigne, Francis Bacon, Isaac Newton, Samuel Pepys, William Harvey, Herman Boerhaave e Antonio Scarpa.[16]
Nuove tecniche nella litotomia hanno iniziato ad emergere a partire dal 1520, ma l'operazione rimase a lungo rischiosa. Dopo che Henry Jacob Bigelow rese popolare la tecnica della litolapassi nel 1878,[17] il tasso di mortalità scese da circa il 24% al 2,4%. Tuttavia, altre tecniche di trattamento hanno continuato a contare un elevato livello di mortalità, soprattutto tra gli urologi inesperti.[15][16] Nel 1980, la Dornier MedTech ha introdotto la litotrissia extracorporea, in grado di rompere i calcoli tramite impulsi acustici, una tecnica che presto si diffuse su larga scala.[18]
Etimologia[modifica | modifica wikitesto]
Il termine “calcolo” proviene dal latino calculus che significa "piccolo sasso". Urolitiasi è composto da οὖρον, in greco “urina” + -lith- che significa pietra e -iasis che significa malattia. La litiasi (formazione di calcoli) nei reni è chiamata nefrolitiasi, da nefro- che significa rene.
Epidemiologia[modifica | modifica wikitesto]

0-0
1-1
2-2
3-3
4-20
È una patologia piuttosto frequente, la prevalenza varia tra il 4% e il 20% nei paesi industrializzati e tra l'1% e il 5% in quelli in via di sviluppo. In Italia affligge in media il 6-9% della popolazione, con incidenze intorno a 100.000 nuovi casi l'anno e prevalenze di 250.000 casi/anno comprendendo le recidive.[19] L'etnia sembra essere un fattore di rischio, con prevalenze maggiori tra uomini caucasici seguiti da ispanici, asiatici e afro-americani.[1][20]
Riguardo alla distribuzione per sesso, la nefrolitiasi risulta essere più frequente nel sesso maschile - con un'incidenza da 3 a 1,5 volte maggiore[1][20] - che in quello femminile, anche se in uno studio riferito al periodo 1976-1994 è stata osservata una riduzione di questo divario negli Stati Uniti d'America,[21] un fenomeno epidemiologico, quest'ultimo, non del tutto spiegato, anche se si sospetta un ruolo degli ormoni sessuali femminili nella diminuzione dell’escrezione urinaria di ossalato.[1] Altri fattori correlati con questa patologia sono l'età, la dieta, la familiarità, la geografia e il clima - con maggiore distribuzione nei Paesi caldi - l'occupazione lavorativa - gli addetti agli altiforni presentano maggiore incidenza - l'Indice di massa corporea (IMC).
Riguardo al ruolo dell'apporto di liquidi e alle caratteristiche dell'acqua, è ampiamente dimostrato che un abbondante apporto di acqua previene lo sviluppo della patologia.[22][23] È dibattuto, invece, il ruolo della durezza dell'acqua, intesa come concentrazione di calcio carbonato, da alcuni correlata a una maggiore escrezione dello stesso,[24] per cui risulterebbe che l'assunzione di acque "dure" preverrebbe in modo più efficace la calcolosi rispetto all'uso di acque "morbide", al contrario dell'opinione comune[25] Risulta privo di sostegno la tesi secondo cui le acque in bottiglia prevengano dalla calcolosi più di quelle della rete idrica servita dagli acquedotti cittadini.
| Nazione | Prevalenza più vecchia (anni)[26] | Ultima prevalenza (anni)[26] |
|---|---|---|
| Stati Uniti | 2.6% (1964–1972) | 5.2% (1988–1994) |
| Italia | 1.2% (1983) | 1.7% (1993–1994) |
| Scozia | 3.8% (1977) | 3.5% (1987) |
| Spagna | 0.1% (1977) | 10.0% (1991) |
| Turchia | n/a | 14.8% (1989) |
| Nazione | Nuovi casi per 100.000 (all'anno)[26] | Andamento |
|---|---|---|
| Stati Uniti | 116 (2000) | decrescente |
| Germania | 720 (2000) | incremento |
| Giappone | 114.3 (2005) | incremento |
| Spagna | 270 (1984) | decrescente |
| Svezia | 200 (1969) | incremento |
Segni e sintomi[modifica | modifica wikitesto]
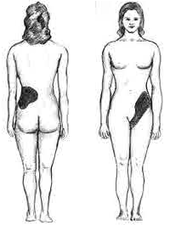
Il segno distintivo di un calcolo che ostruisce l'uretere o la pelvi renale è uno forte dolore intermittente che si irradia dal fianco all'inguine o alla coscia.[27] Questo dolore, noto come colica renale, è spesso descritto come una delle più forti sensazioni dolorose conosciute. La colica renale causata da calcoli urinari è comunemente accompagnata da stimolo urinario, irrequietezza, ematuria, sudorazione, nausea e vomito. Si tratta tipicamente di fitte della durata variabile tra i 20 e i 60 minuti, causate dalle contrazioni peristaltiche dell'uretere che tenta di espellere il calcolo.[27] Il legame embrionale tra il tratto urinario, genitale e gastrointestinale è alla base dell'irradiamento del dolore alle gonadi, così come la nausea e il vomito sono comuni.[28] L'azotemia postrenale e l'idronefrosi possono essere osservate dopo l'ostruzione del flusso urinario in uno o entrambi gli ureteri.[29] Il dolore nel quadrante inferiore sinistro a volte può essere confuso con la diverticolite poiché il sigma si sovrappone all'uretere e la posizione esatta del dolore può essere difficile da isolare a causa della vicinanza di queste due strutture.
Eziopatogenesi[modifica | modifica wikitesto]

Il calcolo urinario è un aggregato solido di varia forma e struttura che si deposita all'interno del rene o delle vie urinarie. La sua formazione è dovuta, di solito, alla rottura di un delicato equilibrio mantenuto dalla funzione renale. I reni, infatti, per la loro funzione devono da un lato risparmiare acqua, dall'altro eliminare sostanze di vario genere di scarsa solubilità, in continuo adattamento a situazioni diverse, di idratazione, di dieta, di clima, di terapia farmacologica, di attività fisica. In condizioni fisiologiche, la formazione di calcoli non avviene per la presenza nelle urine di sostanze che impediscono la precipitazione e la cristallizzazione dei sali di calcio e per effetto di altre che legano il calcio in complessi solubili. Questi meccanismi non sempre garantiscono una protezione efficace. Se le urine si saturano di composti insolubili, si producono, in una prima fase, dei cristalli che aggregandosi fra loro danno origine al calcolo.
Ipocitraturia[modifica | modifica wikitesto]
L'ipocitraturia o bassa escrezione urinaria di citrato (definita come inferiore a 320 mg/giorno) può essere causa di calcoli urinari fino ai 2/3 dei casi. Il ruolo protettivo del citrato è legato a diversi meccanismi; infatti il citrato riduce la sovrasaturazione urinaria di sali di calcio formando complessi solubili con gli ioni di calcio e inibendo la crescita dei cristalli e l'aggregazione. La terapia con citrato di potassio o magnesio citrato di potassio, viene comunemente prescritta nella pratica clinica al fine di aumentare il citrato urinario e ridurre la velocità di formazione dei calcoli.[30]
Sovrasaturazione di urina[modifica | modifica wikitesto]
Quando l'urina si sovrasatura (cioè quando il solvente contiene più soluto rispetto a quanto può tenerne in soluzione) con una o più sostanze calculogeniche (che formano i calcoli), un cristallo può formarsi attraverso il processo di nucleazione.[31] La nucleazione eterogenea (dove vi è una superficie solida sulla quale un cristallo può crescere) procede più rapidamente rispetto alla nucleazione omogenea (dove un cristallo deve crescere in un mezzo liquido senza che vi sia una superficie solida), poiché tale processo richiede meno energia. Aderendo alle cellule sulla superficie di una papilla renale, un cristallo può crescere e aggregarsi in una massa organizzata. A seconda della composizione chimica del cristallo, il processo di formazione del calcolo può procedere più rapidamente quando il pH dell'urina è insolitamente alto o basso.[32]
Sovrasaturazione delle urine rispetto ad un composto calculogenico è pH-dipendente. Ad esempio, ad un pH di 7,0, la solubilità dell'acido urico nelle urine è di 158 mg/100 ml. Ridurre il pH a 5,0 diminuisce la solubilità dell'acido urico a meno di 8 mg/100 ml. La formazione di calcoli di acido urico richiede una combinazione di iperuricosuria (alti livelli di acido urico nelle urine) e basso pH delle urine; l'iperuricosuria da sola non è associata con la formazione di calcoli di acido urico, se il pH delle urine è alcalino.[33] La sovrasaturazione delle urine è necessaria, ma non sufficiente, per lo sviluppo di qualsiasi calcolo delle vie urinarie.[31] È, tuttavia, probabile che sia la causa di fondo dei calcoli di acido urico e di cistina, ma quelli a base di calcio (soprattutto i calcoli di ossalato di calcio) possono avere un'eziologia più complessa.[34]
Gli inibitori della formazione di calcoli[modifica | modifica wikitesto]
L'urina normale contiene agenti chelanti, come il citrato, in grado di inibire la nucleazione, la crescita e l'aggregazione dei cristalli contenenti calcio. Altri inibitori endogeni comprendono la calgranulina (una proteina calcio legante della famiglia S-100), la proteina di Tamm-Horsfall, i glicosaminoglicani, l'uropontina (una forma di osteopontina), la nefrocalcina (una glicoproteina acida) e la protrombina F1 peptide. Al 2016, i meccanismi biochimici di azione di queste sostanze non sono ancora stati completamente chiariti. Tuttavia, quando queste sostanze scendono sotto le loro proporzioni normali, i calcoli possono formarsi da un aggregato di cristalli.[35]
Una assunzione alimentare sufficiente di magnesio e citrato inibisce la formazione di ossalato di calcio e i calcoli di fosfato di calcio; inoltre, magnesio e il citrato operano sinergicamente per inibire i calcoli urinari. L'efficacia del magnesio ad evitare la formazione di calcoli e la loro crescita è dose-dipendente.[36][37][38]
Fattori di rischio[modifica | modifica wikitesto]
La disidratazione dovuta ad una bassa assunzione di liquidi è un fattore importante nella formazione dei calcoli.[27][39] Anche l'obesità è uno dei principali fattori di rischio.
Un elevato apporto alimentare di proteine animali,[27] di sodio, di zuccheri raffinati, di fruttosio e sciroppo di fruttosio,[40] di ossalato,[36] di succo di pompelmo e di succo di mela, può aumentare il rischio di formazione di calcoli urinari.[39]
I calcoli urinari possono derivare anche da una condizione metabolica di base, come ad esempio l'acidosi tubulare distale renale,[41] la malattia di Dent,[42] l'iperparatiroidismo,[43] l'iperossaluria primaria,[44] o il rene a spugna midollare. Tra il 3% e il 20% delle persone che soffrono di calcoli urinari, ha quest'ultima patologia.[31][43]
I calcoli urinari sono più comuni nelle persone con malattia di Crohn;[45] questa condizione è correlata con iperossaluria e malassorbimento di magnesio.[46]
Una persona con calcoli urinari ricorrenti può essere sottoposta a screening per tali condizioni. Questo è in genere fatto tramite una analisi delle urine prodotte nel corso si 24 ore.[29]
Calcite[modifica | modifica wikitesto]
Il calcio è il componente principale dei calcoli urinari umani: l'ossalato di calcio. Alcuni studi suggeriscono che le persone che assumono integratori alimentari di calcio o vitamina D hanno un rischio maggiore di sviluppare calcoli urinari. L'escrezione urinaria di calcio può aumentare in risposta alla supplementazione di vitamina D in alcuni soggetti affetti da calcolosi renale. Tali individui, in virtù di una particolare predisposizione, possono sviluppare una franca ipercalciuria e una vera e propria calcolosi in risposta alla supplmentazione con vitamina D[47].
Negli Stati Uniti, la formazione di calcoli urinari è stata utilizzata come indicatore di eccesso di assunzione di calcio.[48]
Nei primi anni 1990, uno studio condotto negli Stati Uniti ha trovato che le donne in post-menopausa che consumano 1000 mg di integratori di calcio e 400 UI di vitamina D al giorno per sette anni avevano un rischio del 17% maggiore di sviluppare calcoli urinari rispetto ai soggetti che assumevano un placebo.[48]
Diagnosi[modifica | modifica wikitesto]
La diagnosi dei calcoli urinari viene formulata grazie all'anamnesi, all'esame fisico, all'analisi delle urine e agli studi di imaging biomedico.[49] La diagnosi clinica è di solito effettuata sulla base della posizione e della gravità del dolore, che in genere viene classificato come "coliche" (va e viene in onde spasmodiche). Il dolore alla schiena si verifica quando i calcoli producono un'ostruzione nel rene.[50] L'esame obiettivo può rivelare febbre e dolore sul lato interessato alla manovra di Giordano.[49]
Esami di imaging biomedico[modifica | modifica wikitesto]
Nelle persone con una storia di calcoli, in coloro di età inferiore ai 50 anni e in quelli che presentano sintomi di calcoli senza alcun segno, non richiedono l'effettuazione di una tomografia computerizzata (TC).[51]
In caso contrario, una scansione TC spirale senza mezzo di contrasto con sezioni da 5 millimetri è la modalità diagnostica di scelta nella valutazione radiografica di una sospetta nefrolitiasi.[6][28][49][52][53] Tutti i calcoli sono rilevabili grazie alla TC, tranne alcuni rarissimi composti da alcuni residui di farmaci nelle urine,[54] come l'indinavir. I calcoli contenenti calcio sono relativamente radiodensi e spesso possono essere rilevati da una radiografia tradizionale dell'addome che includa i reni, gli ureteri e la vescica.[54] Circa il 60% di tutti i calcoli urinari sono radiopachi.[52][55] In generale, i calcoli di fosfato di calcio hanno una maggiore densità, seguiti da quelli di ossalato di calcio e magnesio ammonio fosfato. I calcoli di cistina sono solo debolmente radiodensi, mentre quelli di acido urico sono di solito completamente radiotrasparenti.[56]
Dove non è disponibile una tomografia computerizzata può essere eseguita una urografia per aiutare a confermare la diagnosi di calcolosi urinaria. Ciò comporta l'iniezione endovenosa di un mezzo di contrasto seguito da una radiografia. I calcoli possono essere rilevati anche per mezzo di un pielogramma retrogrado, in cui un mezzo di contrasto simile viene iniettato direttamente nell'ostio distale dell'uretere (dove l'uretere termina, che entra nella vescica).[52]
Anche un'ecografia ai reni può essere utile, in quanto fornisce i dettagli circa la presenza di idronefrosi, suggerendo che un calcolo stia bloccando il deflusso dell'urina.[54] Alcuni calcoli radiotrasparenti che non appaiono in radiografica, possono invece essere visti grazie agli ultrasuoni. Altri vantaggi dell'ecografia renale includono il suo basso costo e l'assenza di esposizione alle radiazioni. L'ecografia è utile per individuare i calcoli nelle situazioni in cui non è consigliabile ricorrere ai raggi X o alla TC, come ad esempio nei bambini o nelle donne in gravidanza.[57] Nonostante questi vantaggi, al 2009 l'ecografia renale non è stata considerata un possibile sostituto per la TAC spirale senza contrasto nella valutazione diagnostica iniziale della calcolosi urinaria.[53] La ragione principale di ciò risiede nel fatto che, rispetto alla TC, l'ecografia renale più spesso non riesce a rilevare piccole pietre (soprattutto calcolosi ureterale), così come altri disturbi gravi che potrebbero causare i sintomi.[27]
Esami di laboratorio[modifica | modifica wikitesto]

Le indagini di laboratorio che solitamente vengono eseguite includono:[49][53][54][58]
- Esame microscopico delle urine, che può mostrare globuli rossi del sangue, batteri, leucociti, cilindri urinari e cristalli;
- urinocoltura per identificare eventuali microrganismi infettanti presenti nel tratto urinario e per determinare la sensibilità di questi organismi agli antibiotici specifici;
- emocromo completo, alla ricerca di neutrofilia (aumento della conta dei neutrofili) indicativi di infezione batterica, come si vede nel caso di calcoli di struvite;
- test di funzionalità renale per cercare i livelli ematici di calcio anormalmente elevati nel sangue (ipercalcemia);
- raccolta delle urine 24 ore per misurare il volume totale giornaliero urinario, il magnesio, il sodio, l'acido urico, il calcio, il citrato, l'ossalato e il fosfato;
- analisi chimica dei calcoli in grado di stabilire la loro composizione, che a sua volta può contribuire a scegliere la successiva gestione terapeutica preventiva.
Classificazione[modifica | modifica wikitesto]

A-(verde) a stampo, coralliforme o a corna di cervo, staghorn B-pielico C-caliciali superiori D-caliciale mediano E- caliciale inferiore F- pieloureterale G- ureterale superiore o prossimale H- impilamento, steinstrasse I- ureterale mediano o inferiore o distale L-vescicale M- uretrale
I calcoli urinari vengono solitamente classificati secondo la loro posizione e la composizione chimica[2]. I calcoli possono trovarsi nel rene, nell'uretere, nella vescica e nell'uretra. I calcoli caliciali, all'interno del rene, possono essere asintomatici e non necessitano trattamento in assenza di dolore e/o infiammazione. I calcoli pelvici posizionati nel bacinetto renale, richiedono sovente il trattamento potendo diventare ostruttivi. I calcoli a stampo, o coralliformi occupano sia il bacinetto che i calici all'interno del rene. I calcoli ureterali se non c'è ostruzione del flusso, con conseguente colica renale, possono defluire naturalmente. I calcoli vescicali possono arrivare dall'uretere e non venir espulsi per un’ostruzione del collo vescicale che non permette un completo svuotamento della vescica al termine della minzione come accade tipicamente in caso di iperplasia prostatica. Possono anche formarsi nella vescica, sempre in presenza di ostruzione del collo vescicale, associati a una infezione delle vie urinarie.[2]
I calcoli possono essere classificati per il loro componente chimico/minerale principale in[2]:
- Calcoli di ossalato di calcio
- monoidrato, whewellite
- diidrato, weddellite
- Calcoli di fosfato di calcio, apatite, idrossiapatite, brushite, whitlockite, dahllite
- Calcoli di acido urico, uricite
- Calcoli da infezione
- Calcoli di ammonio magnesio fosfato, struvite
- Calcoli di carbonato apatite
- Calcoli di carbonato di calcio, aragonite
- Calcoli di cistina
- Altri tipi: calcoli di xantina, calcoli di farmaci (sulfonamidi, indinavir ecc.)
I calcoli più frequenti sono composti da ossalati. Frequentemente il calcolo presenta forme cristalline miste e sono individuabili al loro interno più sostanze chimiche.
| Tipo di calcolo urinario | Probabilità | Circostanze | Colore | Sensibilità | Dettagli |
|---|---|---|---|---|---|
| Ossalato di calcio | 80% | Quando vi sono urine acide (basso pH)[59] | Nero/marrone scuro | Radiopache | Parte dell'ossalato nelle urine viene prodotto dal corpo. Anche il calcio e l'ossalato assunti nella dieta svolgono un ruolo, ma non sono gli unici fattori che influenzano la formazione di calcoli di ossalato di calcio. L'ossalato alimentare si trova in molte verdure, frutta e noci. |
| Calcio fosfato | 5–10% | Quando le urine sono alcaline (alto pH) | Bianco sporco | Radiopache | Tendono a formarsi nelle urine alcaline, soprattutto quando sono presenti dei Proteus. |
| Acido urico | 5–10% | Quando le urine acide persistono | Giallo / marrone rossatro | Radiolucenti | Diete ricche di proteine animali e purine, sostanze che si trovano naturalmente in tutti gli alimenti, ma soprattutto nelle frattaglie, nel pesce e nei frutti di mare. |
| Struvite | 10–15% | Infezione del rene | Bianco sporco | Radiopache | La prevenzione dei calcoli di struvite dipende dal non avere infezioni. Accorgimenti particolari nella dieta non sembrano essere efficaci nell'evitare la formazione di questi calcoli. |
| Cistina | 1–2%[60] | Rara malattia genetica | Rosa/giallo | Radiopache | Cistina, un amminoacido (uno degli elementi costitutivi delle proteine), viene esecreta attraverso i reni nell'urina formando dei cristalli |
| Xantina[61] | Estremamente rara | Rosso mattone | Radiolucente |
Trattamento[modifica | modifica wikitesto]
Il tipo di calcolo determina la probabilità che esso riesca a transitare spontaneamente. Ad esempio, fino al 98% dei piccoli calcoli (con diamentro inferiore a 5 mm) sono in grado di passare autonomamente, attraverso la minzione, entro quattro settimane dalla comparsa dei sintomi,[6] tuttavia con i calcoli più grandi (da 5 a 10 mm di diametro) questo dato diminuisce a meno del 53%.[62] Anche l'iniziale posizione del calcolo può influenzare la risoluzione spontanea: infatti la probabilità di transito aumenta del 48% per i calcoli situati nell'uretere prossimale e fino al 79% per quelli posizionati all'incrocio vescicoureterico, indipendentemente dalle loro dimensioni.[62] Supponendo che non vi sia un alto livello di ostruzione o un'infezione associata, i sintomi appaiono relativamente lievi e diversi approcci non chirurgici possono essere utilizzati per favorire il passaggio di un calcolo.[33] Chi accusa il ripetersi di formazione di calcoli, necessita di una gestione più intensa, tra cui una corretta assunzione di liquidi e l'uso di alcuni farmaci. Inoltre, la sorveglianza attenta è chiaramente necessaria per massimizzare il decorso clinico.[63]
Solitamente il trattamento si divide in due fasi, la prima mira alla soppressione dei sintomi, con somministrazione di farmaci antinfiammatori non steroidei ed eventualmente un antiemetico nel caso di vomito. L'altra fase mira al trattamento dei calcoli veri e propri. Numerosi studi clinici hanno evidenziato l'efficacia della dieta, di alcuni integratori alimentari e soprattutto dell'assunzione di adeguate quantità di liquidi[64] nella prevenzione secondaria della calcolosi urinaria. In particolare un ampio studio di metanalisi del 2009 ha dimostrato che l'assunzione di acqua in quantità maggiori di due litri al giorno riduce in maniera statisticamente significativa il rischio di formazione di calcoli nei soggetti predisposti.[2][65]
Gestione del dolore[modifica | modifica wikitesto]
La gestione del dolore spesso richiede la somministrazione endovenosa di FANS o oppioidi.[27] Preferibilmente si sceglie una somministrazione orale dei farmaci al fine di garantire un minor disagio per il paziente.[57] L'uso di antispastici non presenta ulteriori benefici.[9]
La terapia di espulsione[modifica | modifica wikitesto]
L'uso di farmaci per velocizzare il passaggio spontaneo dei calcoli attraverso l'uretere è indicato come "terapia medica espulsiva".[66][67] Diversi agenti, tra cui gli alfabloccanti adrenergici (come la tamsulosina) e i calcio-antagonisti (come la nifedipina), si sono dimostrati efficaci per tal scopo.[66] Gli alfabloccanti sembrano avere un'azione più veloce,[68] tuttavia, appaiono efficaci solo per i calcoli di dimensioni comprese tra i 4 mm e i 10 mm.[69] Una combinazione di tamsulosina e un corticosteroide può risultare migliore rispetto alla sola tamsulosina.[66] Questi trattamenti sembrano essere anche un utile complemento alla litotripsia.[6]
Litotrissia[modifica | modifica wikitesto]

La litotrissia extracorporea ad onde d'urto (in inglese Extracorporeal shock wave lithotripsy o ESWL) è una tecnica non invasiva per la rimozione dei calcoli urinari. La maggior parte delle procedure ESWL viene effettuata quando il calcolo si trova in prossimità della pelvi renale. L'ESWL comporta l'impiego di una macchina in grado di creare impulsi ad ultrasuoni concentrati e ad alta energia che, applicati dall'esterno, siano in grado di frantumare i calcoli, in un tempo variabile di circa 30-60 minuti. Dopo essere stata introdotta negli Stati Uniti nel 1984, tale metodica è stata ampiamente e rapidamente accettata come un trattamento alternativo per i calcoli urinari e ureterali.[18] Attualmente viene utilizzata per la distruzione di semplici calcoli situati nel rene e dell'uretere superiore, purché la dimensione degli aggregati lapidei (consistente sia nel numero che nella dimensione dei singoli calcoli) sia inferiore a 20 mm e l'anatomia del rene coinvolto sia normale.[70][71] Nel caso di calcoli di dimensione superiore ai 10 mm, l'ESWL non è in grado di romperli in un unico trattamento e quindi è necessario ricorrere a due o tre sedute. Tra circa l'80% e l'85% dei semplici calcoli urinari possono essere efficacemente trattati.[72] Gli effetti avversi più comuni includono un trauma acuto, come ecchimosi nel punto di applicazione e danni ai vasi sanguigni del rene. [72][73] Infatti, la stragrande maggioranza delle persone che vengono trattate con una dose tipica di onde d'urto sono propense a sperimentare un certo grado di danno renale acuto.[18]
Oltre al potenziale danno acuto di cui sopra, studi su animali suggeriscono che queste lesioni possono progredire fino alla formazione di cicatrici, con conseguente perdita di volume renale funzionale.[72][73] Recenti studi prospettici indicano che anche gli anziani sono a maggior rischio di sviluppare ipertensione di nuova insorgenza dopo la procedura. Inoltre, uno studio retrospettivo caso-controllo pubblicato dai ricercatori della Mayo Clinic nel 2006, ha trovato un aumento del rischio di sviluppare il diabete mellito e l'ipertensione nelle persone trattate con ESWL.[18]
Chirurgia[modifica | modifica wikitesto]
La maggior parte dei calcoli di dimensioni inferiori ai 5 mm transitano spontaneamente.[6][74] Un tempestivo intervento chirurgico può, tuttavia, rendersi necessario per le persone con un solo rene funzionante, nei casi di ostruzione bilaterale, quando vi sia un'infezione delle vie urinarie, oppure quando si riscontra un dolore intrattabile.[6] A partire dalla metà degli anni 1980, trattamenti meno invasivi come la litotripsia extracorporea, l'ureteroscopia e la nefrolitotomia percutanea, hanno iniziato a sostituire la chirurgia a cielo aperto come possibile approccio per la calcolosi renale.[6] Più di recente, l'ureteroscopia è stata adattata per facilitare procedure di nefrostomia retrograda per la nefrolitotomia percutanea. Questo approccio ha dato risultati incoraggianti.[2][75]
Chirurgia endoscopica[modifica | modifica wikitesto]
L'ureteroscopia è diventata sempre più utilizzata grazie alla miniaturizzazione degli ureteroscopi a fibre ottiche e delle apparecchiature per litotrissia intracorporea.
Si distingue nella tradizionale ureteroscopia con endoscopio rigido (in sigla URS) e ureteroscopia con endoscopio flessibile (in sigla RIRS) in grado di raggiungere anche i calcoli pielo-caliciali. Le procedure ureteroscopiche tipicamente comportano il posizionamento di uno stent ureterale (un piccolo tubo che si estende dalla vescica attraverso l'uretere verso il rene) per agevolare il deflusso e fornire un immediato sollievo. Il posizionamento dello stent può essere utile per il salvataggio di un rene a rischio di insufficienza renale acuta dovuta alla maggiore pressione idrostatica, al gonfiore e alle infezioni (pielonefrite e pionefrosi) causate da un calcolo che ostruisce. Uno stent ureterale può variare in lunghezza da 24 a 30 cm e la maggior parte dei modelli possiede una forma comunemente indicata come "doppio J" o "doppio codino", dovuta ad un ricciolo ad entrambe le estremità. Sono progettati per consentire all'urina di scorrere nell'uretere altrimenti ostruito e possono essere tenuti in loco per giorni o settimane, fintantoché le infezioni si risolvano o i calcoli si dissolvano o vengano eliminati grazie a qualche trattamento. La presenza di stent ureterali può causare un disagio da minimo a moderato, incontinenza urinaria e possibili infezioni, problematiche che in genere si risolvono con la rimozione. La maggior parte degli stent ureterali possono essere rimossi per via cistoscopica nel corso di una visita ambulatoriale in anestesia topica dopo la risoluzione della calcolosi urinaria.[2][76]
Alcune tecniche ureteroscopiche definitive per l'estrazione del calcolo (piuttosto che con il semplice superamento dell'ostruzione) includono l'estrazione con un cestello di Dormia e/o l'ureterolitotrissia ad ultrasuoni. La litotrissia laser è un'altra tecnica in grado di frammentare i calcoli nella vescica, negli ureteri e nei reni.[2][77]
La nefrolitotrissia o nefrolitotomia percutanea (in sigla PNL o PCNL) è invece una procedura endoscopica percutanea che permette di raggiungere le cavità renali mediante un tramite creato tra la cute ed il parenchima renale e consente di rimuovere i calcoli renali di dimensioni superiori ai 2 cm senza la necessità di eseguire interventi chirurgici a cielo aperto. Viene eseguita previa anestesia generale, utilizzando posizioni specifiche del paziente (es. la Posizione di Valdivia), inserendo un nefroscopio, uno strumento che consente di esplorare le cavità pielocaliciali del rene. Dopo aver individuato i calcoli si procede alla loro estrazione tramite cestelli o pinze (se di piccole dimensioni) o alla loro frammentazione con litotritori (in caso di calcoli di maggiori dimensioni) e alla successiva asportazione dei frammenti.[2] La nefrolitotomia percutanea o, raramente, la nefrolitotomia anatrofica, è il trattamento di scelta per i calcoli di grandi dimensioni o complessi o nei casi in cui non si possa ricorrere a procedure meno invasive.[6][49]
Le tecniche endoscopiche sono generalmente più efficaci rispetto alla ESWL per il trattamento di calcoli situati nell'uretere inferiore, con tassi di successo tra il 93% e il 100%.[62] Questi vantaggi sono particolarmente evidenti con calcoli superiori a 10 mm di diametro. Tuttavia, la chirurgia endoscopica nel rene e nell'uretere superiore è molto più impegnativa della ESWL e molti urologi preferiscono ancora usare l'ESWL come trattamento di prima linea per i calcoli di dimensione inferiori a 10 mm mentre l'ureteroscopia è preferita per quelli di dimensioni maggiori[62] e per le pazienti in stato di gravidanza, per coloro che sono affetti da obesità e per chi ha disordini emorragici.[2][6]
Calcoli di struvite[modifica | modifica wikitesto]
Un'infezione del tratto urinario sostenuta da batteri del genere Proteus può essere la causa della formazione di cristalli di struvite, causa del 10-15% dei casi di nefrolitiasi, con rapporto femmine-maschi di circa 10 a 2.[78] Il calcolo di struvite causato da infezione di Proteus assume spesso la conformazione "a stampo", ovvero ricalca la forma della pelvi renale, raggiungendo dimensioni anche notevoli. La causa di questa conformazione è da attribuirsi all'essudato infiammatorio, ricco di fibrina, che agisce come cemento nella formazione del calcolo.
Patogenesi[modifica | modifica wikitesto]
Alcuni batteri (tra i quali i generi Proteus e Ureaplasma) possiedono un enzima chiamato ureasi, in grado di scindere l'urea urinaria in anidride carbonica ed ammoniaca; quest'ultima viene idrolizzata a ione ammonio, con conseguente incremento del pH e diminuzione della solubilità degli ioni fosfato e magnesio, costituenti dei cristalli di struvite in grado di fornire la base per la nucleazione di grandi calcoli ostruenti le vie urinarie.[78]
Clinica[modifica | modifica wikitesto]
La principale manifestazione clinica è conseguente all'infiammazione innescata sia da Proteus sia dalla presenza di un corpo estraneo rappresentato dal calcolo, con possibile raccolta ascessuale e sepsi. L'ostacolo al deflusso urinario può portare all'insufficienza renale acuta post-renale, soprattutto se il calcolo è di grandi dimensioni e localizzato nelle vie urinarie distali.[78]
Diagnosi[modifica | modifica wikitesto]
L'esame delle urine fornisce importanti indicazioni; può essere presente microematuria, macroematuria e leucocituria a seconda della gravità e della complessità della lesione. Una batteriuria ed urinocoltura positiva per Proteus, accompagnati dalla presenza di cristalli a coperchio di bara, costituiscono reperti patognomonici. I profili ematici sono caratterizzati da aumento degli indici di flogosi, con aumento della velocità di eritrosedimentazione e della proteina C-reattiva.[78]
Terapia[modifica | modifica wikitesto]
La litotripsia e la nefrolitotomia percutanea con o senza successiva irrigazione del bacinetto renale con emiacidrina costituiscono il primo intervento terapeutico nei casi di calcolo ostruente. L'elevato tasso di recidive può essere abbassato attraverso l'uso di antibiotici specifici per il batterio isolato, cercando di mantenere il più possibile le urine sterili. Un ulteriore approccio terapeutico consiste nell'utilizzo di inibitori dell'ureasi quali l'acido acetoidrossamico, che tuttavia presenta una ingente quantità di effetti collaterali.
Si prescrive una dieta a base di cibi contenenti bicarbonato per sciogliere i cristalli di acido urico, e ricca di citrati quali inibitori della cristallizzazione.[78]
Prevenzione[modifica | modifica wikitesto]
Le misure preventive dipendono dal tipo di calcoli. Nei casi di calcoli di calcio, assumere molti liquidi, diuretici tiazidici e citrato sono sistemi efficaci come l'allopurinolo nei pazienti con alti livelli di acido urico nel sangue o nelle urine.[79][80]
Misure dietetiche[modifica | modifica wikitesto]
La terapia specifica dovrebbe essere scelta in base al tipo di calcolo. La dieta può avere una profonda influenza sullo sviluppo di calcoli urinari. Le strategie preventive includono una combinazione di modifiche all'alimentazione e di assunzione di farmaci, con l'obiettivo di ridurre il carico di escrezione di composti che possono dare origine ai calcoli sui reni.[74][81][82] Le raccomandazioni dietetiche attuabili per ridurre al minimo la possibile formazione di calcoli urinari includono:[83]
- Aumentare l'assunzione di liquidi per avere oltre due litri di produzione di urina al giorno.
- Aumentare l'assunzione di acido citrico; il succo di limone è la più ricca fonte naturale.[84]
- Assunzione moderata di calcio
- Limitare l'assunzione di sodio
- Evitare elevate dosi di supplementi di vitamina C
- Limitare l'assunzione di proteine animali a non più di due pasti al giorno (un'associazione tra il consumo di proteine animali e le recidive di calcoli urinari è stata dimostrata negli uomini[85]).
- Limitare il consumo di bevande analcoliche alla cola,[79] in quanto contenenti acido fosforico, a meno di un litro a settimana.[86]
Il mantenimento di una urina diluita grazie ad una vigorosa assunzione di liquidi è utile in tutte le forme di nefrolitiasi: l'aumento del volume delle urine è un principio fondamentale per la prevenzione dei calcoli urinari. L'assunzione di liquidi dovrebbe essere sufficiente per mantenere una produzione di urina di almeno 2 litri al giorno.[80] Un'alta assunzione di liquidi è stata associata ad una riduzione del 40% del rischio di recidiva.[53] Tuttavia le prove a sostegno di ciò non risultano di buona qualità.[80]
Il calcio si lega con l'ossalato disponibile nel tratto gastrointestinale, impedendo così l'assorbimento nel flusso sanguigno e quindi la riduzione dell'assorbimento di ossalato diminuisce il rischio di sviluppo di calcoli urinari nei soggetti sensibili.[87] A causa di questo, alcuni nefrologi e urologi consigliano di masticare compresse di calcio durante i pasti contenenti alimenti composti da ossalato.[88] I supplementi di calcio citrato possono essere assunti con i pasti, se il calcio nella dieta non può essere aumentato con altri mezzi. Il supplemento di calcio consigliato per le persone a rischio di formazione di calcoli è il citrato di calcio, poiché aiuta ad aumentare l'escrezione urinaria del citrato.[82]
A parte una vigorosa idratazione per via orale e il consumo di maggior calcio nella dieta, altre strategie di prevenzione includono evitare grandi dosi di supplementi di vitamina C e la moderazione nell'assunzione di cibi ricchi di ossalati, come le verdure a foglia, il rabarbaro, i prodotti di soia e il cioccolato.[89] Tuttavia, non è stato ancora eseguito uno studio randomizzato e controllato riguardo all'ipotesi che la minor assunzione di ossalato possa ridurre l'incidenza della formazione di calcoli.[89] Alcune evidenze indicano che l'assunzione di magnesio possa diminuire il rischio di nefrolitiasi sintomatica.[89]
Alcalinizzazione dell'urina[modifica | modifica wikitesto]
Il fulcro della gestione medica dei calcoli di acido urico è l'alcalinizzazione (aumento del pH) delle urine. I calcoli di acido urico sono tra i pochi tipi suscettibili della terapia dissoluzione, nota come chemiolisi. Solitamente la chemiolisi si ottiene attraverso la somministrazione di farmaci per via orale, anche se in alcuni casi, possono essere utilizzati agenti per via endovenosa o l'instillazione di essi direttamente sul calcolo, utilizzando una nefrostomia anterograda o cateteri ureterali retrogradi.[33] L'acetazolamide (Diamox) è un farmaco in grado di alcalinizzare le urine. Oltre a all'acetazolamide, o in alternativa, sono disponibili alcuni integratori alimentari che producono una simile alcalinizzazione delle urine. Questi includono il bicarbonato di sodio, il citrato di potassio, il citrato di magnesio e il Bicitra (una combinazione di acido citrico monoidrato e sodio citrato diidrato).[90] Oltre all'alcalinizzazione delle urine, questi integratori hanno il vantaggio di aumentare il livello di citrato urinario, che aiuta a ridurre l'aggregazione di calcoli di ossalato di calcio.[33]
Aumentare il pH delle urine a circa 6,5 fornisce le condizioni ottimali per la dissoluzione di calcoli di acido urico. Aumentare il pH delle urine di un valore superiore a 7,0 aumenta il rischio della formazione di calcoli di fosfato di calcio. L'esecuzione periodicamente del test delle urine con carta nitrazine può contribuire a garantire che il pH delle urine rimanga in questo range ottimale.[33]
Diuretici[modifica | modifica wikitesto]

Una delle terapie mediche riconosciute per la prevenzione dei calcoli sono i diuretici tiazidici, come il clortalidone o l'indapamide. Questi farmaci inibiscono la formazione di calcoli contenenti calcio riducendo l'escrezione urinaria di questo elemento.[27] La diminuzione dell'assunzione di sodio è necessario per garantire l'effetto clinico dei tiazidici, infatti l'eccesso di sodio favorisce l'escrezione di calcio. I tiazidici funzionano meglio per perdita renale ipercalciuria (elevati livelli di calcio nelle urine), una condizione in cui alti livelli di calcio urinario sono causati da un difetto primario del rene. I tiazidi sono utili per il trattamento dell'ipercalciuria assorbente, una condizione in cui l'alta presenza di calcio nelle urine è il risultato di un eccesso di assorbimento dal tratto gastrointestinale.[35]
Allopurinolo[modifica | modifica wikitesto]
Tra gli individui che presentano iperuricosuria e calcoli di calcio, l'assunzione di allopurinolo è uno dei pochi trattamenti ad aver dimostrato di poter ridurre le recidive da calcoli urinari. L'allopurinolo interferisce con la produzione di acido urico nel fegato ed è utilizzato anche in persone che soffrono di gotta o iperuricemia (elevati livelli sierici di acido urico).[91] Il dosaggio viene regolato per mantenere una ridotta escrezione urinaria di acido urico. Il livello di acido urico nel siero, pari o inferiore a 6 mg/100 ml, è spesso l'obiettivo terapeutico. La condizione di iperuricemia non è necessaria per la formazione di calcoli di acido urico; l'iperuricosuria può avvenire in presenza di acido urico normale o addirittura inferiore alla media.[33]
Note[modifica | modifica wikitesto]
- ^ a b c d e f g h Associazione Urologi Italiani - Linee guida per la calcolosi delle vie urinarie (PDF), 2013.
- ^ a b c d e f g h i j k l C.Türk,T. Knoll,A. Petrik,K. Sarica,A. Skolarikos,M. Straub,C. Seitz, European association of urology-Guidelines on Urolithiasis (PDF), 2015. URL consultato il 7 marzo 2017 (archiviato dall'url originale il 10 gennaio 2017).
- ^ renella, in Treccani.it – Vocabolario Treccani on line, Roma, Istituto dell'Enciclopedia Italiana.
- ^ Renella, su dizionari.repubblica.it. sul Dizionario di Italiano Hoepli
- ^ a b c d e f g h i Kidney Stones in Adults, su niddk.nih.gov, febbraio 2013. URL consultato il 22 maggio 2015.
- ^ a b c d e f g h i j NL Miller e JE Lingeman, Management of kidney stones (PDF), in BMJ, vol. 334, n. 7591, 2007, pp. 468–72, DOI:10.1136/bmj.39113.480185.80, PMC 1808123, PMID 17332586.
- ^ a b c d MS Morgan e MS Pearle, Medical management of renal stones., in BMJ (Clinical research ed.), vol. 352, 14 marzo 2016, pp. i52, PMID 26977089.
- ^ A Qaseem, P Dallas, MA Forciea, M Starkey e TD Denberg, Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: A clinical practice guideline from the American College of Physicians, in Annals of Internal Medicine, vol. 161, n. 9, 4 novembre 2014, pp. 659–67, DOI:10.7326/M13-2908, PMID 25364887.
- ^ a b K Afshar, S Jafari, AJ Marks, A Eftekhari e AE MacNeily, Nonsteroidal anti-inflammatory drugs (NSAIDs) and non-opioids for acute renal colic., in The Cochrane database of systematic reviews, vol. 6, 29 giugno 2015, pp. CD006027, DOI:10.1002/14651858.CD006027.pub2, PMID 26120804.
- ^ Collaborators Global Burden of Disease Study 2013, Global, regional, and national incidence, prevalence, and years lived with disability for 301 acute and chronic diseases and injuries in 188 countries, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013, in Lancet (London, England), vol. 386, n. 9995, 22 agosto 2015, pp. 743–800, DOI:10.1016/s0140-6736(15)60692-4, PMC 4561509, PMID 26063472.
- ^ Collaborators GBD 2013 Mortality and Causes of Death, Global, regional, and national age-sex specific all-cause and cause-specific mortality for 240 causes of death, 1990–2013: a systematic analysis for the Global Burden of Disease Study 2013, in Lancet, vol. 385, n. 9963, 17 dicembre 2014, pp. 117–71, DOI:10.1016/S0140-6736(14)61682-2, PMC 4340604, PMID 25530442.
- ^ (EN) David A. Schulsinger, Kidney Stone Disease: Say NO to Stones!, Springer, 2014, p. 27, ISBN 978-3-319-12105-5.
- ^ G Eknoyan, History of urolithiasis, in Clinical Reviews in Bone and Mineral Metabolism, vol. 2, n. 3, 2004, pp. 177–85, DOI:10.1385/BMM:2:3:177, ISSN 1534-8644.
- ^ Aulus Cornelius Celsus, Book VII, Chapter XXVI: Of the operation necessary in a suppression of urine, and lithotomy, in GF Collier (a cura di), A translation of the eight books of Aul. Corn. Celsus on medicine, 2nd, London, Simpkin and Marshall, 1831, pp. 306–14.
- ^ a b J Shah e HN Whitfield, Urolithiasis through the ages, in British Journal of Urology International, vol. 89, n. 8, 2002, pp. 801–10, DOI:10.1046/j.1464-410X.2002.02769.x, PMID 11972501.
- ^ a b H Ellis, A History of Bladder Stone, Oxford, England, Blackwell Scientific Publications, 1969, ISBN 978-0-632-06140-2.
- ^ HJ Bigelow, Litholapaxy or rapid lithotrity with evacuation, Boston, A. Williams and Company, 1878, p. 29.
- ^ a b c d Shock Wave Lithotripsy Task Force, Current Perspective on Adverse Effects in Shock Wave Lithotripsy (PDF), su Clinical Guidelines, Linthicum, Maryland, American Urological Association, 2009. URL consultato il 13 ottobre 2015 (archiviato dall'url originale il 18 luglio 2013).
- ^ Francesco Porpiglia, Manuale di Urologia, Torino, Minerva Medica, 2015, ISBN 978-88-7711-834-9.
- ^ a b Soucie JM, Thun MJ, Coates RJ, McClellan W, Austin H, Demographic and geographic variability of kidney stones in the United States, in Kidney Int., vol. 46, n. 3, 1994, pp. 893–9, PMID 7996811.
- ^ Stamatelou KK, Francis ME, Jones CA, Nyberg LM, Curhan GC, Time trends in reported prevalence of kidney stones in the United States: 1976-1994, in Kidney Int., vol. 63, n. 5, 2003, pp. 1817–23, DOI:10.1046/j.1523-1755.2003.00917.x, PMID 12675858.
- ^ Curhan GC, Willett WC, Rimm EB, Stampfer MJ, A prospective study of dietary calcium and other nutrients and the risk of symptomatic kidney stones, in N. Engl. J. Med., vol. 328, n. 12, 1993, pp. 833–8, DOI:10.1056/NEJM199303253281203, PMID 8441427.
- ^ Curhan GC, Willett WC, Speizer FE, Spiegelman D, Stampfer MJ, Comparison of dietary calcium with supplemental calcium and other nutrients as factors affecting the risk for kidney stones in women, in Ann. Intern. Med., vol. 126, n. 7, 1997, pp. 497–504, PMID 9092314.
- ^ Churchill D, Bryant D, Fodor G, Gault MH, Drinking water hardness and urolithiasis, in Ann. Intern. Med., vol. 88, n. 4, 1978, pp. 513–4, PMID 637432.
- ^ Sierakowski R, Finlayson B, Landes R., Stone incidence as related to water hardness in different geographical regions of the United States., in Urol Res 1979;, 7:157–60..
- ^ a b c Victoriano Romano, Haluk Akpinar e Dean G Assimos, Kidney Stones: A Global Picture of Prevalence, Incidence, and Associated Risk Factors, in Rev. Urol., vol. 12, 2010 Spring–Summer, 2010, pp. 2–3, PMC 2931286, PMID 20811557.
- ^ a b c d e f g GM Preminger, Chapter 148: Stones in the Urinary Tract, in RE Cutler (a cura di), Merck Manual of Diagnosis and Therapy, 3rd, Whitehouse Station, New Jersey, Merck Sharp and Dohme Corporation, 2007.
- ^ a b MS Pearle, EA Calhoun e GC Curhan, Ch. 8: Urolithiasis (PDF), in MS Litwin e CS Saigal (a cura di), Urologic Diseases in America (NIH Publication No. 07–5512), Bethesda, Maryland, National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, United States Public Health Service, United States Department of Health and Human Services, 2007, pp. 283–319. URL consultato il 6 novembre 2016 (archiviato dall'url originale il 18 ottobre 2011).
- ^ a b M Cavendish, Kidney disorders, in Diseases and Disorders, vol. 2, 1st, Tarrytown, New York, Marshall Cavendish Corporation, 2008, pp. 490–3, ISBN 978-0-7614-7772-3.
- ^ R Caudarella e F Vescini, Urinary citrate and renal stone disease: the preventive role of alkali citrate treatment., in Archivio Italiano di Urologia, Andrologia, vol. 81, n. 3, settembre 2009, pp. 182–7, PMID 19911682.
- ^ a b c Reilly Jr,Perazella, 2005, pp. 192–207.
- ^ Reilly Jr,Perazella, 2005, pp. 209-226.
- ^ a b c d e f Stoller, Meng, 2007, pp. 299–308..
- ^ Nephrolithiasis, su emedicine.medscape.com.
- ^ a b FL Coe, A Evan e E Worcester, Kidney stone disease, in The Journal of Clinical Investigation, vol. 115, n. 10, 2005, pp. 2598–608, DOI:10.1172/JCI26662, PMC 1236703, PMID 16200192.
- ^ a b N Johri, B Cooper, W Robertson, S Choong, D Rickards e R Unwin, An update and practical guide to renal stone management, in Nephron Clinical Practice, vol. 116, n. 3, 2010, pp. c159–71, DOI:10.1159/000317196, PMID 20606476.
- ^ JM Riley, H Kim, TD Averch e HJ Kim, Effect of magnesium on calcium and oxalate ion binding, in J Endourol, vol. 27, n. 12, Oct 2013, pp. 1487–92, DOI:10.1089/end.2013.0173, PMID 24127630.
- ^ EE del Valle, FR Spivacow e AL Negri, [Citrate and renal stones], in Medicina (B Aires), vol. 73, n. 4, 2013, pp. 363–8, PMID 23924538.
- ^ a b GC Curhan, WC Willett, EB Rimm, D Spiegelman e MJ Stampfer, Prospective study of beverage use and the risk of kidney stones, in American Journal of Epidemiology, vol. 143, n. 3, Feb 1996, pp. 240–7, DOI:10.1093/oxfordjournals.aje.a008734, PMID 8561157.
- ^ J Knight, DG Assimos, L Easter e RP Holmes, Metabolism of fructose to oxalate and glycolate, in Hormone and Metabolic Research, vol. 42, n. 12, 2010, pp. 868–73, DOI:10.1055/s-0030-1265145, PMC 3139422, PMID 20842614.
- ^ OW Moe, Kidney stones: Pathophysiology and medical management (PDF), in The Lancet, vol. 367, n. 9507, 2006, pp. 333–44, DOI:10.1016/S0140-6736(06)68071-9, PMID 16443041. URL consultato il 26 novembre 2016 (archiviato dall'url originale il 15 agosto 2011).
- ^ RV Thakker, Pathogenesis of Dent's disease and related syndromes of X-linked nephrolithiasis (PDF), in Kidney International, vol. 57, n. 3, 2000, pp. 787–93, DOI:10.1046/j.1523-1755.2000.00916.x, PMID 10720930.
- ^ a b National Endocrine and Metabolic Diseases Information Service, Hyperparathyroidism (NIH Publication No. 6–3425), su Information about Endocrine and Metabolic Diseases: A-Z list of Topics and Titles, Bethesda, Maryland, National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, Public Health Service, US Department of Health and Human Services, 2006. URL consultato il 27 luglio 2011 (archiviato dall'url originale il 24 maggio 2011).
- ^ B Hoppe e CB Langman, A United States survey on diagnosis, treatment, and outcome of primary hyperoxaluria, in Pediatric Nephrology, vol. 18, n. 10, 2003, pp. 986–91, DOI:10.1007/s00467-003-1234-x, PMID 12920626.
- ^ National Digestive Diseases Information Clearinghouse, Crohn's Disease (NIH Publication No. 06–3410), su Digestive Diseases: A-Z List of Topics and Titles, Bethesda, Maryland, National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, United States Public Health Service, United States Department of Health and Human Services, 2006. URL consultato il 27 luglio 2011 (archiviato dall'url originale il 9 giugno 2014).
- ^ RG Farmer, S Hossein Mir-Madjlessi e WS Kiser, Urinary excretion of oxalate, calcium, magnesium, and uric acid in inflammatory bowel disease: Relationship to urolithiasis, in Cleveland Clinic Quarterly, vol. 41, n. 3, 1974, pp. 109–17, DOI:10.3949/ccjm.41.3.109, PMID 4416806.
- ^ Emmanuel Letavernier e Michel Daudon, Vitamin D, Hypercalciuria and Kidney Stones, in Nutrients, vol. 10, n. 3, 17 marzo 2018, DOI:10.3390/nu10030366. URL consultato il 2 ottobre 2019.
- ^ a b Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, 2011, pp. 1–14.
- ^ a b c d e EJ Anoia, ML Paik e MI Resnick, Ch. 7: Anatrophic Nephrolithomy, in SD Graham e TE Keane (a cura di), Glenn's Urologic Surgery, 7th, Philadelphia, Lippincott Williams & Wilkins, 2009, pp. 45–50, ISBN 978-0-7817-9141-0.
- ^ SH Weaver e P Jenkins, Ch. 14: Renal and Urological Care, in Illustrated Manual of Nursing Practice, 3rd, Lippincott Williams & Wilkins, 2002, ISBN 1-58255-082-4.
- ^ American College of Emergency Physicians, Ten Things Physicians and Patients Should Question, su choosingwisely.org, 27 ottobre 2014. URL consultato il 14 gennaio 2015 (archiviato dall'url originale il 7 marzo 2014).
- ^ a b c RC Smith e M Varanelli, Diagnosis and management of acute ureterolithiasis: CT is truth, in American Journal of Roentgenology, vol. 175, n. 1, 2000, pp. 3–6, DOI:10.2214/ajr.175.1.1750003, PMID 10882237.
- ^ a b c d LST Fang, Chapter 135: Approach to the Paient with Nephrolithiasis, in AH Goroll e AG Mulley (a cura di), Primary care medicine: office evaluation and management of the adult patient, 6th, Philadelphia, Lippincott Williams & Wilkins, 2009, pp. 962–7, ISBN 978-0-7817-7513-7.
- ^ a b c d PK Pietrow e ME Karellas, Medical management of common urinary calculi (PDF), in American Family Physician, vol. 74, n. 1, 2006, pp. 86–94, PMID 16848382.
- ^ D Bushinsky, FL Coe e OW Moe, Ch. 37: Nephrolithiasis, in BM Brenner (a cura di), Brenner and Rector's The Kidney, vol. 1, 8th, Philadelphia, WB Saunders, 2007, pp. 1299–349, ISBN 978-1-4160-3105-5 (archiviato dall'url originale l'8 ottobre 2011).
- ^ RC Smith, JA Levine e AT Rosenfeld, Helical CT of urinary tract stones. Epidemiology, origin, pathophysiology, diagnosis, and management, in Radiologic Clinics of North America, vol. 37, n. 5, 1999, pp. 911–52, v, DOI:10.1016/S0033-8389(05)70138-X, PMID 10494278.
- ^ a b CM Cormier, BJ Canzoneri, DF Lewis, C Briery, L Knoepp e JB Mailhes, Urolithiasis in pregnancy: Current diagnosis, treatment, and pregnancy complications (PDF), in Obstetrical and Gynecological Survey, vol. 61, n. 11, 2006, pp. 733–41, DOI:10.1097/01.ogx.0000243773.05916.7a, PMID 17044950 (archiviato dall'url originale l'11 marzo 2012).
- ^ National Kidney and Urologic Diseases Information Clearinghouse, Kidney Stones in Adults (NIH Publication No. 08–2495), su Kidney & Urologic Diseases: A-Z list of Topics and Titles, Bethesda, Maryland, National Institute of Diabetes and Digestive and Kidney Diseases, National Institutes of Health, Public Health Service, US Department of Health and Human Services, 2007. URL consultato il 27 luglio 2011 (archiviato dall'url originale il 26 luglio 2011).
- ^ ed. Kenneth L. Becker... With 330 contributors, Principles and practice of endocrinology and metabolism, 3ª ed., Philadelphia, Pa. [u.a.], Lippincott, Williams & Wilkins, 2001, p. 684, ISBN 978-0-7817-1750-2.
- ^ Cystine stones, su UpToDate. URL consultato il 20 febbraio 2014.
- ^ Bailey & Love's/25th/1296
- ^ a b c d MT Gettman e JW Segura, Management of ureteric stones: Issues and controversies, in British Journal of Urology International, vol. 95, Supplement 2, 2005, pp. 85–93, DOI:10.1111/j.1464-410X.2005.05206.x, PMID 15720341.
- ^ JN Macaluso, Management of stone disease—bearing the burden, in The Journal of Urology, vol. 156, n. 5, 1999, pp. 1579–80, DOI:10.1016/S0022-5347(01)65452-1, PMID 8863542.
- ^ (EN) L Borghi, Meschi T, Amato F, Briganti A, Novarini A, Giannini A., Urinary volume, water and recurrences in idiopathic calcium nephrolithiasis: a 5-year randomized prospective study, in J Urol, vol. 3, n. 155, marzo 1996, pp. 839-43, PMID 8583588.
- ^ (EN) HA Fink, Akornor JW, Garimella PS, MacDonald R, Cutting A, Rutks IR, Monga M, Wilt TJ, Diet, fluid, or supplements for secondary prevention of nephrolithiasis: a systematic review and meta-analysis of randomized trials, in Eur Urol, vol. 1, n. 56, luglio 2009, pp. 72-80, PMID 19321253.
- ^ a b c C Seitz, E Liatsikos, F Porpiglia, HG Tiselius e U Zwergel, Medical therapy to facilitate the passage of stones: What is the evidence?, in European Urology, vol. 56, n. 3, settembre 2009, pp. 455–71, DOI:10.1016/j.eururo.2009.06.012, PMID 19560860.
- ^ T Campschroer, Y Zhu, D Duijvesz, DE Grobbee e MT Lock, Alpha-blockers as medical expulsive therapy for ureteral stones, in The Cochrane Database of Systematic Reviews, vol. 4, n. 4, 2 aprile 2014, pp. CD008509, DOI:10.1002/14651858.CD008509.pub2, PMID 24691989.
- ^ T Campschroer, Y Zhu, D Duijvesz, DE Grobbee e MT Lock, Alpha-blockers as medical expulsive therapy for ureteral stones, in The Cochrane database of systematic reviews, vol. 4, n. 4, 2 aprile 2014, pp. CD008509, DOI:10.1002/14651858.CD008509.pub2, PMID 24691989.
- ^ Ralph C. Wang, Rebecca Smith-Bindman, Evans Whitaker, Jersey Neilson, Isabel Elaine Allen, Marshall L. Stoller e Jahan Fahimi, Effect of Tamsulosin on Stone Passage for Ureteral Stones: A Systematic Review and Meta-analysis, in Annals of Emergency Medicine, settembre 2016, DOI:10.1016/j.annemergmed.2016.06.044.
- ^ JE Lingeman, BR Matlaga e AP Evan, Surgical Management of Urinary Lithiasis, in AJ Wein, LR Kavoussi, AC Novick, AW Partin e CA Peters (a cura di), Campbell-Walsh Urology, Philadelphia, W. B. Saunders, 2007, pp. 1431–1507.
- ^ GM Preminger, HG Tiselius, DG Assimos, P Alken, AC Buck, M Gallucci, T Knoll, JE Lingeman, SY Nakada, MS Pearle, K Serica, C Türk e JS, Jr Wolf, 2007 Guideline for the management of ureteral calculi, in The Journal of Urology, vol. 178, n. 6, 2007, pp. 2418–34, DOI:10.1016/j.juro.2007.09.107, PMID 17993340.
- ^ a b c AP Evan e LR Willis, Ch. 41: Extracorporeal Shock Wave Lithotripsy: Complications, in AD Smith, GH Badlani, DH Bagley, RV Clayman e SG Docimo (a cura di), Smith's Textbook on Endourology, Hamilton, Ontario, Canada, B C Decker, Inc., 2007, pp. 353–65.
- ^ a b AP Evan e JA McAteer, Ch. 28: Q-effects of Shock Wave Lithotripsy, in FL Coe, MJ Favus, CYC Pak, JH Parks e GM Preminger (a cura di), Kidney Stones: Medical and Surgical Management, Philadelphia, Lippincott-Raven, 1996, pp. 549–60.
- ^ a b MS Parmar, Kidney stones, in British Medical Journal, vol. 328, n. 7453, 2004, pp. 1420–4, DOI:10.1136/bmj.328.7453.1420, PMC 421787, PMID 15191979.
- ^ JB Wynberg, JF Borin, JZ Vicena, V Hannosh e SA Salmon, Flexible ureteroscopy-directed retrograde nephrostomy for percutaneous nephrolithotomy: description of a technique., in J Endourol, vol. 26, n. 10, Oct 2012, pp. 1268–74, DOI:10.1089/end.2012.0160, PMID 22563900.
- ^ Stoller, Meng, 2007, pp. 465–83.
- ^ Rao, Preminger, Kavanagh, 2011, pp. 301–10.
- ^ a b c d e Harrison, Principi di Medicina Interna (16ª edizione), New York - Milano, McGraw-Hill, 2006, ISBN 88-386-2459-3.
- ^ a b HA Fink, TJ Wilt, KE Eidman, PS Garimella, R MacDonald, IR Rutks, M Brasure, RL Kane, J Ouellette e M Monga, Medical management to prevent recurrent nephrolithiasis in adults: A systematic review for an American College of Physicians clinical guideline, in Annals of Internal Medicine, vol. 158, n. 7, 2 aprile 2013, pp. 535–43, DOI:10.7326/0003-4819-158-7-201304020-00005, PMID 23546565.
- ^ a b c A Qaseem, P Dallas, MA Forciea, M Starkey, TD Denberg e Physicians Clinical Guidelines Committee of the American College of, Dietary and pharmacologic management to prevent recurrent nephrolithiasis in adults: a clinical practice guideline from the American College of Physicians., in Annals of Internal Medicine, vol. 161, n. 9, 4 novembre 2014, pp. 659–67, DOI:10.7326/m13-2908, PMID 25364887.
- ^ DS Goldfarb e FL Coe, Prevention of recurrent nephrolithiasis, in American Family Physician, vol. 60, n. 8, 1999, pp. 2269–76, PMID 10593318. URL consultato il 10 novembre 2016 (archiviato dall'url originale il 22 agosto 2005).
- ^ a b VA Finkielstein e DS Goldfarb, Strategies for preventing calcium oxalate stones, in Canadian Medical Association Journal, vol. 174, n. 10, 2006, pp. 1407–9, DOI:10.1503/cmaj.051517, PMC 1455427, PMID 16682705.
- ^ R Paterson, A Fernandez, H Razvi e R Sutton, Evaluation and medical management of the kidney stone patient, in Canadian Urological Association Journal, vol. 4, n. 6, 2010, pp. 375–9, DOI:10.5489/cuaj.10166, PMC 2997825, PMID 21191493.
- ^ Penniston, Kristina, PhD, RD. Citric Acid and Kidney Stones. UW Hospital Metabolic Stone Clinic. Accesso: 8 marzo 2015.
- ^ EN Taylor e Curhan, GC, Diet and fluid prescription in stone disease, in Kidney International, vol. 70, n. 5, settembre 2006, pp. 835–9, DOI:10.1038/sj.ki.5001656, PMID 16837923.
- ^ What are kidney stones?, su kidney.org. URL consultato il 19 agosto 2013 (archiviato dall'url originale il 14 maggio 2013).
- ^ RP Heaney, Nutrition and Chronic Disease (PDF), in Mayo Clinic Proceedings, vol. 81, n. 3, 2006, pp. 297–9, DOI:10.4065/81.3.297, PMID 16529131. URL consultato il 27 luglio 2011 (archiviato dall'url originale il 16 luglio 2011).
- ^ HG Tiselius, Epidemiology and medical management of stone disease, in British Journal of Urology International, vol. 91, n. 8, 2003, pp. 758–67, DOI:10.1046/j.1464-410X.2003.04208.x, PMID 12709088.
- ^ a b c EN Taylor, MJ Stampfer e GC Curhan, Dietary factors and the risk of incident kidney stones in men: New insights after 14 years of follow-up (PDF), in Journal of the American Society of Nephrology, vol. 15, n. 12, 2004, pp. 3225–32, DOI:10.1097/01.ASN.0000146012.44570.20, PMID 15579526.
- ^ E Cicerello, F Merlo e L Maccatrozzo, Urinary alkalization for the treatment of uric acid nephrolithiasis, in Archivio Italiano di Urologia, Andrologia, vol. 82, n. 3, Sep 2010, pp. 145–8, PMID 21121431.
- ^ JS Cameron e HA Simmonds, Use and abuse of allopurinol, in British Medical Journal, vol. 294, n. 6586, 1987, pp. 1504–5, DOI:10.1136/bmj.294.6586.1504, PMC 1246665, PMID 3607420.
Bibliografia[modifica | modifica wikitesto]
- (EN) David A. Schulsinger, Kidney Stone Disease: Say NO to Stones!, Springer, 2014, ISBN 978-3-319-12105-5.
- (EN) H Ellis, A History of Bladder Stone, Oxford, England, Blackwell Scientific Publications, 1969, ISBN 978-0-632-06140-2.
- Francesco Porpiglia, Manuale di Urologia, Torino, Minerva Medica, 2015, ISBN 978-88-7711-834-9.
- (EN) M Cavendish, Kidney disorders, in Diseases and Disorders, vol. 2, 1st, Tarrytown, New York, Marshall Cavendish Corporation, 2008, ISBN 978-0-7614-7772-3.
- (EN) SH Weaver e P Jenkins, Ch. 14: Renal and Urological Care, in Illustrated Manual of Nursing Practice, 3rd, Lippincott Williams & Wilkins, 2002, ISBN 1-58255-082-4.
- (EN) D Bushinsky, FL Coe e OW Moe, Brenner and Rector's The Kidney, a cura di BM Brenner, vol. 1, 8th, Philadelphia, WB Saunders, 2007, ISBN 978-1-4160-3105-5.
- (EN) ed. Kenneth L. Becker... With 330 contributors, Principles and practice of endocrinology and metabolism, 3ª ed., Philadelphia, Pa. [u.a.], Lippincott, Williams & Wilkins, 2001, ISBN 978-0-7817-1750-2.
- (EN) EJ Anoia, ML Paik e MI Resnick, Ch. 7: Anatrophic Nephrolithomy, in SD Graham e TE Keane (a cura di), Glenn's Urologic Surgery, 7th, Philadelphia, Lippincott Williams & Wilkins, 2009, ISBN 978-0-7817-9141-0.
- Harrison, Principi di Medicina Interna (16ª edizione), New York - Milano, McGraw-Hill, 2006, ISBN 88-386-2459-3.
- (EN) LST Fang, Chapter 135: Approach to the Paient with Nephrolithiasis, in AH Goroll e AG Mulley (a cura di), Primary care medicine: office evaluation and management of the adult patient, 6th, Philadelphia, Lippincott Williams & Wilkins, 2009, ISBN 978-0-7817-7513-7.
- (EN) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium, Institute of Medicine of the National Academies, Dietary Reference Intakes for Calcium and Vitamin D, a cura di AC Ross, CL Taylor, AL Yaktine e HB Del, Washington, DC, The National Academies Press, 2011, ISBN 978-0-309-16394-1.
- (EN) PN Rao, GM Preminger e JP Kavanagh (a cura di), Urinary Tract Stone Disease, 1st, London, Springer-Verlag, 2011, DOI:10.1007/978-1-84800-362-0_26, ISBN 978-1-84800-361-3.
- (EN) RF Reilly Jr. e MA Perazella (a cura di), Nephrology in 30 Days, 1st, New York, The McGraw-Hill Companies, Inc., 2005, ISBN 0-07-143701-0.
- (EN) ML Stoller e MV Meng (a cura di), Urinary stone disease: the practical guide to medical and surgical management, 1st, Totowa, New Jersey, Humana Press, 2007, ISBN 978-1-59259-972-1.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni sulla nefrolitiasi
Wikiquote contiene citazioni sulla nefrolitiasi Wikimedia Commons contiene immagini o altri file sulla nefrolitiasi
Wikimedia Commons contiene immagini o altri file sulla nefrolitiasi
Collegamenti esterni[modifica | modifica wikitesto]
- (EN) kidney stone, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 55077 · LCCN (EN) sh85072259 · GND (DE) 4171884-7 · BNF (FR) cb14609741f (data) · J9U (EN, HE) 987007543430205171 |
|---|



