Modello solitonico
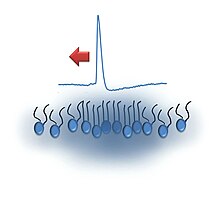
Il modello solitonico, o modello del solitone, in neuroscienze, è un modello recentemente sviluppato che tenta di spiegare la propagazione del segnale lungo l'assone dei neuroni. Il modello propone che il segnale viaggi lungo la membrana cellulare sotto forma di pulsazioni di onde sonore (o di densità), note come solitoni. Il modello presenta una deviazione e una sfida diretta al modello di Hodgkin-Huxley, largamente accettato, che propone la propagazione del segnale sotto forma di potenziale d'azione: canali ionici presenti nella membrana si aprono e permettono agli ioni un rapido ingresso nella cellula, portando all'apertura di canali adiacenti, e così propagando il segnale in maniera essenzialmente elettrica.
Storia[modifica | modifica wikitesto]
Il modello del solitone fu sviluppato agli inizi del 2005 da Thomas Heimburg e Andrew D. Jackson,[1][2][3] entrambi dell'Istituto Niels Bohr dell'Università di Copenaghen. Heimburg è capo del gruppo di biofisica delle membrane, e fino al 2007 tutti gli articoli sul modello del solitone sono stati pubblicati da questo gruppo. Recentemente, invece, il gruppo di fisica biologica di Matthias Schneider ha apportato evidenze sperimentali cruciali sulla propagazione di onde sonore bidimensionali in interfacce lipidiche e il loro possibile ruolo nella segnalazione cellulare.[4][5][6][7]
Giustificazione[modifica | modifica wikitesto]
Il modello ha alla base l'osservazione che le membrane cellulari hanno sempre un punto di congelamento (la temperatura sotto la quale la loro consistenza cambia da fluido a gel) solo leggermente inferiore alla temperatura corporea, e ciò permette la propagazione dei solitoni. È noto da molte decadi che un potenziale d'azione viaggiante lungo un neurone porta a un leggero innalzamento della temperatura, successivamente seguito da un leggero abbassamento.[8] La pulsazione totale non rilascia calore, la somma netta è 0. L'abbassamento nella seconda fase del potenziale d'azione non è spiegato dal modello di Hodgkin–Huxley (cariche elettriche viaggianti lungo un resistore producono sempre calore), ma i solitoni viaggianti non perdono energia in questo modo, e il modello della temperatura osservato nei neuroni è consistente con il modello dei solitoni.
Inoltre è stato osservato che un segnale viaggiante lungo un neurone porta a un leggero ispessimento locale della membrana e a una forza agente verso l'esterno;[9] questo effetto non è spiegato dal modello di Hodgkin–Huxley ma è consistente con il modello solitonico.
È innegabile che si possa osservare un segnale elettrico quando un potenziale d'azione si propaga lungo un neurone. Il modello del solitone lo spiega nel seguente modo: il solitone viaggiante cambia localmente densità e spessore della membrana, e dato che la membrana contiene molte sostanze cariche e polari, ciò risulterà in un effetto elettrico, con un meccanismo simile a quello della piezoelettricità. Queste onde sonore non lineari sono state osservate su interfacce lipidiche, e le evidenze sperimentali mostrano molte smilarità con i potenziali d'azione (accoppiamento elettro-opto-meccanico, velocità, forma bifasica, soglia di eccitazione, etc.)[5]
Formalismo matematico[modifica | modifica wikitesto]
Il solitone rappresentante il potenziali d'azione di nervi è soluzione dell'equazione alle derivate parziali:
dove t è il tempo e x è la posizione lungo l'assone del nervo. Δρ è il cambiamento nella densità della membrana sotto l'influenza del potenziale d'azione, c0 è la velocità del suono nella membrana, p e q descrivono la natura della transizione di fase e quindi la non linearità delle costanti elastiche della membrana. I parametri c0, p e q sono dovuti a proprietà termodinamiche della membrana e non possono essere variati liberamente, devono essere determinati sperimentalmente. Il parametro h descrive la dipendenza dalla frequenza del suono della relazione di dispersione della membrana.
L'equazione è formalmente correlata all'approssimazione di Boussinesq per le onde marine, ad esempio per solitoni in canali d'acqua. Le soluzioni dell'equazione hanno un'ampiezza massima limitante e una velocità di propagazione minima, simile alla velocità di pulsazione nei nervi mielinizzati. Vi sono soluzioni periodiche che dimostrano l'iperpolarizzazione e i periodi di refrattarietà.[10]
Ruolo nei canali ionici[modifica | modifica wikitesto]
Il modello solitonico spiega molti aspetti del potenziale d'azione che non vengono spiegati dal modello di Hodgkin–Huxley. Essendo di natura termodinamica non si riferisce alla natura e alle proprietà delle singole macromolecole (come i canali ionici o altre proteine) su scala molecolare. Piuttosto si assume che le loro proprietà sono implicitamente contenute nelle proprietà dell'intero sistema (la membrana neuronale). Il modello non è dunque in conflitto né con l'azione delle proteine di membrana né con la farmacologia. Il modello solitonico predice correttamente fluttuazioni di corrente durante il potenziale d'azione. Queste correnti sono simili a quelle teoricamente dovute ai canali ionici,[11] ma nel modello solitonico sono dovute a pori che si formano spontaneamente sulla membrana lipidica da fluttuazioni termiche, che sono alla base del modello.
Applicazioni in anestesia[modifica | modifica wikitesto]
Gli autori affermano che il loro modello spiega il funzionamento di molti anestetici il cui meccanismo d'azione era prima sconosciuto. L'osservazione di Meyer-Overton (vedi concentrazione minima alveolare) mantiene che la potenza di una varietà chimicamente ampia di anestetici è proporzionale alla loro solubilità lipidica, suggerendo che essi non agiscono legandosi a specifiche proteine o canali ionici ma piuttosto dissolvendosi nella membrana lipidica e cambiandone le proprietà. Questa dissoluzione abbassa il punto di congelamento della membrana, e la maggior differenza tra temperatura corporea e punto di congelamento inibisce la propagazione dei solitoni.[12] Questa differenza può essere riportata nella normalità aumentando la pressione, abbassando il pH, o abbassando la temperatura. La pressione necessaria a cancellare l'effetto di un anestetico con una data solubilità lipidica può essere calcolato con il modello solitonico, ed è ragionevolmente in accordo con le evidenze sperimentali.
Note[modifica | modifica wikitesto]
- ^ Heimburg, T., Jackson, A.D., On soliton propagation in biomembranes and nerves, in Proc. Natl. Acad. Sci. U.S.A., vol. 102, 12 luglio 2005, p. 9790, Bibcode:2005PNAS..102.9790H, DOI:10.1073/pnas.0503823102.
- ^ Heimburg, T., Jackson, A.D., On the action potential as a propagating density pulse and the role of anesthetics, in Biophys. Rev. Lett., vol. 2, 2007, pp. 57–78, Bibcode:2006physics..10117H, DOI:10.1142/S179304800700043X, arXiv:physics/0610117.
- ^ Andersen, S.S.L., Jackson, A.D., Heimburg, T., Towards a thermodynamic theory of nerve pulse propagation, in Progr. Neurobiol., vol. 88, 2009, pp. 104–113, DOI:10.1016/j.pneurobio.2009.03.002.
- ^ J Griesbauer, Bossinger S Wixforth A Schneider M, Propagation of 2D Pressure Pulses in Lipid Monolayers and Its Possible Implications for Biology, in Physical Review Letters, vol. 108, 9 maggio 2012, DOI:10.1103/PhysRevLett.108.198103.
- ^ a b Shamit Shrivastava, Schneider Matthias, Evidence for two-dimensional solitary sound waves in a lipid controlled interface and its implications for biological signalling, in Royal Society Interface, vol. 11, 18 giugno 2014, DOI:10.1098/rsif.2014.0098.
- ^ J Griesbauer, Bossinger S Wixforth A Schneider M, Simultaneously propagating voltage and pressure pulses in lipid monolayers of pork brain and synthetic lipids, in Physical Review E, vol. 86, 19 dicembre 2012, DOI:10.1103/PhysRevE.86.061909.
- ^ Shamit Shrivastava, NON-LINEAR SOLITARY SOUND WAVES IN LIPID MEMBRANES AND THEIR POSSIBLE ROLE IN BIOLOGICAL SIGNALING, 1ª ed., Boston, MA 02215 US, Thesis, Boston University, gennaio 2014.
- ^ Abbott, B.C., Hill, A.V., Howarth, J.V., The positive and negative heat associated with a nerve impulse, in Proceedings of the Royal Society B, vol. 148, 1958, pp. 149–187, Bibcode:1958RSPSB.148..149A, DOI:10.1098/rspb.1958.0012.
- ^ Iwasa, K., Tasaki I., Gibbons, R., Swelling of nerve fibres associated with action potentials, in Science, vol. 210, 1980, pp. 338–9, Bibcode:1980Sci...210..338I, DOI:10.1126/science.7423196, PMID 7423196.
- ^ Villagran Vargas, E., Ludu, A., Hustert, R., Gumrich, P., Jackson, A.D., Heimburg, T., Periodic solutions and refractory periods in the soliton theory for nerves and the locust femoral nerve, in Biophysical Chemistry, 153 –3, 2010, pp. 159–167, DOI:10.1016/j.bpc.2010.11.001, PMID 21177017, arXiv:1006.3281.
- ^ Heimburg, T., Lipid Ion Channels, in Biophys. Chem., 150 –3, 2010, pp. 2–22, DOI:10.1016/j.bpc.2010.02.018, PMID 20385440, arXiv:1001.2524.
- ^ Heimburg, T., Jackson, A.D., The thermodynamics of general anesthesia, in Biophys. J., vol. 92, 2007, pp. 3159–65, Bibcode:2007BpJ....92.3159H, DOI:10.1529/biophysj.106.099754, PMC 1852341, PMID 17293400, arXiv:physics/0610147.
Voci correlate[modifica | modifica wikitesto]
- Modelli del neurone biologico
- Modello di Hodgkin-Huxley
- Neurone artificiale
- Solitone
- Solitone vettoriale
Collegamenti esterni[modifica | modifica wikitesto]
- On the (sound) track of anesthetics, Eurekalert, da un comunicato stampa dell'Università di Copenaghen, 6 marzo 2007
- On the (sound) track of anesthetics, ScienceLine
- Kaare Græsbøll, Function of Nerves — Action of Anesthetics (PDF), in Gamma, vol. 143, 2006. URL consultato il 1º febbraio 2015 (archiviato dall'url originale il 3 marzo 2016). Un'introduzione elementare.
- Pradip Das, W.H. Schwarz, Solitons in cell membrane, in Physical Review E, vol. 51, 4 novembre 1994, p. 3588, Bibcode:1995PhRvE..51.3588D, DOI:10.1103/PhysRevE.51.3588.
- Konrad Kauffman (1989) "Potenziali d'azione e accoppiamento elettrochimico nelle membrane fosfolipidiche chirali macroscopiche".
![{\displaystyle {\frac {\partial ^{2}\Delta \rho }{\partial t^{2}}}={\frac {\partial }{\partial x}}\left[\left(c_{0}^{2}+p\Delta \rho +q\Delta \rho ^{2}\right){\frac {\partial \Delta \rho }{\partial x}}\right]-h{\frac {\partial ^{4}\Delta \rho }{\partial x^{4}}},}](https://wikimedia.org/api/rest_v1/media/math/render/svg/49468442896ff1edd5f1297b1a2253d2dee7a782)