P-glicoproteina
| ATPasi trasportatrice di xenobiotici | |
|---|---|
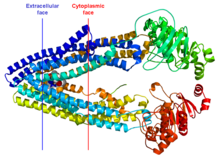 Struttura cristallina della MDR3 murina. La posizione approssimata della proteina nella membrana cellulare è indicata dalle linee rossa (lato citoplasmatico) e blu (lato extracellulare). La proteina è rappresentata come cartoon ad arcobaleno (estremità N-terminale in blu, C-terminale in rosso). | |
| Numero EC | 3.6.3.44 |
| Classe | Idrolasi |
| Nome sistematico | |
| ATP fosfoidrolasi (esportatrice di xenobiotici) | |
| Altri nomi | |
| multidrug-resistance protein; proteina MDR; P-glicoproteina; pleiotropic-drug-resistance protein; proteina PDR; steroid-transporting ATPase; ATP phosphohydrolase (steroid-exporting) | |
| Banche dati | BRENDA, EXPASY, GTD, PDB (RCSB PDB PDBe PDBj PDBsum) |
| Fonte: IUBMB | |
| P-glicoproteina | |
|---|---|
| Gene | |
| HUGO | ABCB1 ABC20, CD243, GP170, P-gp |
| Locus | Chr. 7 q21.12 |
| Proteina | |
| OMIM | 171050 |
| UniProt | P08183 |
La P-glicoproteina 1 (glicoproteina di permeabilità, abbreviata P-gp o Pgp) anche nota come proteina di resistenza multifarmaco 1 (MDR1)[1] o ATP-binding cassette sottofamiglia B membro 1 (ABCB1) o cluster di differenziazione 243 (CD243) è una glicoproteina di membrana con funzione di pompa la cui attività nota sembra essere quella di estrudere dal citoplasma sostanze anfipatiche neutre o debolmente basiche penetrate nella cellula. Consuma ATP. È un trasportatore ABC[2] codificato nell'uomo dal gene ABCB1.
La Pgp è distribuita in modo estensivo ed espressa da neuroni, astrociti, cellule endoteliali, placenta, trofoblasto, ovaie, testicoli e cellule tumorali, enterociti (riduce l'assorbimento di sostanze tossiche), epatociti, cellule tubulari renali.
La p-glicoproteina svolge quindi una funzione di barriera funzionale tra questi tessuti e il sangue. Svolge un importante ruolo protettivo di distretti "nobili" come il sistema nervoso centrale (contribuisce alla formazione della barriera ematoencefalica), feto e gonadi.
Funzione[modifica | modifica wikitesto]
La P-glicoproteina è una proteina di membrana che appartiene alla superfamiglia dei trasportatori ABC. Le proteine ABC trasportano varie molecole attraverso le membrane intra- ed extracellulari. I geni ABC si dividono in 7 sottofamiglie (ABC1, MDR/TAP, MRP, ALD, OABP, GCN20, White), questa proteina è membro della sottofamiglia MDR/TAP. Come tutti i membri della sua sottofamiglia la Pgp è coinvolta nei processi di resistenza multifarmaco. Si tratta di una pompa di efflusso per composti xenobiotici che accetta un ampio spettro di substrati. È responsabile del diminuito accumulo di farmaco nelle cellule multifarmaco-resistenti e spesso media lo sviluppo di resistenza nei confronti di farmaci anticancro. La P-glicoproteina funge anche da trasportatore nella barriera emato-encefalica[3]
L'ABCB1 è una pompa di efflusso ATP-dipendente che accetta substrati con diverse strutture, per questo si ritiene che si sia evoluta come meccanismo di difesa contro le sostanze tossiche.
La Pgp trasporta vari substrati attraverso la membrana cellulare, tra cui:
- Farmaci come la colchicina il tacrolimus e la chinidina
- Chemioterapici come l'etoposide, la doxorubicina e la vinblastina
- Lipidi
- Steroidi
- Xenobiotici
- Peptidi
- Bilirubina
- Glicosidi cardiotonici come la digossina
- Immunosoppressori
- Glucocorticoidi come il desametasone
- Agenti antiretrovirali per l'HIV di tipo 1 come inibitori delle proteasi e inibitori della retrotrascrittasi nonnucleosidici.
La sua abilità nel trasportare i substrati precedenti ne giustifica i molti ruoli che svolge tra cui:
- Regolazione della distribuzione e della biodisponibilità dei farmaci
- L'accresciuta espressione di P-glicoproteina può ridurre l'assorbimento di farmaci che sono suoi substrati. Ne conseguono una ridotta biodisponibilità ed il mancato raggiungimento delle concentrazioni plasmatiche terapeutiche di farmaco. D'altra parte concentrazioni plasmatiche di farmaco troppo elevate e conseguente tossicità possono derivare da una diminuita espressione genica di Pgp
- Trasporto attivo di antitumorali che genera resistenza multifarmaco
- Rimozione di metaboliti tossici e xenobiotici dalle cellule verso l'urina, la bile ed il lume intestinale
- Trasporto di composti fuori dal cervello attraverso la barriera emato-encefalica
- Uptake di digossina
- Impedimento all'ingresso nel sistema nervoso centrale da parte della ivermectina
- Migrazione delle cellule dendritiche
- Protezione delle cellule staminali ematopoietiche da tossine.[2]
P-glicoproteina e tumori[modifica | modifica wikitesto]
Nelle cellule tumorali la P-glicoproteina può essere espressa in misura maggiore rispetto alle cellule normali. Assieme ad altri trasportatori (MRP Multidrug Resistance-associated Proteins; BCRP Breast Cancer Resistance Protein; proteine TAP1 e TAP2) è coinvolta nella resistenza farmacologica agli antiblastici.
Antracicline, etoposide e paclitaxel sono solo alcuni dei substrati della P-glicoproteina la cui concentrazione all'interno delle cellule tumorali può essere aumentata del 40-50% inibendo la funzione della P-gp.
Approcci farmacologici[modifica | modifica wikitesto]
I farmaci capaci di inibire l'attività di questa pompa si distinguono in
- Farmaci di prima e seconda generazione: (calcio antagonisti, antipsicotici, antiaritmici, antimalarici, immunosoppressori) ossia farmaci già in uso con altre indicazioni che inibiscono la funzione della p-glicoproteina se somministrati ad alte dosi alle quali però presentano elevata tossicità.
- Farmaci di terza generazione: dotati di attività specifica verso la P-glicoproteina, attualmente in sperimentazione (biricodar, elacridar, tariquidar, zosuquinidar).
Altri aspetti[modifica | modifica wikitesto]
La P-gp è anche presente, come detto, su rene, fegato e intestino dove regola il transito di numerose sostanze (tra cui farmaci) nei suddetti tipi cellulari. La P-glicoproteina sembra inoltre modulare l'attività di alcune isoforme del citocromo P450. È intuitivo che la sua funzione (e l'inibizione farmacologica delle sue funzioni) presenta dei complessi aspetti farmacocinetici di interazione con farmaci di cui può modulare assorbimento, distribuzione, metabolismo ed escrezione.
In effetti l'azione della P-gp è alla base della scarsa penetrazione di farmaci e xenobiotici nei tessuti che esprimono ad alti livelli tale proteina. Un esempio tipico è il sistema nervoso centrale. In questa sede, infatti, oltre alla presenza della barriera emato-encefalica, si riscontra un'alta espressione di P-gp e OATP (organic anion transporter polypetide) sulla membrana delle cellule endoteliali: questo fa sì che i farmaci vengano facilmente estrusi dal SNC, con conseguente difficoltà nel raggiungimento della concentrazione terapeutica.
Note[modifica | modifica wikitesto]
- ^ Ueda K, Clark DP, Chen CJ, Roninson IB, Gottesman MM, Pastan I, The human multidrug resistance (mdr1) gene. cDNA cloning and transcription initiation, in J. Biol. Chem., vol. 262, n. 2, gennaio 1987, pp. 505–8, PMID 3027054. URL consultato il 16 giugno 2012 (archiviato dall'url originale il 26 luglio 2008).
- ^ a b Dean, Michael, The Human ATP-Binding Cassette (ABC) Transporter Superfamily, su ncbi.nlm.nih.gov, National Library of Medicine (US), NCBI, 1º novembre 2002. URL consultato il 2 marzo 2008 (archiviato dall'url originale il 12 febbraio 2006).
- ^ Entrez Gene: ABCB1, su ncbi.nlm.nih.gov.
Voci correlate[modifica | modifica wikitesto]
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su P-glicoproteina
Wikimedia Commons contiene immagini o altri file su P-glicoproteina
Collegamenti esterni[modifica | modifica wikitesto]
- farmacovigilanza.org. URL consultato il 2 agosto 2008 (archiviato dall'url originale il 6 maggio 2008).