Transaminazione
La transaminazione è una reazione chimica in cui il gruppo α-amminico di un amminoacido viene trasferito ad un α-chetoacido (generalmente all'α-chetoglutarato), generando contemporaneamente un nuovo amminoacido e l'α-chetoacido corrispondente all'amminoacido.
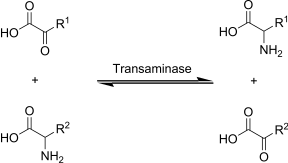
La transaminazione rappresenta la prima tappa del catabolismo degli amminoacidi, essendo la via metabolica che permette la deaminazione della maggior parte degli amminoacidi. Inoltre le reazioni di transaminazione permettono di convertire amminoacidi essenziali in amminoacidi non essenziali (ovvero quelli che l'organismo è in grado di sintetizzare ex novo).
Da un punto di vista biochimico le reazioni sono catalizzate da diversi enzimi, detti aminotransferasi o transaminasi, ognuno dei quali è specifico per un dato amminoacido. Poiché si tratta di una reazione in condizione di equilibrio, i prodotti della reazione dipendono dalla disponibilità dei diversi α-chetoacidi presenti all'interno della cellula.
Nella cellula la transaminazione è anche utilizzata per produrre α-chetoacidi utili per il metabolismo, un esempio è la reazione che coinvolge l'ossaloacetato ed il glutammato, principale collettore dei gruppi amminici derivanti dal catabolismo degli amminoacidi nei tessuti extra-epatici:
- Glutammato + ossaloacetato ↔ α-chetoglutarato + aspartato
L'ossalacetato è un α-chetoacido necessario per la gluconeogenesi e l'α-chetoglutarato incrementa il ciclo di Krebs.
Meccanismo di reazione[modifica | modifica wikitesto]
La reazione di transaminazione avviene grazie alla presenza del coenzima contenente un gruppo aldeidico, il piridossal-5'-fosfato (PLP), un derivato della piridossina (vitamina B6). La reazione catalizzata dalla transaminasi avviene in due step (meccanismo a "ping-pong"). Nel primo, il gruppo α-amminico di un amminoacido viene trasferito all'enzima, producendo il corrispondente α-chetoacido e la forma amminata del coenzima PLP, denominata PMP (pridossammina-5'-fosfato). Nel secondo step il gruppo amminico è trasferito al chetoacido accettore, generando il nuovo amminoacido e ripristinando il coenzima PLP nella sua forma iniziale.

Descrizione meccanismo[modifica | modifica wikitesto]
Il PLP forma un legame covalente con l'enzima tramite la condensazione del suo gruppo aldeidico con il gruppo ε-amminico di un residuo di lisina (Lys), il PLP è quindi un cofattore, il gruppo prostetico delle aminotransferasi. La base di Schiff formatasi è chiamata "aldimmina interna" ed è il sito attivo dell'enzima, proprietà dovuta alla sua coniugazione con l'anello piridinico. Quando entra nel sito attivo dell'enzima, l'amminoacido substrato si sostituisce alla Lys nella formazione della base di Schiff grazie a una “transimminazione”.
Una volta formata "l’aldimmina esterna", la sottrazione di un protone da parte di un gruppo basico del sito attivo (catalisi basica generale) porta alla formazione di una carica negativa sul carbonio α. Si ha quindi un intermedio carbanionico stabilizzato per risonanza: la delocalizzazione della carica negativa è possibile grazie al flusso di elettroni attraverso un complesso sistema di doppi legami coniugati, che porta alla neutralizzazione della carica positiva presente nell’anello piridinico del PLP. Il coinvolgimento dell’azoto piridinico caricato positivamente in una “trappola per elettroni” è simile al caso dell’anello tiazolico della tiamina pirofosfato (TPP) nelle reazioni catalizzate da piruvato deidrogenasi e transchetolasi e nel caso della base di Schiff protonata nelle reazioni catalizzate da aldolasi e transaldolasi. La struttura limite di risonanza in cui è stata neutralizzata la carica positiva nell’anello piridinico è l’intermedio chinonoide, così chiamato per la posizione dei doppi legami nell’anello simile a quella di un chinone.
Dopo la formazione dell’intermedio chinonoide si può ammettere che sia questa specie a procedere nella reazione attraverso una addizione elettrofila di protone al doppio legame C=C. Questo determina la rottura del doppio legame e la concomitante formazione di un carbocatione sull’anello piridinico, la cui carica viene neutralizzata grazie al riarrangiamento dei doppi legami, che ripristina l’anello piridinico con la carica positiva sull’atomo di azoto. In questo modo si è ottenuta una base di Schiff protonata (chetimmina), la cui idrolisi rilascia un α-chetoacido.
L'amminoacido iniziale si è quindi trasformato in α-chetoacido, uno dei due prodotti della reazione di transaminazione, mentre il suo gruppo amminico è ora transitoriamente incorporato nella PMP. La sequenza di reazioni rappresenta solo una parte della reazione complessiva catalizzata dalle transaminasi. Per completare la reazione, un nuovo α-chetoacido sostituisce quello rilasciato e, acquisendo il gruppo amminico della piridossammina-5'-fosfato, viene convertito nell’amminoacido corrispondente (ovvero il secondo prodotto di reazione), tramite la stessa sequenza di reazioni che si svolgono al contrario, riformando il coenzima iniziale PLP.
Meccanismo alternativo[modifica | modifica wikitesto]
Un secondo tipo di transaminazione è descritto come una sostituzione nucleofila di un'ammina o di un anione ammidico ad un'ammina o a un sale d'ammonio. Per esempio, l'attacco di un anione ammidico ad un'ammina primaria è utilizzato per produrre ammine secondarie:
RNH2 + R'NH− → RR'NH + NH2−
In laboratorio è possibile preparare ammine secondarie simmetriche usando il nichel Raney (2RNH2 → R2NH + NH3). Infine, i sali d'ammonio quaternari possono essere dealchilati usando etanolammina:
R4N+ + NH2CH2CH2OH → R3N + RN+H2CH2CH2OH
Anche gli amminonaftaleni subiscono una reazione di transaminazione durante il loro catabolismo.
Tipi di aminotransferasi[modifica | modifica wikitesto]
La reazione di transaminazione può essere catalizzata da alcuni enzimi differenti: possono essere specifici per singoli amminoacidi, oppure possono catalizzare la reazione per gruppi di amminoacidi composti da unità chimicamente simili, come avviene per il gruppo di amminoacidi a catena ramificata, il quale comprende leucina, isoleucina e valina. I tipi più comuni di transaminasi sono l'alanina transaminasi (ALT) e l'aspartato aminotransaminasi (AST).
Altri progetti[modifica | modifica wikitesto]
 Wikimedia Commons contiene immagini o altri file su Transamminazione
Wikimedia Commons contiene immagini o altri file su Transamminazione
Collegamenti esterni[modifica | modifica wikitesto]
- transamminazióne, su sapere.it, De Agostini.
| Controllo di autorità | Thesaurus BNCF 41290 |
|---|