Cronologia della chimica

Questa cronologia della chimica elenca scoperte, idee, invenzioni, esperimenti e contributi importanti che hanno significativamente cambiato le conoscenze umane nel campo della chimica, scienza moderna definita come studio scientifico della composizione della materia e delle sue trasformazioni. La storia della chimica in senso moderno iniziò probabilmente con lo scienziato inglese Robert Boyle, anche se le sue radici si possono far risalire ai primi documenti storici.
Le prime idee che furono in seguito incorporate nella scienza moderna della chimica provengono da due fonti principali. I filosofi naturali (come Aristotele e Democrito) utilizzarono il metodo deduttivo nel tentativo di spiegare il comportamento del mondo circostante. Gli alchimisti (come Geber e Rhazes) utilizzarono tecniche sperimentali nel tentativo di prolungare la vita o di convertire materiali, ad esempio per trasformare i metalli vili in oro.
Nel XVII secolo, una sintesi delle idee di questi due approcci, quello deduttivo e quello sperimentale, portarono allo sviluppo di una forma di pensiero nota come metodo scientifico. Con l'introduzione del metodo scientifico nacque la scienza moderna della chimica.
La chimica è nota anche come scienza centrale, dato che influenza fortemente ed è fortemente influenzata da molti altri campi scientifici e tecnologici. Molti eventi considerati basilari per la nostra comprensione moderna della chimica costituiscono anche scoperte fondamentali in altri settori, tra i quali la fisica, la biologia, l'astronomia, la geologia e la scienza dei materiali.[1]
Chimica antica[modifica | modifica wikitesto]


È discutibile considerare "chimici" in senso moderno i personaggi nominati in questa sezione, dato che il metodo scientifico è stato applicato alla chimica solo molto più tardi. Tuttavia merita elencare qui le idee di grandi pensatori sia per la loro capacità di previsione, sia perché le loro idee hanno avuto vasta diffusione e sono state ritenute valide per lungo tempo.
- circa 3000 a.C.
- Gli egizi formulano la teoria dell'Ogdoade, insieme di otto divinità primigenie che risiedevano nel Caos. Gli dei dell'Ogdoade sono responsabili della creazione, in particolare del sole.[2]
- circa 1200 a.C.
- Tapputi-Belatekallim, una sovrintendente del Palazzo Reale, utilizza prodotti chimici per fabbricare profumi in Mesopotamia, come riportato su una tavoletta in cuneiforme.[3]
- circa 450 a.C.
- Empedocle asserisce che ogni cosa è composta da una miscela di quattro sostanze primordiali: terra, aria, fuoco e acqua. Due ulteriori principi, amore e odio, agiscono sulle sostanze primordiali combinandole e separandole in infinite combinazioni.[4]
- circa 440 a.C.
- Leucippo e Democrito propongono l'idea di atomo, particella indivisibile che costituisce tutta la materia. Questa idea viene sostanzialmente respinta dai filosofi naturali a favore della visione aristotelica (vedi oltre).[5][6]
- circa 360 a.C.
- Platone conia il termine elementi (stoicheia). Il suo dialogo Timeo è un trattato rudimentale di chimica che include una discussione sulla composizione di corpi organici e inorganici, e assume che le particelle costituenti gli elementi abbiano una particolare forma geometrica: tetraedro (fuoco), ottaedro (aria), icosaedro (acqua) e cubo (terra).[7]
- circa 350 a.C.
- Aristotele, ampliando concetti di Empedocle, propone l'idea che le sostanze siano costituite da una combinazione di forma e materia. Descrive una teoria comprendente cinque elementi: fuoco, acqua, terra, aria ed etere. Questa teoria sarà ampiamente accettata in tutto il mondo occidentale per più di 2000 anni.[8]
- circa 50 a.C.
- Lucrezio pubblica il De rerum natura, una descrizione poetica delle idee dell'atomismo.[9]
- circa 200
- Ermete Trismegisto, personaggio leggendario dell'età ellenistica, fonda l'arte dell'alchimia.[10]
- circa 300
- Zosimo di Panopoli scrive uno dei primi libri noti di alchimia, che definisce come studio della composizione delle acque, movimento, crescita, incarnazione e disincarnazione, traendo gli spiriti dai corpi e legando gli spiriti all'interno dei corpi.[11]
- circa 770
- Jabir ibn Hayyan, latinizzato in Geber, alchimista arabo/persiano considerato da molti il padre della chimica,[12][13][14] sviluppa vari processi chimici sperimentali e isola numerosi acidi, tra i quali acido cloridrico, acido citrico, acido acetico, acido tartarico e acqua regia.
- circa 1000
- Al-Biruni[15] e Avicenna,[16] due chimici persiani, respingono le pratiche alchemiche e la teoria della trasmutazione dei metalli.
- circa 1167
- Magister Salernus della Scuola Medica Salernitana menziona per la prima volta la distillazione del vino.[17]
- circa 1220
- Roberto Grossatesta pubblica vari commenti alle opere di Aristotele, dove delinea un primo schema del metodo scientifico.[18]
- circa 1250
- Taddeo Alderotti sviluppa la distillazione frazionata, un metodo molto più efficiente dei metodi precedenti.[19]
- circa 1260
- Alberto Magno scopre l'arsenico[20] e il nitrato d'argento.[21] È anche uno dei primi a citare l'acido solforico.[22]
- circa 1267
- Ruggero Bacone nell'Opus Maius delinea un abbozzo del metodo scientifico e riporta i risultati dei suoi esperimenti con la polvere da sparo.[23]
- circa 1310
- Pseudo-Geber, un anonimo alchimista europeo che scriveva usando il nome di Geber, pubblica vari volumi dando origine alla teoria a lungo ritenuta valida, secondo la quale tutti metalli sono composti da zolfo e mercurio in varie proporzioni. È anche uno dei primi a descrivere acido nitrico e acqua regia.[24]

- circa 1530
- Paracelso sviluppa lo studio della iatrochimica, disciplina basata sulla cura delle malattie attraverso l'uso di sostanze minerali, ponendo le basi della moderna industria farmaceutica. Sembra sia stato il primo ad usare la parola "chimica".[11]
- 1597
- Andreas Libavius scrive "Alchemia", il primo trattato sistematico di chimica.[25]
XVII secolo[modifica | modifica wikitesto]
Nel XVII secolo si assiste al passaggio dall'alchimia alla chimica, grazie all'introduzione del metodo scientifico e allo sviluppo della termodinamica.
- 1605
- Francesco Bacone pubblica Sull'avanzamento e sul progresso del sapere umano e divino, che contiene una descrizione di quello che diventerà in seguito il metodo scientifico.[26]
- 1605
- Michael Sendivogius, alchimista polacco, pubblica il trattato Novum Lumen Chymicum in cui propone che nell'aria esista un "cibo vitale", molto più tardi riconosciuto come ossigeno.[27]
- 1615
- Jean Béguin pubblica Tyrocinium Chymicum, uno dei primi testi moderni di chimica, dove sono riportate le prime equazioni chimiche.[28]
- 1637
- Cartesio pubblica il Discorso sul metodo, che contiene uno schema del metodo scientifico.[29]
- 1648
- Viene pubblicato postumo il testo Ortus medicinae di Jean Baptiste van Helmont. L'opera è considerata importante nel processo di transizione tra alchimia e chimica, ed ebbe una notevole influenza su Robert Boyle. Il testo contiene i risultati di molti esperimenti e definisce una prima versione della legge della conservazione della massa.[30]

- 1661
- Robert Boyle pubblica The Sceptical Chymist (Il chimico scettico), un trattato sulla differenza tra chimica e alchimia. Contiene le prime idee moderne di atomo, molecola e reazione chimica, e segna storicamente l'inizio della chimica moderna.[31]
- 1662
- Robert Boyle formula la legge di Boyle, una descrizione del comportamento dei gas ottenuta sperimentalmente, che mette in relazione tra loro pressione e volume.[32]
- 1669
- Hennig Brand, alchimista di Amburgo, isola il fosforo dal residuo ottenuto distillando una gran quantità di urina.[33]
XVIII secolo[modifica | modifica wikitesto]
Nel XVIII secolo continuano gli sviluppi della termodinamica e vengono isolate molte sostanze importanti, tra cui l'idrogeno e l'ossigeno. Sul finire del secolo si assiste inoltre alla nascita di una nuova branca della chimica: l'elettrochimica.
- 1730
- Il chimico svedese George Brandt analizza un pigmento blu scuro trovato in un minerale di rame, e dimostra che tale pigmento contiene un nuovo elemento, che chiama cobalto.[34]
- 1754
- Joseph Black isola il diossido di carbonio, chiamandolo "aria fissa".[35]

- 1757
- Mentre sta studiando composti di arsenico, Louis Claude Cadet de Gassicourt ottiene il "liquido fumante di Cadet", che si scoprirà poi contenere ossido di cacodile, considerato il primo composto organometallico sintetico.[36]
- 1760
- Joseph Black formula il concetto di calore latente per spiegare la termochimica dei processi di transizione di fase.[30]
- 1766
- Henry Cavendish scopre l'idrogeno, un gas incolore e inodore che brucia e può formare una miscela esplosiva con l'aria.[37]
- 1773-1774
- Carl Scheele[38] e Joseph Priestley[39] lavorando indipendentemente isolano l'ossigeno, che Scheele chiama "aria di fuoco" e Priestley chiama "aria deflogistizzata".

- 1778
- Antoine-Laurent de Lavoisier, considerato il fondatore della chimica moderna,[40] dà il nome all'ossigeno e ne riconosce l'importanza e il ruolo nei processi di combustione.[30]
- 1787
- Antoine-Laurent de Lavoisier insieme ad altri pubblica Méthode de nomenclature chimique (Metodo di nomenclatura chimica), che contiene il primo sistema moderno di nomenclatura chimica.[41]
- 1787
- Jacques Charles propone la legge di Charles, un corollario della legge di Boyle, mettendo in relazione la temperatura e il volume di un gas.[42]
- 1789
- Antoine-Laurent de Lavoisier pubblica Traité Élémentaire de Chimie (Trattato di chimica elementare), considerato il primo moderno libro di testo di chimica. Si tratta di una panoramica completa delle chimica moderna (nota a quel tempo), e comprende la prima definizione sintetica della legge della conservazione della massa, e quindi segna anche la nascita della disciplina della stechiometria e della chimica analitica quantitativa.[43]
- 1797
- Joseph Proust propone la legge delle proporzioni definite, che afferma che gli elementi reagiscono per formare composti combinandosi sempre secondo proporzioni in massa definite e costanti.[44]

- 1800
- Alessandro Volta inventa la pila voltaica fondando così la disciplina dell'elettrochimica.[45]
XIX secolo[modifica | modifica wikitesto]

Nel XIX secolo vengono svolti importantissimi progressi nell'ambito della termodinamica, della chimica e delle sue branche, tra cui in particolare: la chimica organica, la biochimica e l'elettrochimica. Tali conoscenze vengono utilizzate in maniera proficua favorendo lo sviluppo della chimica industriale: la chimica in questo modo allarga il proprio ambito d'azione, passando dal laboratorio all'industria e nasce di conseguenza l'ingegneria chimica.
- 1801
- John Dalton formula la legge di Dalton (o legge delle pressioni parziali), che descrive le relazioni tra i componenti di una miscela di gas e i contributi delle pressioni parziali di ciascun componente alla miscela totale.[46]
- 1805
- Joseph Louis Gay-Lussac e il suo collaboratore Alexander von Humboldt scoprono che l'acqua è costituita da due volumi di idrogeno e un volume di ossigeno.[47]
- 1808
- Joseph Louis Gay-Lussac formula la legge dei volumi di combinazione, che afferma che quando due sostanze gassose reagiscono mantenendo temperatura e pressione costante, i volumi dei gas reagenti stanno tra loro secondo rapporti espressi da numeri interi e piccoli.[47]
- 1808
- John Dalton pubblica New System of Chemical Philosophy, che contiene una prima descrizione moderna della teoria atomica e una chiara enunciazione della legge delle proporzioni multiple.[46]
- 1808
- Jöns Jacob Berzelius pubblica Lärbok i Kemien, dove propone simboli chimici moderni, ed espone il concetto di peso atomico relativo.[48]
- 1811
- Amedeo Avogadro propone la legge di Avogadro, che afferma che volumi uguali di gas diversi, alla stessa temperatura e pressione, contengono lo stesso numero di molecole.[49]
- 1817
- Pierre Joseph Pelletier e Joseph Caventou isolano la clorofilla.[50] Pionieri nell'utilizzo di solventi per estrarre i principi attivi delle piante, isoleranno molti altri alcaloidi, tra cui stricnina, chinino e caffeina.[51]
- 1825
- Friedrich Wöhler e Justus von Liebig studiano il fulminato d'argento e il cianato d'argento, sostanze con la stessa composizione ma con proprietà diverse, già chiamate isomeri da Berzelius. Deducono che l'isomeria è dovuta ad un diverso arrangiamento degli atomi nella struttura molecolare.[52]
- 1827
- William Prout classifica le biomolecole raggruppandole in carboidrati, proteine e lipidi.[53]
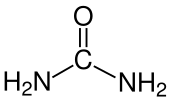
- 1828
- Friedrich Wöhler sintetizza l'urea, dimostrando che si possono produrre composti organici da materiali di partenza inorganici, e sfata così la teoria del vitalismo.[52]
- 1832
- Friedrich Wöhler e Justus von Liebig scoprono e spiegano il ruolo dei gruppi funzionali in chimica organica.[52]
- 1834
- Michael Faraday pubblica le leggi di Faraday sull'elettrolisi, che stabiliscono le relazioni tra la quantità di sostanza prodotta e la quantità di carica trasferita durante l'elettrolisi.[54]
- 1840
- Germain Hess formula la legge di Hess, un primo enunciato della legge di conservazione dell'energia, che stabilisce che la variazione di energia in un processo chimico è indipendente dal percorso utilizzato per passare dallo stato iniziale a quello finale.[55]
- 1847
- Hermann Kolbe ottiene acido acetico da sostanze totalmente inorganiche, smentendo ulteriormente il vitalismo.[56]
- 1847
- Ascanio Sobrero sintetizza la nitroglicerina e ne osserva le proprietà esplosive e vasodilatatrici.[57]
- 1848
- Lord Kelvin enuncia il concetto di zero assoluto, temperatura alla quale cessa ogni moto molecolare.[58]
- 1849
- Louis Pasteur scopre che l'acido tartarico di sintesi è una miscela racemica delle forme levogira e destrogira, chiarendo il principio della attività ottica. Separa per la prima volta i due enantiomeri contribuendo all'avanzamento della stereochimica.[59]

- 1852
- August Beer enuncia la legge di Lambert-Beer, che spiega la relazione tra la composizione di una miscela e la quantità di luce che viene assorbita. Questa legge, basata in parte su studi precedenti di Pierre Bouguer e Johann Heinrich Lambert, fonda la tecnica analitica della spettrofotometria.[60]
- 1852
- Edward Frankland introduce il concetto di valenza, considerando che ogni atomo possa combinarsi solo con un certo numero limitato di atomi differenti.[61] È anche il primo ad utilizzare il termine "legame".[62]
- 1855
- Benjamin Silliman, Jr. è un pioniere dei metodi di cracking del petrolio, rendendo possibile l'attuale industria petrolchimica.[63]
- 1856
- William Henry Perkin sintetizza il primo colorante artificiale, la porpora di anilina. Il composto fu ottenuto casualmente tentando di produrre chinino da catrame di carbone. Con questa scoperta nasce l'industria dei coloranti sintetici, uno dei primi campi industriali chimici di successo.[64]
- 1857
- August Kekulé propone che il carbonio sia tetravalente e formi quattro legami chimici.[65]

- 1859-1860
- Robert Bunsen e Gustav Kirchhoff pongono le basi per fondare la spettroscopia come metodo analitico. Ciò li porta a scoprire cesio e rubidio. Poco dopo altri ricercatori usano la stessa tecnica e scoprono indio, tallio ed elio.[66]
- 1860
- Stanislao Cannizzaro riprende le idee di Avogadro sulle molecole diatomiche, compila una tabella di pesi atomici e nel 1860 la presenta al Congresso di Karlsruhe. Terminano così diatribe durate decenni su pesi atomici e formule molecolari, e si apre la strada alla scoperta della tavola periodica da parte di Mendeleev.[67]
- 1861
- Ernest Solvay brevetta un metodo per produrre carbonato di sodio da materiali facilmente disponibili ed economici: calcare e salamoia. Il primo stabilimento Solvay sorge nel 1863, rendendo disponibile a basso costo questo materiale che è fondamentale per svariati processi industriali.[68]
- 1862
- Alla Mostra Internazionale di Londra Alexander Parkes esibisce la parkesina, il primo polimero termoplastico. Questa scoperta dà inizio alla moderna industria delle materie plastiche.[69]

- 1862
- Alexandre-Émile Béguyer de Chancourtois pubblica la sua vis tellurique (ellisse tellurica), una prima versione tridimensionale della tavola periodica degli elementi.[70]
- 1864
- John Newlands propone senza successo la legge delle ottave, un arrangiamento degli elementi in base al peso atomico che precorre la tavola periodica degli elementi.[71]
- 1864
- Julius Lothar Meyer sviluppa una prima versione della tavola periodica, con 28 elementi organizzati in base alla valenza.[72]
- 1864
- Cato Maximilian Guldberg e Peter Waage, elaborando idee di Claude Louis Berthollet formulano la legge di azione di massa.[73]
- 1865
- Johann Josef Loschmidt determina il numero di molecole contenute in una mole, che sarà poi chiamato numero di Avogadro[74], e ancora successivamente, costante di Avogadro.
- 1865
- August Kekulé, basandosi in parte sul lavoro di Loschmidt e altri, propone che il benzene abbia una struttura ciclica con legami singoli e doppi alternati.[65]
- 1865
- Adolf von Baeyer inizia a lavorare sul colorante indaco, una pietra miliare della moderna chimica organica industriale che rivoluzionerà l'industria dei coloranti.[75]
- 1867
- Alfred Nobel brevetta la dinamite, un esplosivo manipolabile senza rischi a base di nitroglicerina, che rivoluziona il mondo delle costruzioni. Divenuto ricchissimo, con un lascito testamentario istituirà i Premi Nobel.[76]

- 1869
- Dmitrij Ivanovič Mendeleev pubblica la prima tavola periodica degli elementi moderna, organizzando i 66 elementi noti secondo il peso atomico. Questa tavola ha la capacità di predire in modo accurato le proprietà di elementi ancora sconosciuti.[72]
- 1873
- Jacobus Henricus van 't Hoff e Joseph Achille Le Bel, lavorando indipendentemente sviluppano un modello di legame chimico che razionalizza gli esperimenti di Pasteur sulla chiralità e interpreta in modo fisico l'attività ottica dei composti chirali.[77]
- 1876
- Willard Gibbs pubblica On the Equilibrium of Heterogeneous Substances (Sull'equilibrio delle sostanze eterogenee), un'opera di 300 pagine che riassume le sue ricerche di termodinamica, fonda la chimica fisica e introduce il concetto di energia libera per spiegare le basi dell'equilibrio chimico.[78]
- 1877
- Ludwig Boltzmann deriva in modo statistico molti concetti fisici e chimici importanti, tra cui l'entropia e la distribuzione delle velocità delle molecole in fase gassose.[79]
- 1883
- Svante Arrhenius sviluppa la teoria ionica per spiegare la conducibilità degli elettroliti.[80]
- 1884
- Jacobus Henricus van 't Hoff pubblica Études de Dynamique chimique (Studi di dinamica chimica) un importante contributo alla cinetica chimica dove descrive metodi grafici per determinare l'ordine di reazione.[81]

- 1884
- Hermann Emil Fischer propone la struttura della purina, chiave di molte molecole biologiche, che sintetizzerà poi nel 1898. Inizia inoltre a lavorare alla chimica del glucosio e di altri zuccheri correlati.[82]
- 1884
- Henri Le Châtelier sviluppa il principio di Le Châtelier, che spiega come un sistema chimico all'equilibrio risponde a uno stimolo esterno.[83]
- 1886
- Eugen Goldstein dà il nome ai raggi catodici (che poi si capirà sono elettroni) e ai raggi canale o raggi anodici (che poi si capirà sono ioni idrogeno positivi che hanno perso il loro elettrone nel tubo a raggi catodici, e saranno chiamati protoni).[84]

- 1893
- Alfred Werner scopre la struttura ottaedrica dei complessi di cobalto, dando inizio alla chimica di coordinazione.[85]
- 1894-1898
- William Ramsay scopre i gas nobili, che vanno ad occupare uno spazio inatteso nella tavola periodica e faranno progredire i modelli di legame chimico.[86]
- 1897
- Joseph John Thomson usando il tubo a raggi catodici scopre l'elettrone.[87]
- 1897
- Felix Hoffmann sintetizza l'acido acetilsalicilico in una forma stabile per applicazioni medicinali. Venduto dalla Bayer con il nome commerciale aspirina, sarà uno dei farmaci più utili della storia.[88]
- 1898
- Wilhelm Wien scopre che i raggi canale sono deflessi dai campi magnetici, e che l'entità della deflessione è proporzionale al rapporto massa/carica. Questa scoperta farà nascere la tecnica analitica della spettrometria di massa.[89]

- 1898
- Marie Curie e Pierre Curie isolano radio e polonio dal minerale pechblenda.[90]
- circa 1900
- Ernest Rutherford scopre che la radioattività è una disintegrazione di atomi, e conia i termini per i vari tipi di radiazione.[91]
- 1900
- Victor Grignard scopre gli alogenuri di alchilmagnesio (reattivi di Grignard), che contribuiranno fortemente allo sviluppo della chimica organica.[92]
XX secolo[modifica | modifica wikitesto]
Nel XX secolo i concetti della chimica trovano spiegazioni più accurate grazie all'utilizzo della meccanica quantistica, da cui nascono ad esempio nuovi modelli atomici e raffinate teorie sull'interazione tra atomi. Dal connubio tra la chimica e la meccanica quantistica nasce la chimica quantistica.
- 1903
- Michail Semënovič Cvet inventa la cromatografia, un'importante tecnica analitica.[93]
- 1904
- Hantarō Nagaoka propone un modello atomico dove gli elettroni orbitano attorno ad un nucleo carico positivamente.[94]

- 1905
- Fritz Haber e Carl Bosch sviluppano il processo Haber-Bosch per produrre ammoniaca da idrogeno e azoto, una pietra miliare dell'industria chimica che avrà profonde conseguenze sull'agricoltura.[95]
- 1905
- Albert Einstein spiega il moto browniano e prova definitivamente l'esattezza della teoria atomica.[96]
- 1907
- Leo Baekeland inventa la bachelite, prima resina sintetica, che diventa un successo commerciale.[97]

- 1909
- Robert Millikan misura la carica di singoli elettroni con una precisione senza precedenti attraverso l'esperimento della goccia di olio, confermando che tutti gli elettroni hanno la stessa carica e la stessa massa.[98]
- 1909
- Søren Sørensen inventa il concetto di pH e sviluppa metodi per misurare l'acidità.[99]
- 1911
- Antonius van den Broek propone l'idea che gli elementi siano disposti nella tavola periodica seguendo la carica nucleare positiva anziché secondo il peso atomico.[100]
- 1911
- A Bruxelles si tiene il primo Congresso Solvay, che riunisce la maggior parte degli scienziati più famosi del momento. Congressi Solvay di fisica e di chimica continuano tuttora a tenersi regolarmente.[101]
- 1911
- Ernest Rutherford, Hans Wilhelm Geiger e Ernest Marsden eseguono il famoso esperimento del foglio d'oro, che dimostra la validità del modello nucleare dell'atomo, dove un piccolo nucleo molto denso e carico positivamente è circondato da una nuvola elettronica diffusa.[91]
- 1912
- William Henry Bragg e William Lawrence Bragg formulano la legge di Bragg e fondano la cristallografia a raggi X, uno strumento che permette di osservare la struttura dei materiali cristallini.[102]
- 1912
- Peter Debye sviluppa il concetto di dipolo molecolare per descrivere la distribuzione di carica asimmetrica presente in alcune molecole.[103]

- 1913
- Niels Bohr usa la meccanica quantistica per descrivere la struttura atomica e propone il modello atomico di Bohr, dove gli elettroni possono trovarsi solo su orbite ben definite.[104]
- 1913
- Henry Moseley lavora sulla precedente idea di Antonius van den Broek e introduce il concetto di numero atomico per ovviare alle discrepanze della tavola periodica di Mendeleev che era basata sui pesi atomici.[105]
- 1913
- Frederick Soddy introduce il concetto di isotopi, elementi che hanno le stesse proprietà chimiche ma diversi pesi molecolari.[106]
- 1913
- Joseph John Thomson approfondisce il lavoro di Wilhelm Wien e mostra che atomi e gruppi di atomi si possono separare in base al rapporto massa/carica, una tecnica ora nota come spettrometria di massa.[107]
- 1916
- Gilbert Lewis pubblica The Atom and the Molecule (L'atomo e la molecola) dove formula la teoria del legame di valenza.[108]
- 1922
- Otto Stern e Walther Gerlach eseguono l'esperimento di Stern-Gerlach e dimostrano che le particelle subatomiche hanno proprietà quantistiche intrinseche, e che lo spin è quantizzato.[109]
- 1923
- Gilbert Lewis e Merle Randall pubblicano Thermodynamics and the Free Energy of Chemical Substances (Termodinamica ed Energia Libera delle Sostanze Chimiche), il primo trattato moderno di termodinamica chimica.[110]
- 1923
- Gilbert Lewis enuncia una nuova teoria per acidi e basi, definendoli in base alla capacità di scambiarsi una coppia di elettroni.[110]
- 1923
- Nello stesso anno, Johannes Nicolaus Brønsted e Thomas Martin Lowry sviluppano indipendentemente la teoria acido-base di Brønsted-Lowry, che definisce acidi e basi in relazione alla possibilità di scambiare uno ione H+.[111]
- 1924
- Louis de Broglie introduce il modello ondulatorio della struttura atomica, basato sull'idea del dualismo onda-particella.[112]
- 1925
- Wolfgang Pauli sviluppa il principio di esclusione di Pauli, che afferma che due elettroni attorno ad un nucleo atomico non possono occupare simultaneamente lo stesso stato quantico, descritto da quattro numeri quantici.[113]
- 1926
- Erwin Schrödinger propone l'equazione di Schrödinger, che fornisce una base matematica al modello ondulatorio della struttura atomica.[114]
- 1927
- Werner Heisenberg enuncia il principio d'indeterminazione, stabilendo che la misura simultanea di due variabili coniugate, come posizione e quantità di moto oppure energia e tempo, non può essere compiuta senza un'incertezza ineliminabile.[115]
- 1927
- Fritz London e Walter Heitler applicano la meccanica quantistica all'interpretazione del legame nella molecola di idrogeno,[116] segnando l'inizio della chimica quantistica.[117][118]
- 1929
- Linus Pauling pubblica le regole di Pauling,[119] utili per determinare la struttura di cristalli ionici complessi.[120]
- 1931
- Erich Hückel enuncia la regola di Hückel, che consente di prevedere se una molecola con un anello ciclico possiede proprietà aromatiche oppure no.[121]
- 1931
- Harold Urey scopre il deuterio tramite distillazione frazionata dell'idrogeno liquido.[122]
- 1932
- James Chadwick scopre il neutrone.[123]
- 1932-1934
- Linus Pauling e Robert Mulliken definiscono numericamente l'elettronegatività, inventando le scale che ora portano il loro nome.[124]

- 1935
- Wallace Carothers, a capo di un gruppo di ricerca alla DuPont, inventa il nylon, uno dei polimeri sintetici di maggior successo commerciale.[125]
- 1937
- Carlo Perrier ed Emilio Segrè scoprono il tecnezio, primo elemento prodotto artificialmente, riempiendo un posto rimasto vuoto nella tavola periodica. Il tecnezio potrebbe essere stato sintetizzato per la prima volta da Walter Noddack e altri, ma i risultati dell'esperimento non furono confermati.[126]
- 1937
- Eugene Houdry inventa un metodo per effettuare il cracking del petrolio su scala industriale, portando allo nascita della prima raffineria moderna.[127]
- 1937
- Pyotr Kapitsa, John F. Allen e Don Misener producono l'elio-4 superraffreddato, il primo superfluido a viscosità zero, una sostanza che mostra proprietà quantomeccaniche su scala macroscopica.[128]
- 1938
- Otto Hahn scopre il processo di fissione nucleare in uranio e torio.[129]
- 1939
- Linus Pauling pubblica The Nature of the Chemical Bond (La Natura del Legame Chimico), uno dei più importanti testi moderni di chimica sul legame chimico, dove spiega ibridazione degli orbitali, legame covalente, e legame ionico utilizzando l'elettronegatività, e usa il concetto di risonanza per spiegare, tra le altre cose, la struttura del benzene.[120]
- 1940
- Edwin McMillan e Philip Hauge Abelson identificano il nettunio tra i prodotti di fissione dell'uranio. Il nettunio è il primo e più leggero elemento transuranico ad essere sintetizzato. McMillan lavorò al Lawrence Berkeley National Laboratory dove sarebbero stati scoperti molti nuovi elementi ed isotopi.[130]
- 1941
- Glenn Theodore Seaborg continua il lavoro di Edwin McMillan nel creare nuovi nuclidi. Seaborg è un pioniere dei metodi di cattura neutronica e di altre reazioni nucleari, e sarà lo scopritore, anche con suoi collaboratori, di dieci nuovi elementi chimici e innumerevoli isotopi di elementi conosciuti.[130]
- 1945
- Jacob A. Marinsky, Lawrence E. Glendenin e Charles D. Coryell effettuano la prima sintesi pienamente confermata del promezio, riempiendo l'ultima casella rimasta vuota nella tavola periodica.[131]
- 1945-1946
- Felix Bloch e Edward Mills Purcell sviluppano la risonanza magnetica nucleare, una tecnica analitica importante per la determinazione della struttura delle molecole, specie in chimica organica.[132]
- 1949
- Ronald Norrish e George Porter inventano la flash fotolisi, una tecnica che permette di studiare le reazioni di specie a vita breve come i radicali. Con l'avvento dei laser sarà possibile studiare reazioni che avvengono nel campo dei femtosecondi.[133][134]
- 1949
- Willard Frank Libby pubblica un metodo di datazione radiometrica basato sul carbonio-14, che permette di misurare l'età di qualsiasi materiale di origine organica, aprendo nuove prospettive agli studi archeologici.[135]
- 1951
- Linus Pauling usa la cristallografia a raggi X per dedurre la struttura secondaria delle proteine.[120]
- 1952
- Alan Walsh compie studi pionieristici di spettroscopia di assorbimento atomico, un importante metodo spettroscopico che permette di misurare la concentrazione di uno specifico ione metallico all'interno di una miscela.[136]

- 1952
- Robert Burns Woodward, Geoffrey Wilkinson e Ernst Otto Fischer chiariscono la struttura del ferrocene, una delle scoperte più importanti nel campo della chimica metallorganica.[137]
- 1953
- James Dewey Watson e Francis Crick propongono la struttura del DNA, aprendo la strada alla nascita della biologia molecolare.[138]
- 1953
- Stanley Miller e Harold Urey dimostrano con un famoso esperimento che nell'atmosfera primordiale della Terra si possono essere formati spontaneamente composti organici come gli amminoacidi a partire da sostanze inorganiche semplici come idrogeno, metano, ammoniaca e acqua.[139]
- 1953
- Giulio Natta estende le ricerche di Karl Ziegler e sviluppa i catalizzatori di Ziegler-Natta permettendo di ottenere polimeri isotattici o sindiotattici che saranno prodotti industriali diffusissimi (Moplen).[140]
- 1957
- Jens Christian Skou scopre la pompa sodio-potassio, il primo enzima noto che trasporta ioni attraverso la membrana plasmatica delle cellule.[141]
- 1958
- Max Perutz e John Kendrew usano la cristallografia a raggi X per chiarire la struttura di una proteina, la mioglobina del capodoglio.[142]

- 1960
- Theodore Harold Maiman realizza il primo laser, una sorgente di radiazioni che sfrutta l'emissione stimolata per ottenere un fascio collimato di radiazione coerente e monocromatica.[143]
- 1962
- Neil Bartlett sintetizza l'esafluoroplatinato di xeno, dimostrando per la prima volta che i gas nobili possono formare composti chimici.[144]
- 1962
- George Andrew Olah usa superacidi per osservare le reazioni dei carbocationi.[145]

- 1962
- Osamu Shimomura isola la green fluorescent protein (GFP), espressa dalla medusa Aequorea victoria.[146] Sfruttando la sua fluorescenza, studi successivi di Martin Chalfie e Roger Tsien la renderanno un diffussimo strumento per esperimenti e tecniche di biologia molecolare.[147]
- 1963
- Panayotis Katsoyannis[148] e Helmut Zahn,[149] lavorando indipendentemente, sono i primi a sintetizzare una proteina: l'insulina.
- 1964
- Richard R. Ernst compie studi che permetteranno di sviluppare la tecnica di risonanza magnetica nucleare a trasformata di Fourier. L'aumento di sensibilità così ottenuto renderà possibile l'imaging a risonanza magnetica (MRI).[150]
- 1965
- Robert Burns Woodward e Roald Hoffmann enunciano le regole di Woodward-Hoffmann, che usano le proprietà di simmetria degli orbitali molecolari per spiegare la stereochimica delle reazioni chimiche.[151]

- 1965
- Stephanie Louise Kwolek lavorando alla DuPont inventa il kevlar, una fibra sintetica molto resistente e leggera (a parità di peso è 5 volte più resistente dell'acciaio), che troverà svariate applicazioni.[152]
- 1966
- Hitosi Nozaki e Ryōji Noyori scoprono il primo esempio di sintesi asimmetrica ottenuta tramite un complesso chirale dei metalli di transizione con struttura ben definita.[153]

- 1967
- Charles J. Pedersen sintetizza i primi eteri corona, molecole cicliche che formano complessi stabili con ioni metallici alcalini e alcalino-terrosi.[154] Queste ricerche saranno sviluppate da Donald J. Cram e Jean-Marie Lehn, dando origine ad una nuova branca della chimica, la chimica supramolecolare.[155]
- 1970
- John Pople sviluppa il programma GAUSSIAN che renderà molto più semplici i calcoli di chimica computazionale.[156]
- 1971
- Yves Chauvin propone un meccanismo che interpreta le reazioni di metatesi olefinica.[157]
- 1974
- Mario Molina e Frank Sherwood Rowland scoprono che i clorofluorocarburi danneggiano lo strato di ozono presente nella stratosfera.[158]
- 1980
- Barry Sharpless e il suo gruppo di ricerca scoprono varie reazioni stereoselettive di ossidazione. Tra queste, l'epossidazione di Sharpless[159] e la diidrossilazione asimmetrica di Sharpless.[160]

- 1982
- Tra il 1982 e il 1985, Johann Deisenhofer, Robert Huber and Hartmut Michel usano la diffrattometria a raggi X per determinare l'esatta disposizione degli oltre 10.000 atomi che formano il centro di reazione fotosintetico in alcuni batteri, favorendo la comprensione del meccanismo della fotosintesi.[161]
- 1983
- Kary Mullis perfeziona la reazione a catena della polimerasi (PCR), riuscendo ad ottenere grandi quantità di DNA a partire da piccolissime quantità iniziali. La PCR diventerà una tecnica indispensabile nei laboratori medici e biologici per svariate applicazioni.[162]
- 1985
- Alec Jeffreys scopre il metodo per riconoscere l'impronta genetica del DNA di uno specifico individuo, rivoluzionando le tecniche di identificazione di medicina forense.[163]
- 1985
- Akira Yoshino mette a punto il primo prototipo di accumulatore agli ioni di litio. Batterie ricaricabili di questo tipo saranno commercializzate nel 1991 e usate in seguito in tutti i dispositivi elettronici e i veicoli elettrici.[164]

- 1985
- Harold Kroto, Robert Curl e Richard Smalley scoprono i fullereni, allotropi di carbonio che hanno una struttura simile alla cupola geodetica progettata dall'architetto Richard Buckminster Fuller.[165]
- 1986
- Georg Bednorz e Karl Alexander Müller scoprono il primo materiale superconduttore ad alta temperatura, l'ossido di lantanio bario e rame (LBCO).[166]
- 1988
- Ahmed Zewail mette a punto lo spettroscopio al femtosecondo, riuscendo a osservare nella scala dei femtosecondi come si muovono gli atomi nello stato di transizione di una reazione. Nasce la branca della femtochimica.[167]
- 1991
- Sumio Iijima usa il microscopio elettronico per scoprire un altro tipo di fullereni, i nanotubi di carbonio;[168] in realtà i primi studi di L. V. Radushkevich e V. M. Lukyanovich sull'argomento erano già apparsi nel 1952, ma erano rimasti sconosciuti perché apparsi in Unione Sovietica durante la guerra fredda.[169]
- 1993
- Andrew S. Bell, David Brown e Nicholas K. Terrett brevettano un nuovo farmaco, il pirazolpirimidinone, originalmente pensato per curare l'angina pectoris. Diventerà noto in tutto il mondo con il nome di Viagra.[170]

- 1994
- Robert A. Holton e il suo gruppo effettuano la prima sintesi totale del taxolo, usato nella chemioterapia del cancro.[171][172]
- 1995
- Eric Allin Cornell e Carl Wieman sintetizzano il primo condensato di Bose-Einstein, una sostanza che mostra proprietà quantomeccaniche su una scala macroscopica.[173]

- 1998
- Omar Yaghi e collaboratori progettano e sintetizzano i primi materiali con pori di dimensione elevata ed esattamente controllata, combinado ossidi metallici e leganti organici. Nasce una nuova categoria di composti che verranno poi classificati come metal organic frameworks (MOFs).[174]
- 1998
- Paul Anastas e John Charles Warner pubblicano i 12 principi della chimica verde che suggeriscono come progettare prodotti e processi chimici riducendo o eliminando l'impiego di sostanze pericolose.[175][176]
XXI secolo[modifica | modifica wikitesto]
- 2001
- Craig Venter della Celera Genomics e Francis Collins del National Human Genome Research Institute annunciano di aver sequenziato il genoma umano.[177]
- 2001
- Barry Sharpless e il suo gruppo di ricerca introducono il concetto di click chemistry, una tecnica che permetterà di sintetizzare sostanze complesse in modo semplice e rapido, unendo molecole più piccole.[178]
- 2004
- Andrej Gejm e Konstantin Novosëlov scoprono un'altra forma di carbonio, il grafene, un materiale molto resistente e buon conduttore di calore ed elettricità, nonostante sia costituito da uno strato monoatomico di atomi di carbonio.[179]
- 2012
- Emmanuelle Charpentier e Jennifer Doudna propongono il metodo CRISPR-Cas9 per l'editing genomico, rivoluzionando le tecniche biotecnologiche e consentendo di modificare il genoma in vivo con estrema precisione e semplicità.[180]

- 2016
- La IUPAC riconosce ufficialmente la scoperta degli elementi 113, 115, 117 e 118, ai quali viene assegnato rispettivamente il nome nihonio (Nh), moscovio (Mc), tennesso (Ts) e oganesson (Og). Si completa così il settimo periodo della tavola periodica degli elementi.[181]
Note[modifica | modifica wikitesto]
- ^ Brown e LeMay 1977
- ^ Griffiths 1955
- ^ Kass-Simon et al. 1993, p. 301.
- ^ Parry 2012
- ^ Berryman 2004A
- ^ Berryman 2004B
- ^ Zeyl 2013
- ^ Gayhart.
- ^ Sedleyl 2013
- ^ Hoeller 1996
- ^ a b Strathern 2000
- ^ Derewenda 2008
- ^ Warren 2005
- ^ Zahoor 1997
- ^ Marmura 1965
- ^ Briffault 1919, pp. 196-197.
- ^ Forbes 1970, p. 88.
- ^ Urquhart 1913
- ^ Holmyard 1990, p. 53.
- ^ Emsley 2001, pp. 43,513,529.
- ^ Davidson 2003
- ^ Karpenko e Norris 2001
- ^ Crombie e North 2008
- ^ Norris 2006
- ^ Forshaw 2008
- ^ Klein 2012
- ^ Soukup 2006
- ^ Crosland 1959
- ^ Piat 1913
- ^ a b c Brown 1920
- ^ Davidson 2001
- ^ MacIntosh 2010
- ^ Enciclopedia Italiana
- ^ Emsley 2001, p. 140.
- ^ Mieli 1939
- ^ Seyferth 2001
- ^ Cavendish 1766
- ^ Quartaroli 1936
- ^ Di Meo
- ^ Quartaroli 1933
- ^ de Morveau et al. 1787
- ^ Gay-Lussac 1802
- ^ Weisstein 2007
- ^ Quartaroli 1935
- ^ Potamian 1913
- ^ a b Quartaroli 1931
- ^ a b Encyclopædia Britannica 1911
- ^ Chemical Heritage Foundation 2010
- ^ Enciclopedia Italiana 1930
- ^ Pelletier e Caventou 1817
- ^ Enciclopedia Italiana
- ^ a b c Chemical Heritage Foundation 2010
- ^ Rosenfeld 2003
- ^ Ehl e Ihde 1954
- ^ Leicester 1951
- ^ European Association for Chemical and Molecular Sciences 2005
- ^ Quartaroli 1936
- ^ Weisstein 2007
- ^ Chemical Heritage Foundation 2010
- ^ Sigrist-Photometer AG
- ^ Encyclopædia Britannica 1911
- ^ Weisberg et al. 2011
- ^ Wright 1911
- ^ Chemical Heritage Foundation 2010
- ^ a b Chemical Heritage Foundation 2010
- ^ Chemical Heritage Foundation 2010
- ^ Chemical Heritage Foundation 2010
- ^ Martin e van Tiggelen 2011
- ^ Plastics Historical Society 2011
- ^ Chemical Heritage Foundation 2010
- ^ The Third Millennium Online
- ^ a b Chemical Heritage Foundation 2010
- ^ Waage e Gulberg 1986
- ^ Enciclopedia Italiana
- ^ Nobel Media AB 2013
- ^ Chemical Heritage Foundation 2010
- ^ Chemical Heritage Foundation 2010
- ^ Giorgi 1933
- ^ Eric W. Weisstein 2007
- ^ Chemical Heritage Foundation 2010
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Desch 1938
- ^ Enciclopedia Italiana
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Chemical Heritage Foundation 2010
- ^ Chemical Heritage Foundation 2010
- ^ Nobel Media AB 2013
- ^ Chemical Heritage Foundation 2010
- ^ a b Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Encyclopædia Britannica 2014
- ^ Hentschel 2009
- ^ Chemical Heritage Foundation 2010
- ^ Cassidy 1995
- ^ Chemical Heritage Foundation 2010
- ^ Nobel Media AB 2013
- ^ Chemical Heritage Foundation 2010
- ^ van der Broek 1913
- ^ Solvay Institutes 2011
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Weisstein 2007
- ^ Nobel Media AB 2013
- ^ Rayleigh 1941
- ^ Chemical Heritage Foundation 2010
- ^ Franklin 2012
- ^ a b Hildebrand 1947
- ^ Pope 1938
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Heitler e London 1927
- ^ Grattan-Guinness 2003, p. 1266.
- ^ Mehra e Rechenberg 2000, p. 540.
- ^ Pauling 1929
- ^ a b c Nobel Media AB 2013
- ^ Suchy 1980
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Jensen 2003
- ^ Chemical Heritage Foundation 2010
- ^ Emsley 2001, p. 526.
- ^ Chemical Heritage Foundation 2010
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ a b Chemical Heritage Foundation 2010
- ^ Emsley 2001, p. 428.
- ^ Nobel Media AB 2013
- ^ Nobel Media AB 2013
- ^ Fleming e Phillips 2004
- ^ Arnold e Libby 1949
- ^ Hannaford 2000
- ^ Wilkinson et al. 1952
- ^ Nobel Media AB 2013
- ^ Miller 1953
- ^ Nobel Media AB 2013
- ^ Skou 1957
- ^ Nobel Media AB 2013
- ^ D'Haenens 2007
- ^ Sampson 2006
- ^ Olah et al. 1963
- ^ Shimomura 2009
- ^ Tsien 1998
- ^ Katsoyannis et al. 1963
- ^ Meienhofer et al. 1963
- ^ Nobel Media AB 2013
- ^ Woodward e Hoffmann 1965
- ^ Chemical Heritage Foundation 2010
- ^ Nobel Media AB 2013
- ^ Pedersen 1967
- ^ Nobel Media AB 2013
- ^ Hehre et al. 1970
- ^ Hérisson e Chauvin 1971
- ^ Molina e Rowland 1974
- ^ Katsuki e Sharpless 1980
- ^ Jacobsen et al. 1988
- ^ Deisenhofer et al. 1985
- ^ Bartlett e Stirling 2003
- ^ Jeffreys 1985
- ^ Yoshino 2012
- ^ Nobel Media AB 2013
- ^ Bednorz e Müller 1986
- ^ Zewail 1988
- ^ Iijima 1991
- ^ Radushkevich e Lukyanovich 1952
- ^ Bell et al. 1993
- ^ Holton et al. 1994
- ^ Holton et al. 1994
- ^ Nobel Media AB 2013
- ^ Yaghi et al. 1998
- ^ Anastas e Warner 1998
- ^ United States Environmental Protection Agency 2014
- ^ Venter 2001
- ^ Kolb et al. 2001
- ^ Novoselov et al. 2004
- ^ Jinek et al. 2012
- ^ Öhrström e Reedijk 2016
Bibliografia[modifica | modifica wikitesto]
- (EN) Paul T. Anastas e John Charles Warner, Green Chemistry: Theory and Practice, New York, Oxford University Press, 1998, ISBN 978-0-19-850698-0.
- J. R. Arnold e W. F. Libby, Age Determinations by Radiocarbon Content: Checks with Samples of Known Age, in Science, vol. 110, n. 2869, 1949, pp. 678-680, DOI:10.1126/science.110.2869.678.
- Isaac Asimov, Breve storia della chimica. Introduzione alle idee della chimica, Zanichelli, 1968, ISBN 978-88-08-04064-0.
- John M. S. Bartlett e David Stirling, A Short History of the Polymerase Chain Reaction, in Methods in Molecular Biology, vol. 226, 2003, pp. 3-6, DOI:10.1385/1-59259-384-4:3.
- J. G. Bednorz e K. A. Müller, Possible high Tc superconductivity in the Ba−La−Cu−O system, in Zeitschrift für Physik B Condensed Matter, vol. 64, n. 2, 1986, pp. 189-193, DOI:10.1007/BF01303701.
- (EN) Robert Briffault, The Making of Humanity, Londra, Allen & Untwin, 1938.
- (EN) James Campbell Brown, A History of Chemistry from the Earliest Times, Londra, Churchill, 1920.
- (EN) Theodore L. Brown e H. Eugene LeMay, Chemistry: The Central Science, Prentice Hall, 1977, ISBN 0-13-128769-9.
- (EN) David Cassidy,, Einstein on Brownian Motion, in Einstein and Our World, Humanities Press, 1995. URL consultato il 6 maggio 2014 (archiviato dall'url originale il 6 febbraio 2007).
- Henry Cavendish, Three Papers Containing Experiments on Factitious Air, by the Hon. Henry Cavendish, in Philosophical Transactions, vol. 56, 1766, pp. 141–184, DOI:10.1098/rstl.1766.0019.
- M.P. Crosland, The use of diagrams as chemical 'equations' in the lectures of William Cullen and Joseph Black, in Annals of Science, vol. 15, n. 2, 1959, pp. 75–90, DOI:10.1080/00033795900200088.
- (EN) J. Deisenhofer, O. Epp, K. Miki, R. Huber e H. Michel, Structure of the protein subunits in the photosynthetic reaction centre of Rhodopseudomonas viridis at 3Å resolution, in Nature, vol. 318, n. 6047, 1985, pp. 618-624, DOI:10.1038/318618a0.
- (FR) de Morveau, Lavoisier, Bertholet, & de Fourcroy, Méthode de nomenclature chimique, Parigi, Cuchet, 1787.
- Zygmunt S. Derewenda, On wine, chirality and crystallography, in Acta Crystallographica Section A, A64, 2008, pp. 246–258, DOI:10.1107/S0108767307054293.
- C. H. Desch, Henry Louis Le Chatelier. 1850-1936, in Obituary Notices of Fellows of the Royal Society, vol. 2, n. 6, 1938, pp. 250–259, DOI:10.1098/rsbm.1938.0005.
- Irnee J. D'Haenens, Theodore Harold Maiman, in Physics Today, vol. 60, n. 10, 2007, pp. 72-73, DOI:10.1063/1.2800106.
- Rosemary Gene Ehl e Aaron J. Ihde, Faraday's electrochemical laws and the determination of equivalent weights, in J. Chem. Educ., vol. 31, n. 5, 1954, pp. 226-232, DOI:10.1021/ed031p226.
- (EN) John Emsley, Nature's Building Blocks: An A-Z Guide to the Elements, Oxford, Oxford University Press, 2001, ISBN 0-19-850341-5.
- Graham R. Fleming e David Phillips, GEORGE PORTER KT OM, LORD PORTER OF LUDDENHAM 6 December 1920 — 31 August 2002 (PDF), in Biogr. Mems Fell. R. Soc., vol. 50, 2004, pp. 257-283, DOI:10.1098/rsbm.2004.0017. URL consultato il 21 maggio 2014.
- (EN) Robert James Forbes, A Short History of the Art of Distillation, Brill, 1970, ISBN 978-90-04-00617-1.
- Peter J. Forshaw, “Paradoxes, Absurdities, and Madness”: Conflict over Alchemy, Magic and Medicine in the Works of Andreas Libavius and Heinrich Khunrath, in Early Science and Medicine, vol. 13, 2008, pp. 53-81, DOI:10.1163/157338207X242465. URL consultato il 29 aprile 2014.
- Joseph-Louis Gay-Lussac, On the expansion of gases and vapors, read at the National Institute on 11 pluviôse, year 10, by citizen Gay-Lussac, in Annales de Chimie, vol. 43, 1802, pp. 137.
- (EN) Ivor Grattan-Guinness (a cura di), Companion Encyclopedia of the History and Philosophy of the Mathematical Sciences, Johns Hopkins University Press, 2003, ISBN 978-0-8018-7396-6.
- J. Gwyn Griffiths, The Orders of Gods in Greece and Egypt (According to Herodotus), in The Journal of Hellenic Studies, vol. 75, 1955, pp. 21–23, DOI:10.2307/629164.
- W. J. Hehre, W. A. Lathan, R. Ditchfield, M. D. Newton e J. A. Pople, Gaussian 70, in Quantum Chemistry Program Exchange, Program No. 237, 1970.
- Walter Heitler e Fritz London, Wechselwirkung neutraler Atome und homöopolare Bindung nach der Quantenmechanik, in Zeitschrift für Physik, vol. 44, n. 6-7, 1927, pp. 455–472, DOI:10.1007/BF01397394.
- (EN) Klaus Hentschel, Atomic Models, Nagaoka's Saturnian Model, in Daniel Greenberger, Klaus Hentschel, Friedel Weinert (a cura di), Compendium of Quantum Physics, Springer, 2009, DOI:10.1007/978-3-540-70626-7_10, ISBN 978-3-540-70622-9.
- Jean-Louis Hérisson e Yves Chauvin, Catalyse de transformation des oléfines par les complexes du tungstène. II. Télomérisation des oléfines cycliques en présence d'oléfines acycliques, in Makromolekulare Chemie, vol. 141, n. 1, 1971, pp. 161-176, DOI:10.1002/macp.1971.021410112.
- Joel H. Hildebrand, Gilbert Newton Lewis. 1875-1946 [collegamento interrotto], in Obituary Notices of Fellows of the Royal Society, vol. 5, n. 15, 1947, pp. 491-506, DOI:10.1098/rsbm.1947.0014.
- Stephan A. Hoeller, On the Trail of the Winged God: Hermes and Hermeticism Throughout the Ages, in Gnosis: A Journal of Western Inner Traditions, vol. 40, 1996. URL consultato il 27 aprile 2014 (archiviato dall'url originale il 26 novembre 2009).
- (EN) Eric John Holmyard, Alchemy, Dover Publications, 1990, ISBN 978-0-486-26298-7.
- Robert A. Holton, Carmen Somoza, Hyeong Baik Kim, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith e Soekchan Kim, First total synthesis of taxol. 1. Functionalization of the B ring, in J. Am. Chem. Soc., vol. 116, n. 4, 1994, pp. 1597–1598, DOI:10.1021/ja00083a066.
- Robert A. Holton, Hyeong Baik Kim, Carmen Somoza, Feng Liang, Ronald J. Biediger, P. Douglas Boatman, Mitsuru Shindo, Chase C. Smith e Soekchan Kim, First total synthesis of taxol. 2. Completion of the C and D rings, in J. Am. Chem. Soc., vol. 116, n. 4, 1994, pp. 1599–1600, DOI:10.1021/ja00083a067.
- Sumio Iijima, Helical microtubules of graphitic carbon, in Nature, vol. 354, n. 6348, 1991, pp. 56-58, DOI:10.1038/354056a0.
- Eric N. Jacobsen, Istvan. Marko, William S. Mungall, Georg. Schroeder e K. Barry Sharpless, Asymmetric dihydroxylation via ligand-accelerated catalysis, in J. Am. Chem. Soc., vol. 110, n. 6, 1988, pp. 1968–1970, DOI:10.1021/ja00214a053.
- A. J. Jeffreys, V. Wilson e S. L. Thein, Hypervariable 'minisatellite' regions in human DNA, in Nature, vol. 314, n. 6006, 1985, pp. 67-73, DOI:10.1038/314067a0.
- William B. Jensen, Electronegativity from Avogadro to Pauling: II. Late Nineteenth- and Early Twentieth-Century Developments, in Journal of Chemical Education, vol. 80, n. 3, 2003, pp. 279, DOI:10.1021/ed080p279.
- (EN) M. Jinek, K. Chylinski, I. Fonfara, M. Hauer, J. Doudna e E. Charpentier, A Programmable Dual-RNA–Guided DNA Endonuclease in Adaptive Bacterial Immunity, in Science, vol. 337, n. 6096, 2012, pp. 816–821, DOI:10.1126/science.1225829.
- Vladimir Karpenko e John A. Norris, Vitriol in the History of Chemistry (PDF), in Chem. Listy, vol. 96, 2001, pp. 997-1005. URL consultato il 27 aprile 2014.
- (EN) Gabriele Kass-Simon, Patricia Farnes, Deborah Nash (a cura di), Women of Science: Righting the Record, Bloomington, Indiana Univ. Press, 1993, ISBN 978-0-253-20813-2.
- Panayotis G. Katsoyannis, Andrew Tometsko e Kouhei Fukuda, Insulin Peptides. IX. The Synthesis of the A-Chain of Insulin and its Combination with Natural B-Chain to Generate Insulin Activity, in J. Am. Chem. Soc., vol. 85, n. 18, 1963, pp. 2863–2865, DOI:10.1021/ja00901a052.
- Tsutomu Katsuki e K. Barry Sharpless, The first practical method for asymmetric epoxidation, in J. Am. Chem. Soc., vol. 102, n. 18, 1980, pp. 5974–5976, DOI:10.1021/ja00538a077.
- H. C. Kolb, M. G. Finn, K. B. Sharpless, <2004::AID-ANIE2004>3.0.CO;2-5 Click Chemistry: Diverse Chemical Function from a Few Good Reactions, in Angew. Chem. Int. Ed., vol. 40, n. 11, 2001, pp. 2004-2021, DOI:10.1002/1521-3773(20010601)40:11<2004::AID-ANIE2004>3.0.CO;2-5.
- Henry M. Leicester, Germain Henri Hess and the foundations of thermochemistry, in J. Chem. Educ., vol. 28, n. 11, 1951, pp. 581, DOI:10.1021/ed028p581.
- Michael E. Marmura, An Introduction to Islamic Cosmological Doctrines. Conceptions of Nature and Methods Used for Its Study by the Ikhwan Al-Safa'an, Al-Biruni, and Ibn Sina by Seyyed Hossein Nasr, in Speculum, vol. 40, n. 4, 1965, pp. 744–746, DOI:10.2307/2851429.
- (EN) Jagdish Mehra e Helmut Rechenberg, The Historical Development of Quantum Theory, vol. 6, Springer, 2000.
- J. Meienhofer, E. Schnabel, H. Bremer, O. Brinkhoff, R. Zabel, W. Sroka, H. Klostermeyer, D. Brandenburg, T. Okuda e H. Zahn, Synthese der Insulinketten und ihre Kombination zu insulinaktiven Präparate, in Z. Naturforsch., 18B, n. 12, 1963, pp. 1120-1121.
- Stanley L. Miller, A Production of Amino Acids Under Possible Primitive Earth Conditions, in Science, vol. 117, n. 3046, 1953, pp. 528-529, DOI:10.1126/science.117.3046.528. URL consultato il 18 maggio 2014.
- Mario Molina e F. S. Rowland, Stratospheric sink for chlorofluoromethanes: chlorine atom-catalysed destruction of ozone, in Nature, vol. 249, 1974, pp. 810-812, DOI:10.1038/249810a0.
- J. A. Norris, The Mineral Exhalation Theory of Metallogenesis in Pre-Modern Mineral Science, in Ambix, vol. 53, n. 1, 2006, pp. 43-56, DOI:10.1179/174582306X93183.
- K. S. Novoselov, A. K. Geim, S. V. Morozov, D. Jiang, Y. Zhang, S. V. Dubonos, I. V. Grigorieva e A. A. Firsov, Electric Field Effect in Atomically Thin Carbon Films, in Science, vol. 306, n. 5696, 2004, pp. 666-669, DOI:10.1126/science.1102896.
- (EN) L. Öhrström e J. Reedijk, Names and symbols of the elements with atomic numbers 113, 115, 117 and 118 (IUPAC Recommendations 2016), in Pure and Applied Chemistry, vol. 88, n. 12, 2016, pp. 1225-1229, DOI:10.1515/pac-2016-0501.
- George A. Olah, William S. Tolgyesi, Stephen J. Kuhn, Maryanne E. Moffatt, Ivan J. Bastien, Edward B. Baker, Stable Carbonium Ions. IV. Secondary and Tertiary Alkyl and Aralkyl Oxocarbonium Hexafluoroantimonates. Formation and Identification of the Trimethylcarbonium Ion by Decarbonylation of the tert-Butyl Oxocarbonium Ion, in J. Am. Chem. Soc., vol. 85, n. 9, 1963, pp. 1328–1334, DOI:10.1021/ja00892a025.
- Linus Pauling, The principles determining the structure of complex ionic crystals, in J. Am. Chem. Soc., vol. 51, n. 4, 1929, pp. 1010–1026, DOI:10.1021/ja01379a006.
- Charles J. Pedersen, Cyclic polyethers and their complexes with metal salts, in J. Am. Chem. Soc., vol. 89, n. 10, 1967, pp. 2495–2496, DOI:10.1021/ja00986a052.
- Pelletier e Caventou, Sur la matière verte des feuilles, in J. of Pharmacie, vol. 3, 1817, pp. 486-491. URL consultato il 16 maggio 2014.
- W. J. Pope, Thomas Martin Lowry. 1874-1936 [collegamento interrotto], in Obit. Not. Fell. R. Soc., vol. 2, n. 6, 1938, pp. 287-293, DOI:10.1098/rsbm.1938.0009. URL consultato il 18 maggio 2014.
- Л. В. Радушкевич, О Структуре Углерода, Образующегося При Термическом Разложении Окиси Углерода На Железном Контакте (PDF), in Журнал Физической Химии, vol. 26, 1952, pp. 88–95. URL consultato il 17 maggio 2014 (archiviato dall'url originale il 5 marzo 2016).
- Rayleigh, Joseph John Thomson [collegamento interrotto], in Obituary Notices of Fellows of the Royal Society, vol. 3, n. 10, 1941, pp. 586-609, DOI:10.1098/rsbm.1941.0024.
- Louis Rosenfeld, William Prout: Early 19th Century Physician-Chemist, in Clinical Chemistry, vol. 49, n. 4, 2003, pp. 699-705, DOI:10.1373/49.4.699. URL consultato il 2 maggio 2014 (archiviato dall'url originale il 17 ottobre 2015).
- Dietmar Seyferth, Cadet's Fuming Arsenical Liquid and the Cacodyl Compounds of Bunsen, in Organometallics, vol. 20, n. 8, 2001, pp. 1488-1498, DOI:10.1021/om0101947.
- (EN) O. Shimomura, Discovery of green fluorescent protein (GFP)(Nobel Lecture), in Angew. Chem. Int. Ed., vol. 48, 2009, pp. 5590-5602, DOI:10.1002/anie.200902240.
- Jens Chr. Skou, The influence of some cations on an adenosine triphosphatase from peripheral nerves, in Biochimica et Biophysica Acta, vol. 23, n. 2, 1957, pp. 394-401, DOI:10.1016/0006-3002(57)90343-8.
- (EN) Paul Strathern, Mendeleyev's Dream – The Quest for the Elements, Berkley Books, 2000, ISBN 0-425-18467-6.
- K. Suchy, Obituary: Erich Hückel, in Physics Today, vol. 33, n. 5, 1980, pp. 72-75, DOI:10.1063/1.2914092.
- (EN) R. Y. Tsien, The Green Fluorescent Protein, in Annual Review of Biochemistry, vol. 67, 1998, pp. 509-544, DOI:10.1146/annurev.biochem.67.1.509.
- A. van der Broek, Intra-atomic charge, in Nature, vol. 92, n. 2300, 1913, pp. 372, DOI:10.1038/092372c0.
- J. Craig Venter e altri, The Sequence of the Human Genome, in Science, vol. 291, n. 5507, 2001, pp. 1304-1351, DOI:10.1126/science.1058040.
- P. Waage e C. M. Gulberg, Studies concerning affinity, in J. Chem. Educ., vol. 63, n. 12, 1986, pp. 1044-1047, DOI:10.1021/ed063p1044. (Traduzione in inglese dell'articolo originale in norvegese.)
- John Warren, War and the Cultural Heritage of Iraq: a sadly mismanaged affair, in Third World Quarterly, vol. 26, n. 4-5, 2005, pp. 815-830.
- Geoffrey Wilkinson, M. Rosenblum , M. C. Whiting, R. B. Woodward, The structure of iron bis-cyclopentadienyl, in J. Am. Chem. Soc., vol. 74, n. 8, 1952, pp. 2125–2126, DOI:10.1021/ja01128a527.
- R. B. Woodward, Roald Hoffmann, Stereochemistry of Electrocyclic Reactions, in J. Am. Chem. Soc., vol. 87, n. 2, 1965, pp. 395–397, DOI:10.1021/ja01080a054.
- Arthur W. Wright, Benjamin Silliman (PDF), in Bibliographical Memoirs of the National Academy of Sciences, vol. 7, 1911, pp. 116-141. URL consultato il 5 maggio 2014.
- (EN) O. M. Yaghi, H. Li, C. Davis, D. Richardson e T. L. Groy, Synthetic Strategies, Structure Patterns, and Emerging Properties in the Chemistry of Modular Porous Solids, in Acc. Chem. Res., vol. 31, n. 8, 1998, pp. 474–484, DOI:10.1021/ar970151f.
- (EN) A. Yoshino, The Birth of the Lithium-Ion Battery, in Angew. Chem. Int. Ed., vol. 51, 2012, pp. 5798 – 5800, DOI:10.1002/anie.201105006.
- (EN) A. H. Zewail, Laser Femtochemistry, in Science, vol. 242, n. 4886, 1988, pp. 1645–1653, DOI:10.1126/science.242.4886.1645.
Voci correlate[modifica | modifica wikitesto]
- Premio Nobel per la chimica
- Scoperta degli elementi chimici
- Storia della chimica
- Vincitori del premio Nobel per la chimica
Collegamenti esterni[modifica | modifica wikitesto]
- Andrew S. Bell, David Brown e Nicholas K. Terrett, Pyrazolopyrimidinone antianginal agents, su Brevetto US5250534 A, 1993. URL consultato il 20 maggio 2014.
- Sylvia Berryman, Leucippus, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2004A. URL consultato il 27 aprile 2014.
- Sylvia Berryman, Democritus, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2004B. URL consultato il 27 aprile 2014.
- Chemical Heritage Foundation, Svante August Arrhenius, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Leo Hendrik Baekeland, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Jöns Jakob Berzelius, su chemheritage.org, 2010. URL consultato il 1º maggio 2014.
- Chemical Heritage Foundation, Robert Bunsen and Gustav Kirchhoff, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Stanislao Cannizzaro, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Wallace Hume Carothers, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Marie Sklodowska Curie, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, An Element of Order, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Fritz Haber, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Felix Hoffmann, su chemheritage.org, 2010. URL consultato il 16 maggio 2014.
- Chemical Heritage Foundation, Eugene Houdry, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, August Kekulé and Archibald Scott Couper, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Stephanie Kwolek: Curiosity and the Discovery of Kevlar, su chemheritage.org, 2010. URL consultato il 18 maggio 2014 (archiviato dall'url originale il 4 novembre 2014).
- Chemical Heritage Foundation, Gilbert Newton Lewis, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Justus von Liebig and Friedrich Wöhler, su chemheritage.org, 2010. URL consultato il 1º maggio 2014.
- Chemical Heritage Foundation, Julius Lothar Meyer and Dmitri Ivanovich Mendeleev, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Alfred Nobel, su chemheritage.org, 2010. URL consultato il 16 maggio 2014 (archiviato dall'url originale l'8 ottobre 2014).
- Chemical Heritage Foundation, Louis Pasteur, su chemheritage.org, 2010. URL consultato il 1º maggio 2014.
- Chemical Heritage Foundation, William Henry Perkin, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Glenn Theodore Seaborg, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Søren Sørensen, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Joseph John Thomson, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Chemical Heritage Foundation, Jacobus Henricus van’t Hoff, su chemheritage.org, 2010. URL consultato il 5 maggio 2014.
- Christy Martin e Brigitte van Tiggelen, Making the Process, su chemheritage.org, Chemical Heritage Foundation, 2011. URL consultato il 16 maggio 2014 (archiviato dall'url originale il 18 maggio 2014).
- A. C. Crombie e J. D. North, Bacon, Roger, su Complete Dictionary of Scientific Biography, 2008. URL consultato il 29 aprile 2014.
- John S. Davidson, Annotations to Boyle’s “The Sceptical Chymist” (PDF), su chem.gla.ac.uk, 2001. URL consultato il 29 aprile 2014.
- Michael W. Davidson, Albertus Magnus, su Molecular Expressions: Science, Optics and You, The Florida State University, 2003. URL consultato il 29 aprile 2014.
- Antonio Di Meo, Priestley, Joseph, su Enciclopedie on line, Treccani. URL consultato il 29 aprile 2014.
- Enciclopedia Italiana, AVOGADRO, Amedeo, su treccani.it, Treccani, 1930. URL consultato il 1º maggio 2014.
- Enciclopedia Italiana, Brand, Hennig, su treccani.it, Treccani. URL consultato il 17 maggio 2014.
- Enciclopedia Italiana, Goldstein ‹ġòltštain›, Eugen, su treccani.it, Treccani. URL consultato il 5 maggio 2014.
- Enciclopedia Italiana, Loschmidt ‹lóšmit›, Joseph, su treccani.it, Treccani. URL consultato il 5 maggio 2014.
- Enciclopedia Italiana, Pelletier, Pierre-Joseph, su treccani.it, Treccani. URL consultato il 17 maggio 2014.
- Encyclopædia Britannica, Frankland, Sir Edward, su en.wikisource.org, 1911. URL consultato il 17 maggio 2014.
- Encyclopædia Britannica, Gay-Lussac, Joseph Louis, su en.wikisource.org, 1911. URL consultato il 1º maggio 2014.
- Encyclopædia Britannica, Tsvet, Mikhail [collegamento interrotto], su Compton's Desk Reference, 2014. URL consultato il 5 maggio 2014.
- EPA, Basics of Green Chemistry, su www2.epa.gov, United States Environmental Protection Agency, 2014. URL consultato il 18 maggio 2014 (archiviato dall'url originale il 22 maggio 2014).
- European Association for Chemical and Molecular Sciences, Kolbe, Adolph Wilhelm Hermann (1818-1884), su 100 Distinguished European Chemists, 2005. URL consultato il 1º maggio 2014 (archiviato dall'url originale l'11 ottobre 2008).
- Allan Franklin, Appendix 5: Right Experiment, Wrong Theory: The Stern-Gerlach Experimen, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2012. URL consultato il 7 maggio 2014.
- Robert B. Gayhart, History/chronology of the elements, su History of Chemistry. URL consultato il 27 aprile 2014.
- Giovanni Giorgi, GIBBS, Josiah Willard, su Enciclopedia Italiana (1933), Treccani, 1933. URL consultato il 5 maggio 2014.
- Peter Hannaford, Alan Walsh 1916-1998, su Biographical Memoirs, Australian Academy of Science, 2000. URL consultato il 16 maggio 2014 (archiviato dall'url originale il 17 maggio 2014).
- Jürgen Klein, Francis Bacon, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2012. URL consultato il 27 aprile 2014.
- J. J. MacIntosh, Robert Boyle, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2010. URL consultato il 27 aprile 2014.
- Aldo Mieli, BLACK, Joseph, su Enciclopedia Italiana, Treccani, 1930. URL consultato il 29 aprile 2014.
- Nobel Media AB, Adolf von Baeyer - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Niels Bohr - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, The Nobel Prize in Physics 1915, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Louis de Broglie - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, James Chadwick - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, The Nobel Prize in Chemistry 1962, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, The Nobel Prize in Chemistry 1987, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, The Nobel Prize in Chemistry 1996, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, Peter Debye - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Richard R. Ernst - Biographical, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, Emil Fischer - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Victor Grignard - Biographical, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, Otto Hahn - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Werner Heisenberg - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Pyotr Kapitsa - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, The Nobel Prize in Physiology or Medicine 1962, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, Nobel Prize in Physics 1923 - Presentation Speech, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Giulio Natta - Biographical, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, Ryoji Noyori - Biographical, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, Wolfgang Pauli - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Linus Pauling - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, The Nobel Prize in Physics 1952, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, Information for the Public, su nobelprize.org, 2013. URL consultato il 16 maggio 2014.
- Nobel Media AB, George Porter - Biographical, su nobelprize.org, 2013. URL consultato il 21 maggio 2014.
- Nobel Media AB, Sir William Ramsay - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Ernest Rutherford - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Erwin Schrödinger - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Frederick Soddy - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Harold C. Urey - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Jacobus H. van 't Hoff - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Alfred Werner - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Nobel Media AB, Wilhelm Wien - Biographical, su nobelprize.org, 2013. URL consultato il 5 maggio 2014.
- Richard Parry, Empedocles, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2012. URL consultato il 27 aprile 2014.
- Clodius Piat, Catholic Encyclopedia (1913)/René Descartes, su en.wikisource.org, 1913. URL consultato il 27 aprile 2014.
- Plastics Historical Society, What are Plastics?, su plastiquarian.com, 2011. URL consultato il 5 maggio 2014.
- Brother Potamian, Catholic Encyclopedia (1913)/René Descartes, su en.wikisource.org, 1913. URL consultato il 27 aprile 2014.
- Alfredo Quartaroli, DALTON, John, su Enciclopedia Italiana (1931), Treccani, 1931. URL consultato il 29 aprile 2014.
- Alfredo Quartaroli, LAVOISIER, Antoine-Laurent, su Enciclopedia Italiana (1933), Treccani, 1933. URL consultato il 29 aprile 2014.
- Alfredo Quartaroli, Proust, Joseph-Louis, su Enciclopedia Italiana (1935), Treccani, 1935. URL consultato il 29 aprile 2014.
- Alfredo Quartaroli, Scheele, su Enciclopedia Italiana (1936), Treccani, 1936. URL consultato il 29 aprile 2014.
- Alfredo Quartaroli, Sobrero, su Enciclopedia Italiana (1936), Treccani, 1936. URL consultato il 16 maggio 2014.
- Mark T. Sampson, Neil Bartlett and the Reactive Noble Gases, su National Historic Chemical Landmarks, American Chemical Society, 2006. URL consultato il 16 maggio 2014.
- David Sedleyl, Lucretius, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2013. URL consultato il 27 aprile 2014.
- Sigrist-Photometer AG, Lambert-Beer Law, su ABC of Process Photometry. URL consultato il 5 maggio 2014.
- Solvay Institutes, About Us: History, su solvayinstitutes.be, 2011. URL consultato il 5 maggio 2014 (archiviato dall'url originale il 29 marzo 2014).
- Rudolf Werner Soukup, Michael Sendivogius: An alchemist and Austrian-Polish double agent of the beginning 17th century (PDF), su Proceedings of the 2nd ICESHS, 2006. URL consultato il 29 aprile 2014 (archiviato dall'url originale il 2 maggio 2014).
- The Third Millennium Online, The Periodic Table, su 3rd1000.com. URL consultato il 5 maggio 2014.
- Francis Fortescue Urquhart, Catholic Encyclopedia (1913)/Robert Grosseteste, su en.wikisource.org, 2013. URL consultato il 27 aprile 2014.
- Michael Weisberg, Paul Needham e Robin Hendry, hilosophy of Chemistry, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2011. URL consultato il 17 maggio 2014.
- Eric W. Weisstein, Boltzmann, Ludwig (1844-1906), su Eric Weisstein's World of Scientific Biography, Wolfram Research Products, 2007. URL consultato il 5 maggio 2014.
- Eric W. Weisstein, Lavoisier, Antoine (1743-1794), su Eric Weisstein's World of Scientific Biography, Wolfram Research Products, 2007. URL consultato il 1º maggio 2014.
- Eric W. Weisstein, Kelvin, Lord William Thomson (1824-1907), su Eric Weisstein's World of Scientific Biography, Wolfram Research Products, 2007. URL consultato il 1º maggio 2014.
- Eric W. Weisstein, Moseley, Henry (1887-1915), su Eric Weisstein's World of Scientific Biography, Wolfram Research Products, 2007. URL consultato il 6 maggio 2014.
- A. Zahoor, JABIR IBN HAIYAN (Geber), su unhas.ac.id, 1997. URL consultato il 27 aprile 2014 (archiviato dall'url originale il 30 giugno 2008).
- Donald Zeyl, Plato's Timaeus, su Stanford Encyclopedia of Philosophy, Metaphysics Research Lab, CSLI, Stanford University, 2013. URL consultato il 27 aprile 2014.
