Stadio cineticamente determinante
In cinetica chimica, lo stadio cineticamente determinante (o stadio cineticamente limitante o stadio cineticamente controllante o, in inglese, rate determining step)[1] corrisponde allo stadio del meccanismo di una reazione chimica che avviene più lentamente rispetto agli altri stadi, e determina la velocità della reazione stessa.[2][3]
Analogia tra le reazioni multistadio e le catene di montaggio[modifica | modifica wikitesto]
Le reazioni chimiche che coinvolgono più reazioni elementari possono essere paragonate a delle catene di montaggio (ad esempio una catena di montaggio per la realizzazione di un'automobile). Ogni reazione elementare, in cui è suddivisa la reazione globale, è analoga ad una singola fase della catena di montaggio.
Analogamente, lo stadio cineticamente determinante può essere paragonato alla fase più lenta della catena di montaggio. La velocità con cui viene realizzato il prodotto in una catena di montaggio dipende dalla velocità della fase più lenta, la quale rallenta l'intera produzione. Allo stesso modo, la velocità della reazione globale dipende dalla velocità dello stadio cineticamente determinante.
Individuazione dello stadio cineticamente determinante[modifica | modifica wikitesto]
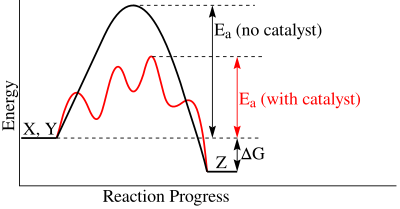
In un diagramma "coordinata di reazione-energia", lo stadio cineticamente determinante corrisponde allo stadio caratterizzato dalla maggiore energia di attivazione (il secondo per la reazione catalizzata in figura).
Alcuni esempi di stadio cineticamente determinante sono:
- reazione chimica elementare;
- adsorbimento dei reagenti sul sito di reazione;
- desorbimento dei prodotti dal sito di reazione;
- trasporto di materia dei reagenti dal bulk al sito di reazione;
- trasporto di materia dei prodotti dal bulk al sito di reazione.
Il concetto di "stadio cineticamente determinante" si utilizza anche in biochimica e in elettrochimica.
Controllo di una reazione chimica[modifica | modifica wikitesto]
Si dice che una reazione chimica è sotto controllo termodinamico se le concentrazioni dei prodotti di una reazione corrispondono a quelle che si avrebbero in condizioni di equilibrio, mentre si dice che la reazione è sotto controllo cinetico se si hanno più reazioni competitive con velocità di reazione differenti per cui la concentrazione dei prodotti dipende dalla cinetica di tali reazioni.[4]
Nel caso in cui si abbia controllo cinetico, la velocità di reazione dipende dallo stadio cineticamente determinante,[1] per cui si dice che lo stadio cineticamente determinante "controlla" la reazione chimica in questione.
Quando un processo è controllato cineticamente da più stadi (per cui non c'è un singolo stadio cineticamente determinante), si dice che tale processo è sotto controllo misto.
Esempio[modifica | modifica wikitesto]
Si consideri la seguente reazione chimica:
Il meccanismo di tale reazione coinvolge le seguenti reazioni elementari:
- (stadio più lento)
- (stadio più veloce)
In questo caso lo stadio cineticamente determinante è il primo, in quanto avviene più lentamente.
Controllo di un processo elettrochimico[modifica | modifica wikitesto]
I processi elettrochimici coinvolgono reazioni redox che avvengono all'interfaccia elettrodo-elettrolita; gli stadi coinvolti in un processo elettrochimico sono:[5][6]
- "trasferimento di massa" di alcuni reagenti dal bulk dell'elettrolita all'interfaccia elettrodo-elettrolita;[7]
- adsorbimento sulla superficie dell'elettrodo di alcuni reagenti;
- reazione redox; tale stadio è anche detto "trasferimento di carica", in quanto durante la reazione redox si ha uno scambio di elettroni tra due specie chimiche;
- desorbimento dalla superficie dell'elettrodo di alcuni prodotti;
- "trasferimento di massa" di alcuni prodotti dall'interfaccia elettrodo-elettrolita al bulk dell'elettrolita;
- cristallizzazione di alcuni prodotti sulla superficie dell'elettrodo;
- svolgimento di reazioni chimiche secondarie prima o dopo la reazione redox;
- trasferimento di massa di alcuni reagenti e prodotti all'interno del bulk dell'elettrolita.
A ciascuno di questi stadi è associata una sovratensione, cioè una variazione del potenziale di cella rispetto alle condizioni di equilibrio. In particolare si ha:
- sovratensione per trasferimento di carica (associata alla reazione redox);
- caduta ohmica (associata al trasporto di materia nel bulk dell'elettrolita);
- sovratensione di cristallizzazione;
- sovratensione per reazione chimica.
Allo stadio cineticamente determinante è associata la sovratensione più elevata.
Note[modifica | modifica wikitesto]
- ^ a b IUPAC Gold Book - rate-controlling step
- ^ Introducing Chemical Kinetics - Rate Equations Archiviato il 14 agosto 2011 in Internet Archive.
- ^ Copia archiviata, su science-dictionary.com. URL consultato il 31 maggio 2011 (archiviato dall'url originale il 12 agosto 2011).
- ^ Copia archiviata (PDF), su unibas.it. URL consultato il 31 maggio 2011 (archiviato dall'url originale il 30 maggio 2009).
- ^ Kiehne, p. 11.
- ^ Zanello, pp. 12-13.
- ^ Per una rappresentazione dettagliata della struttura dell'interfaccia elettrodo-elettrolita, vedi la voce Doppio strato elettrico.
Bibliografia[modifica | modifica wikitesto]
- (EN) Heinz Albert Kiehne, Battery Technology Handbook, 2ª ed., CRC Press, 2003, ISBN 0-8247-5642-8.
- (EN) Piero Zanello, Inorganic electrochemistry: theory, practice and applications, Royal Society of Chemistry, 2003, ISBN 0-85404-661-5.


