SARS-CoV-2
| SARS-CoV-2 | |
|---|---|
 | |
| Classificazione scientifica | |
| Dominio | Riboviria |
| Regno | Orthornavirae |
| Phylum | Pisuviricota |
| Classe | Pisoniviricetes |
| Ordine | Nidovirales |
| Sottordine | Cornidovirineae |
| Famiglia | Coronaviridae |
| Sottofamiglia | Orthocoronavirinae |
| Genere | Betacoronavirus |
| Sottogenere | Sarbecovirus |
| Specie | Coronavirus correlato alla SARS |
| Sinonimi | |
|
Coronavirus 2 da sindrome respiratoria acuta grave | |
| Nomi comuni | |
|
2019-nCoV | |
Il coronavirus 2 da sindrome respiratoria acuta grave, abbreviato in SARS-CoV-2 (acronimo dall'inglese Severe Acute Respiratory Syndrome COronaVirus 2),[1][2] in precedenza nominato nuovo coronavirus del 2019 (2019-nCoV[3]), è un ceppo virale della specie coronavirus correlato alla SARS facente parte del genere Betacoronavirus (famiglia Coronaviridae), sottogenere Sarbecovirus, scoperto intorno alla fine del 2019; si tratta del settimo coronavirus riconosciuto in grado di infettare esseri umani.[2]
Il nome ufficiale dato dall'Organizzazione mondiale della sanità alla sindrome causata dal virus è COVID-19 (abbreviazione dell'inglese COronaVIrus Disease-2019). Il nome viene impropriamente e ormai largamente usato come sinonimo del virus stesso, sebbene si riferisca alla patologia da esso causata.[4]
Il virus è stato sequenziato genomicamente dopo un test di acido nucleico effettuato su un campione prelevato da un paziente colpito da una polmonite, di cui non si conosceva la causa, all'inizio della pandemia del 2019-2023 a Wuhan.[5][6]
Caratteristiche biologiche[modifica | modifica wikitesto]
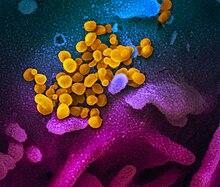
Il coronavirus SARS-CoV-2 è un ceppo virale appartenente al sottogenere Sarbecovirus, della sottofamiglia dei coronavirus (Orthocoronavirinae), responsabili di patologie che vanno dal raffreddore comune a malattie più gravi come la sindrome respiratoria mediorientale (MERS) e la sindrome respiratoria acuta grave (SARS). I coronavirus sono una vasta famiglia di virus, ma solo sei (229E, NL63, OC43, HKU1, MERS-CoV, SARS-CoV) erano precedentemente noti per la capacità di infettare gli esseri umani; quindi il SARS-CoV-2 è il settimo.
La sostanziale differenza dai precedenti è il periodo di incubazione, che va da 2 a 14 giorni durante i quali non provoca alcun sintomo. Il 26 gennaio 2020, Ma Xiaowei (ministro in carica per la Commissione Nazionale di Sanità cinese) ha dichiarato che "il nuovo coronavirus è contagioso, seppur limitatamente, anche nel suo periodo di incubazione, che dura fino a 14 giorni".[7] L'Organizzazione Mondiale della Sanità (OMS) ritiene che il numero di riproduzione di base che rappresenta la potenziale trasmissibilità del virus da persona a persona sia tra 1,4 e 3,8.[8] Questo valore indica il numero di altre persone a cui un paziente appena infetto può trasmettere la malattia, qualificando dunque il nuovo SARS-CoV-2 come infettivo quanto il SARS-CoV del 2002.[9] Durante una conferenza di aggiornamento del 29 gennaio 2020, l’Organizzazione Mondiale della Sanità fa sapere che il metodo di trasmissione non è solo diretto, ma anche indiretto per contatto.[10]
Il genoma del SARS-CoV-2 è formato da 29.881 nucleotidi[11] di cui l'89% identici a quelli del SARS-like-CoVZXC21 (diffuso nei pipistrelli) e l'82% identici a quelli del SARS-CoV; tuttavia solo il 40% degli aminoacidi coincide con quelli dei coronavirus legati alla SARS.[12] Recentemente, inoltre, un lavoro pubblicato sulla rivista Nature ha identificato delle specie di pipistrelli residenti nelle caverne del Laos settentrionale con un'identità di sequenza genomica superiore al 96% ed elevata similarità strutturale delle proprie proteine vitali ai fini della capacità replicativa ed infettiva, indicandoli come i virus animali più prossimi al SARS-CoV-2.[13][14]
Non è stato chiarito come il virus avrebbe potuto trasferirsi da ospiti a sangue freddo a ospiti a sangue caldo.[15] Un evento di ricombinazione omologa può aver mescolato un virus del sottogenere A (Embecovirus, virus simili a SARS Bat CoVZC45 e CoVZXC21) con la proteina legante del recettore di un Beta-CoV ancora sconosciuto.[16][17]
Genoma virale[modifica | modifica wikitesto]

Il 22 gennaio 2020, il Journal of Medical Virology ha pubblicato un rapporto con analisi genomica indicante che i serpenti nell'area di Wuhan sono "tra gli animali selvatici, il più probabile serbatoio" per il virus, ma sono necessarie ulteriori ricerche.[18]
Infatti, le sequenze del betacoronavirus di Wuhan mostrano somiglianze con i betacoronavirus trovati nei pipistrelli;[19] tuttavia, il virus è geneticamente distinto da altri coronavirus come quello correlato alla sindrome respiratoria acuta grave (SARS) e il coronavirus correlato alla sindrome respiratoria mediorientale da Coronavirus (MERS).[20]
Il SARS-CoV-2 è strettamente correlato al SARS-CoV-1 (identico dal 75% all'80%). Gli istituti di ricerca e per il controllo delle malattie cinesi hanno isolato cinque genomi del nuovo coronavirus, tra cui BetaCoV/Wuhan/IVDC-HB-01/2019, BetaCoV/Wuhan/IVDC-HB-04/2020, BetaCoV/Wuhan/IVDC-HB-05/2019, BetaCoV/Wuhan/WIV04/2019 e BetaCoV/Wuhan/IPBCAMS-WH-01/2019.[20][21][22] Il suo genoma è costituito da una singola elica di RNA di circa 30 kb (30 000 basi).[20]
Struttura[modifica | modifica wikitesto]

Ogni virione SARS-CoV-2 ha un diametro di circa 50-200 nanometri.[23]

Come altri coronavirus, SARS-CoV-2 presenta quattro proteine strutturali, note come: proteina S (spike o spinula), E (involucro), M (membrana) e N (nucleocapside); la proteina N contiene il genoma dell'RNA mentre le proteine S, E e M creano insieme il capside virale.[24] La proteina spike, che è stata analizzata a livello atomico mediante microscopia crioelettronica,[25][26] è quella che permette al virus di attaccarsi alla membrana di una cellula ospite.[24]
Gli esperimenti di modellizzazione delle proteine sulla proteina S del virus hanno suggerito che SARS-CoV-2 ha affinità con i recettori dell'enzima 2 di conversione dell'angiotensina (ACE2) delle cellule umane per usarle come "porta" di entrata nella cellula.[27]
Al 22 gennaio 2020, un gruppo cinese che lavorava con il genoma virale completo e un gruppo statunitense che utilizzava metodi di genetica inversa, hanno dimostrato indipendentemente che ACE2 era in grado di agire da recettore per SARS-CoV-2.[19][28][29][30][31][32] Gli studi hanno dimostrato che il SARS-CoV-2 ha un'affinità più elevata con ACE2 umano rispetto al SARS-CoV.[25]

S1/S2, S2': siti di taglio
PF: peptide di fusione
TM: dominio transmembrana
N-, C-: N-terminale e C-terminale
La proteina S è suddivisa in due subunità S1 e S2, la subunità S1 contiene il dominio di unione al recettore (DUR) ed è responsabile dell'attacco iniziale del virus alla cellula, tramite unione S1-recettore cellulare, mentre la subunità S2 è responsabile della fusione nella membrana cellulare per l'inserimento del RNA virale all'interno. Nei virus maturi la proteina S è presente come un trimero a forma di fungo con un DUR localizzato su ognuna delle tre subunità S1 che fanno da testa poggiando su uno stelo molto flessibile[33] composto dalle subunità S2. Le proteine S appaiono distribuite aleatoriamente sulla superficie virale.[33] I DUR cambiano continuamente tra posizione alzata e sdraiata. A differenza della proteina S del SARS-CoV in cui i DUR sono preferibilmente in posizione alzata[34][35], la proteina S del SARS-CoV-2 mantiene prevalentemente i DUR in posizione sdraiata.[36][37] Questo spiega il fatto che nonostante il DUR del SARS-CoV-2 mostri maggiore affinità per l'ACE, la sua minore accessibilità fa risultare una affinità d'unione SARS-CoV-2-ACE comparabile o minore dell'affinità SARS-CoV-ACE. Ma questa caratteristica di avere un DUR più nascosto rende più facile l'evasione dall'immunosorveglianza dell'organismo ospite.[38]
Come le proteine di fusione di molti altri virus, la proteina S è attivata da proteasi cellulari presenti sulla superficie delle cellule umane. L'attivazione di tale proteina del SARS-CoV-2 è un processo che richiede il taglio proteolitico in due distinti punti, S1/S2 e S2', che separa le due subunità S1 e S2 che però rimangono unite non covalentemente[39][40]. I tagli sono dovuti a due proteine presenti sulla membrana della cellula ospite, al punto S1/S2 tramite la furina, una proteina transmembrana che normalmente catalizza il rilascio di proteine mature a partire da precursori, e al punto S2' tramite la serina proteasi 2 transmembranica (TMPRSS2), il cui ruolo fisiologico è tuttora ignoto[41]. Il taglio al sito S2' appena sopra il peptite idrofilo di fusione sembra sia responsabile dell'inizio del attività di fusione membranica[42][43]. In seguito al taglio si ha lo sbloccaggio del peptide di fusione (PF) che a questo punto si protende per fondersi alla membrana cellulare.
Una variante della proteina S originale di Wuhan, nota come D614G già individuata nei primi mesi del 2020 ha iniziato a prendere piede in Europa per poi diffondersi successivamente in Nord America, Oceania e Asia per diventare progressivamente a partire da marzo la più diffusa al mondo[44]. Tale mutazione derivata da una mutazione missenso nel gene codificante la proteina S, risultante nel cambio di un amminoacido aspartato a una glicina nella posizione 614[45]. Nonostante la variante D614G presenti una morfologia e capacità neutralizzante simile alla variante di Wuhan, la prevalsa sul ceppo iniziale è stata spiegata in esperimenti in vitro en in vivo con un'aumentata affinità per l'ACE2 della cellula ricevente, aumentata replicazionne e trasmissione[46][47]. La variante D614G oltre al cambio nella posizione 614 è accompagnata nella maggior parte dei casi da altre 3 mutazioni ed è stata considerata dall'agosto 2020 la forma mondiale dominante[44].
A causa della rilevanza della proteina S nell'attacco alle cellule ospiti per la proliferazione del virus, una pressione selettiva continua causata da persone immunizzare naturalmente o tramite vaccinazione ha portato a far prevalere la diffusione di varianti virali con modifiche nella sequenza di questa proteina. Questo ha portato a riscontrare varianti virali del SARS-CoV-2 con capacità di maggiore infettività e/o migliore evasione ai sistemi immuni tra cui le prime scoperte furono originariamente in Inghilterra (B.1.1.7), Sudafrica (B.1.351), Brasile (P.1) e India (B.1.617)[48]. Le altre proteine del virus non subendo una pressione selettiva elevata non hanno subìto variazioni rilevanti nel tempo e sono anche tra le più conservate tra i vari coronavirus umani preesistenti.
Persistenza del virus[modifica | modifica wikitesto]
Diverse ricerche cercano di stabilire la persistenza del SARS-CoV-2 su vari tipi di superfici e ambienti anche in relazione alle condizioni variabili di temperatura, umidità, ecc.
Aria[modifica | modifica wikitesto]
Ricerche indicano che il virus può rimanere infettivo negli aerosol per ore mentre sulle superfici fino a giorni.[49][50] Infatti, la COVID-19 è trasmessa dagli aerosol, in cui occorrono circa 66 minuti affinché si dimezzi il numero delle particelle di virus vitali. Il 25% mantiene ancora la virulenza dopo poco più di un'ora e il 12,5% della carica virale persiste dopo circa tre ore.[49]
Metalli e altri materiali[modifica | modifica wikitesto]
Sull'acciaio inossidabile, per dimezzare la carica virale sono necessarie 5 ore e 38 minuti. Sulla plastica, invece, l'emivita è di 6 ore e 49 minuti; sul cartone l'emivita è di circa tre ore e mezzo. La carica virale sul rame si dimezza più velocemente che altrove, dove la metà del virus viene inattivato entro 45 minuti.[49][51][52]
Acqua[modifica | modifica wikitesto]
I sistemi di sanificazione delle acque potabili dovrebbero garantire di rimuovere o inattivare il virus,[53] così come quelli delle piscine e delle vasche di idromassaggio.[53]
Al 23 marzo 2020 si ritiene che il rischio di trasmissione della COVID-19 attraverso i sistemi fognari sia basso; pur non potendolo escludere del tutto a oggi non ci sono prove che ciò si sia verificato. Nell'epidemia di SARS del 2003, è stata documentata la trasmissione associata agli aerosol delle acque reflue; per cui va monitorata l'efficienza dei sistemi di clorazione delle acque reflue.[53] Una ricerca indica come la ricerca con Wastewater-Based Epidemiology (WBE) individua efficacemente i casi positivi di SARS-CoV-2 stimati dai titoli virali delle acque reflue è di ordini di grandezza maggiore del numero di casi confermati clinicamente; questo facilita le autorità a comprendere meglio la progressione il tasso di mortalità e la progressione della malattia.[54]
Varianti genomiche e sierotipi[modifica | modifica wikitesto]

Il virus che causa il COVID-19, ha molte varianti, alcune di queste sono ritenute di particolare importanza a causa della loro maggiore potenziale trasmissibilità, dell'aumento della virulenza e della ridotta efficacia, verso di esse, dei vaccini.[56][57]
La sequenza WIV04/2019, appartenente al clade GISAID S / PANGO A lineage / Nextstrain 19B, riflette maggiormente la sequenza del virus originale nota come "sequenza zero", essa è ampiamente utilizzata come sequenza di riferimento.[58]
A tutto aprile 2021 non è stata stabilita una nomenclatura coerente per il SARS-CoV-2.[59] Comunemente, anche da parte dei governi e dagli organi di stampa, le varianti sono spesso nominate in funzione del paese in cui sono state identificate per la prima volta,[60][61] ma a partire dal gennaio 2021, l'Organizzazione mondiale della sanità (OMS) sta lavorando ad una "nomenclatura standard per le varianti del SARS-CoV-2 che non fa riferimento al luogo di origine o primo isolamento".[62]
Il virus continuerà a mutare con sempre nuove varianti, ciò perché la sua circolazione è molto alta e quindi subirà la pressione selettiva operata dal sistema immunitario, favorendo la diffusione delle varianti che non vengono bloccate. I vaccini possono garantire una efficace protezione nelle popolazioni a condizione che vengano somministrati ad un ampio numero di soggetti di una popolazione e a condizione che non si sviluppino ceppi mutati (varianti) che abbiano la capacità di sfruttare la fuga immunitaria. Per questo motivo è importante insieme alla vaccinazione, ampliare il più possibile le indagini rivolte al sequenziamento genomico del virus circolante.[63]
Dall'iniziale esordio, nel novembre-dicembre 2019, dell'epidemia di SARS-CoV-2 a Wuhan in Cina, sono state individuate migliaia di varianti genomiche del virus, ciò anche per l'elevato tasso di sostituzione nucleotidica dei virus,[64] che in questo caso è pari a 8 × 10−4.[65] L'analisi genomica effettuata in Europa, e in particolare in Italia, mostra la presenza di diversi ceppi mutati del virus, con un tasso di mutazioni pari ad una ogni due settimane in media.[66]
Sierotipi[modifica | modifica wikitesto]
Ad agosto 2020 si ritiene che SARS-CoV-2 abbia almeno sei ceppi principali: L, S, V, G, GR e GH.[67]
Storia ed epidemiologia[modifica | modifica wikitesto]
Origine del virus[modifica | modifica wikitesto]

L’esatta origine del nuovo coronavirus è sconosciuta e nessuna ipotesi è stata scartata.[68] Diverse ipotesi formulate nei primi studi propendevano per un'eziopatogenesi a probabile carattere zoonotico (come la SARS e la MERS). Più scienziati ritenevano che la malattia potesse aver avuto origine dal Bungarus multicinctus, un serpente altamente velenoso commerciato nel mercato umido di Wuhan. Poiché la maggior parte del primo gruppo di soggetti infetti lavorava in quel mercato, si ipotizzava che vi fosse giunta una versione primordiale del virus, che da lì si sarebbe propagato nella provincia e nelle aree limitrofe.[18] Il 22 gennaio 2020 il Journal of Medical Virology pubblicava un rapporto con analisi genomica che affermava che i serpenti nell'area di Wuhan sarebbero stati "il più probabile serbatoio tra gli animali selvatici" per il virus. Uno studio filogenetico basato su genomi pubblicati, suggeriva che la trasmissione potesse essere avvenuta per il tramite di un singolo animale infetto.[69] Tale ipotesi è poi stata abbandonata ed è rimasta ignota la specie che potrebbe aver trasmesso il patogeno all'essere umano.
Una diversa ipotesi rispetto a quella del virus naturale si poggia sul fatto che tre ricercatori dell'istituto di virologia di Wuhan - non distante dal mercato - si erano ammalati già nel novembre 2019 e avevano cercato assistenza sanitaria.[70] Secondo Daniel Lucey, della Georgetown University, le prime infezioni sarebbero occorse nel novembre 2019 o prima, fuori dal mercato del pesce, essendoci uno studio pubblicato che mostra come tredici dei primi quarantuno pazienti riconosciuti non avevano alcunché a che fare con tale luogo.[71]
Le ipotesi sull'origine[modifica | modifica wikitesto]
Secondo la virologa Rasmussen: «Nessuno ha escluso l’origine del laboratorio"[72] ma la maggioranza degli studi pubblicati considera più probabile l'origine zoonotica.[73][74][75][76][77][78][79][80][81] Dopo mesi di negoziati tra l’OMS e il governo cinese, che inizialmente aveva rifiutato la possibilità di un’inchiesta indipendente sull'origine del virus, un team di scienziati dell’OMS ha avviato un'indagine che dopo aver analizzato le varie ipotesi sull'origine del virus definisce "estremamente improbabile" l'origine in un laboratorio.[77] L'inchiesta dell'OMS in seguito sarebbe stata considerata non sufficientemente trasparente da alcuni governi mondiali (principalmente occidentali) perché aveva seguito le linee guida del governo cinese, portando quindi a pensare a una manipolazione dei dati. Il 27 maggio 2021 il presidente degli Stati Uniti Joe Biden richiedeva nuove indagini riguardo all'origine del virus, dichiarando che quelle condotte fino a quel momento non avevano portato a una conclusione definitiva.[82] Nello stesso mese anche Anthony Fauci, virologo e consulente per la pandemia del presidente degli Stati Uniti, dichiarava di non poter escludere con certezza l'ipotesi del virus generato artificialmente.[83] Nell'agosto 2021 il governo cinese ha respinto la richiesta dell'OMS di effettuare ulteriori indagini sull'origine del virus.[84]
Origine naturale[modifica | modifica wikitesto]
Il 17 marzo 2020 uno studio pubblicato su Nature affermava che la struttura genetica del virus era incompatibile con qualsiasi alterazione artificiale al momento conosciuta e che la sua origine era molto probabilmente animale.[76] Questa era all'epoca la tesi condivisa dalla maggioranza degli scienziati.[85]
L'analisi filogenetica delle sequenze genomiche a lunghezza intera ottenute da pazienti infetti ha mostrato che SARS-CoV-2 è simile al coronavirus con sindrome respiratoria acuta grave (SARS-CoV)[86] e utilizza lo stesso recettore di ingresso cellulare, l'enzima di conversione dell'angiotensina 2 (ACE2).[87]
Secondo i sostenitori di questa tesi, le speculazioni sull'origine artificiale di SARS-CoV-2 sono infondate.[88] Diverse entità si sono adoperate per diversi mesi a censurare contenuti che sostenessero una tesi differente da quella dell'origine naturale del virus. Molti scienziati si sarebbero tirati indietro da tali indagini a causa dalla affermazioni di Donald Trump, considerate come tentativo di politicizzare la questione.[89] Facebook dichiarava solo nel maggio 2021 tramite un suo portavoce che avrebbe smesso di mettere in opera la censura sull'argomento.[82]
Due studi pubblicati nel 2022 sulla rivista Science identificano lo "Huanan seafood market in Wuhan" come primo epicentro di diffusione della CoViD-19, nonché come luogo dove il coronavirus SARS-CoV-2 avrebbe effettuato il passaggio di specie dagli animali all'uomo.[79][90]
Origine artificiale[modifica | modifica wikitesto]
L'ipotesi dell'origine artificiale parte dalla considerazione che nel corso del tempo in più laboratori sono avvenuti incidenti con conseguenti infezioni a medici.[91] Essa si poggia sulla possibile fuoriuscita da un laboratorio, avvenuta in modo accidentale durante la ricerca di un vaccino.[92][93] Il sospetto che SARS-CoV-2 possa avere un'origine di laboratorio nasce dalla coincidenza che sia stato rilevato per la prima volta in una città che ospita un importante laboratorio virologico che studia i coronavirus.[78] Il 14 settembre 2020 su Rai 3, in un'inchiesta presentata nella trasmissione PresaDiretta, si fa riferimento all'ipotesi che il virus SARS-CoV-2 abbia avuto un'origine artificiale e sia accidentalmente uscito da un laboratorio.[94]
Luc Montagnier, premio Nobel per la medicina nel 2008, basandosi sullo studio di alcuni ricercatori dell’Indian Institute of Technology di New Delhi, ha dichiarato in molteplici occasioni di ritenere che il SARS-CoV-2 potrebbe essere un virus fabbricato artificialmente a partire da sezioni del genoma del virus dell'immunodeficienza umana ed essere uscito accidentalmente da un laboratorio di Wuhan.[95] Queste affermazioni sono state contestate da Gaetan Burgio, genetista dell'Australian National University e da altri membri della comunità scientifica, poiché le sequenze di genoma in questione sarebbero molto corte e comuni a diversi altri virus.[96]
La virologa e ricercatrice cinese Li-Meng Yan, contestata da molti scienziati e censurata da Twitter[97], si associa alla ipotesi dell'origine artificiale, dichiarando in un libello di 27 pagine[98][99] sul coronavirus che: «L'evidenza mostra che SARS-CoV-2 dovrebbe essere un prodotto di laboratorio creato utilizzando i coronavirus di pipistrello ZC45 e/o ZXC21 come modello e/o spina dorsale». Durante la revisione paritaria del libello[100], le tesi di Li-Meng Yan sono state definite da più studiosi «infondate», «fuorvianti» e «disoneste».[101][102]
Secondo uno studio non conclusivo dell’ottobre 2022 di Bruttel, Washburne e VanDongen, della Duke University del Montana, pubblicato senza revisione paritetica, la modalità di distribuzione delle cerniere (restriction site) che mantengono attaccati i vari segmenti al genoma, indicherebbero un'alta probabilità che SARS-CoV-2 possa aver avuto origine come un clone infettivo assemblato in vitro.[103]
Fattori epidemiologici[modifica | modifica wikitesto]
Verso la fine di gennaio 2020 il virus si è diffuso a Bangkok (Thailandia), Tokyo (Giappone), Seul (Corea del Sud), Cina, Taiwan, Hong Kong, Macao, in Malaysia, Giappone, Stati Uniti, Vietnam, Singapore, Francia, Germania, Australia, Canada, Nepal, Cambogia, Sri Lanka, Italia, Emirati Arabi Uniti, Regno Unito, Brasile, Russia e Spagna.[104]
Alle 24:00 del 1º febbraio 2020, la Commissione Nazionale di Sanità (istituzione cinese) indicava: 14 411 casi confermati di cui 2 011 considerati gravi, 304 decessi, 328 pazienti guariti e dimessi, 19 544 casi sospetti. 118 478 persone sono sotto osservazione medica.[105][106]

Sebbene non fossero ancora del tutto chiare le modalità di trasmissione del virus, era stato confermato che è in grado di passare da persona a persona. Un funzionario della sanità pubblica nello stato di Washington negli Stati Uniti d'America ha osservato che i coronavirus vengono trasmessi principalmente "attraverso uno stretto contatto con un altro individuo, in particolare tossendo e starnutendo su qualcun altro che si trova entro un raggio di circa 1-2 metri da quella persona".[107] Si ritenne, infatti, che nella maggior parte dei casi la diffusione tra persone avvenisse attraverso le goccioline respiratorie emesse da un individuo infetto mediante tosse o starnuti che, successivamente, vengono inalate da un soggetto sano che si trovasse nelle vicinanze. Non era chiaro se fosse possibile infettarsi dal virus anche dopo aver toccato superfici o oggetti ove sia presente portando poi le mani verso la propria bocca o verso il naso o gli occhi.[108]
Sebbene i virus respiratori siano trasmissibili solitamente quando il soggetto malato presenta anche i sintomi, sembrerebbe che il SARS-CoV-2 possa diffondersi anche in occasione di un contatto ravvicinato con un paziente asintomatico.[108] Si stima che il numero di riproduzione di base della trasmissione del virus da persona a persona sia tra il 1,4 e il 3,8. Tale valore indica il numero di altre persone a cui un paziente appena infetto possa trasmettere la malattia. Secondo quanto riferito, il nuovo coronavirus è stato finora in grado di trasmettersi in catena fino a un massimo di quattro persone.[109]
Il 22 gennaio 2020, alcuni scienziati avevano pubblicato un articolo che, dopo aver esaminato "umani, pipistrelli, galline, ricci, pangolini e due specie di serpenti", concludeva che il SARS-CoV-2 "sembra essere un virus ricombinante fra il coronavirus del pipistrello e un coronavirus di origine sconosciuta" e "tra gli animali selvatici il serpente è il serbatoio più probabile per il SARS-CoV-2 da cui poi viene trasmesso agli umani".[110][111] Ulteriori studi hanno inoltre suggerito che il SARS-CoV-2 sia originato a seguito della "combinazione di virus da pipistrelli e serpenti".[110][111][112] Tuttavia, parte della comunità scientifica ha contestato tali conclusioni sostenendo che il pipistrello doveva essere il serbatoio naturale, mentre l'ospite intermedio, un uccello o un mammifero e non gli stessi serpenti.[112][113]
Il 25 gennaio 2020 non era ancora stato confermato quale potesse essere il serbatoio naturale del SARS-CoV-2 nella fauna selvatica e l'ospite intermedio che lo ha trasmesso agli esseri umani. È stato invece confermato che il virus riesce a entrare nella cellula umana attraverso il recettore ACE2, come il virus SARS-CoV.[114]
Il 20 gennaio 2020 la trasmissione da persona a persona è stata confermata a Guangdong, in Cina, da Zhong Nanshan, capo del gruppo della commissione sanitaria che indagava sulla pandemia, rivelando che avviene attraverso le mucose di occhi, naso, bocca o contatto.
In Italia, incrociando i dati epidemiologici e molecolari, secondo uno studio italiano,[115][116] la diffusione potrebbe essere partita intorno al 25 gennaio: infatti, studiando la banca dati GISAID, si scopre che i tre genomi del virus prelevati dai malati di Codogno erano strettamente correlati a quello isolato primariamente da un paziente ammalatosi di COVID-19 in Baviera, tra il 24 e il 27 gennaio 2020.
Patologie[modifica | modifica wikitesto]


L'infezione da SARS-CoV-2 nell'uomo comporta una malattia chiamata COVID-19. I pazienti contagiati dal virus accusano solitamente sintomi simili all'influenza, come febbre (in oltre il 90% dei casi), tosse[117] secca (oltre l'80% dei casi), stanchezza, respiro corto (circa 20% dei casi) e difficoltà di respiro (circa 15% dei casi)[118] che sono stati descritti come "simil-influenzali".[119] Dall'analisi dei dati su 155 pazienti italiani deceduti al 6 marzo 2020[120], condotta dall'Istituto Superiore di Sanità (ISS), sono meno comuni i sintomi gastrointestinali e no, come la diarrea, la congiuntivite e le eruzioni cutanee (da cui ha correlazione con la malattia di Kawasaki), o anche l'emottisi, cioè l'emissione di sangue dalle vie respiratorie, ad esempio con un colpo di tosse. Invece, uno studio cinese evidenzia principalmente in 99 casi su 204 pazienti, cioè circa il 48,5%, la presenza di diarrea o altri sintomi gastrointestinali (vomito, dolori addominali).[121] Sintomi che si hanno in una fase avanzata dell'infezione, sono la parziale (disosmia), o totale (anosmia) perdita olfattiva, o del gusto (disgeusia) che, al momento, non è chiaro se siano transitorie e possano terminare con la guarigione, o siano permanenti.[122][123]
Il 26 gennaio, Ma Xiaowei (Commissione Nazionale di Sanità) ha dichiarato che "il nuovo coronavirus è contagioso anche nel suo periodo di incubazione, che dura fino a 14 giorni".[7]
I casi di infezione grave possono causare polmonite, insufficienza renale acuta, fino ad arrivare al decesso.[124] I pazienti presentano anche leucopenia (carenza di globuli bianchi) e linfocitopenia (carenza di linfociti).
Similmente all'influenza e al SARS-CoV, il SARS-CoV-2 infetta e distrugge gli alveoli. Al collasso della barriera cellulare separante gli alveoli dai vasi sanguigni, il liquido dai vasi penetra gli alveoli bloccando il trasporto dell'ossigeno al sangue. Una reazione eccessiva del sistema immunitario può peggiorare il danno ai tessuti, che se irreversibile può risultare letale. Ma analogamente al SARS-CoV e MERS-CoV il danno non si ferma ai polmoni. Un'infezione da SARS-CoV-2 può scatenare una risposta immunitaria eccessiva e può causare una tempesta di citochine che può condurre a un'insufficienza multipla d’organo e alla morte.
In una dichiarazione rilasciata il 23 gennaio 2020, il direttore generale dell'Organizzazione mondiale della sanità, Tedros Adhanom Ghebreyesus, ha dichiarato che un quarto degli infetti presentava ulteriori malattie gravi e che molti di quelli deceduti accusavano ulteriori patologie come ipertensione, diabete o malattie cardiovascolari che alteravano il sistema immunitario.[125] Uno studio dimostra che la circonferenza del collo è un fattore di rischio per la necessità di ventilazione invasiva meccanica ed esito peggiore della malattia.[126]
Uno studio condotto sui primi quarantuno pazienti ricoverati negli ospedali di Wuhan con casi confermati ha riferito che la maggioranza dei pazienti era in buona salute prima di contrarre l'infezione e che oltre un quarto dei soggetti precedentemente sani necessitava di terapia intensiva.[127][128] Tra la maggior parte di coloro che hanno necessitato di un ricovero in ospedale, i parametri vitali erano stabili al momento del ricovero e presentavano un basso numero di globuli bianchi e bassi linfociti.[118]
Sebbene si supponga che le prime infezioni siano avvenute già qualche mese prima,[69] i primi cinquantanove casi sospetti sono stati registrati tra la fine di dicembre 2019 e l'inizio di gennaio dell'anno successivo e tra questi l'infezione è stata confermata in quarantuno pazienti. Trenta (73%) di questi erano uomini e l'età media era di quarantanove anni; quasi un terzo (32%) presentava una patologia di base pregressa, tra cui otto con diabete, sei con ipertensione e sei con malattie cardiache. Due terzi di questo primo gruppo erano stati esposti al mercato all'ingrosso dei frutti di mare di Huanan. I sintomi riportati tra loro sono stati: quaranta (98%) con febbre, trentuno (76%) con tosse e diciotto (44%) con dolori muscolari e stanchezza. Sintomi meno frequenti includevano tosse con espettorato o emottisi, mal di testa e diarrea. Circa la metà del gruppo presentava carenza di respiro e per tredici è stato necessario il ricovero in terapia intensiva. L'esame tramite tomografia computerizzata effettuato su tutte le quarantuno persone contagiate ha rivelato la presenza di polmonite. Le complicanze includevano dodici pazienti con sindrome da distress respiratorio acuto, cinque con danno cardiaco acuto e quattro con infezione secondaria.[129] In un recente studio è stata evidenziata una elevata percentuale di cheratocongiuntivite in pazienti ricoverati in terapia sub-intensiva per complicazioni polmonari; in particolare, è stato isolato il virus sulla superficie oculare nella maggior parte dei pazienti che effettuavano ossigenoterapia mediante maschera facciale o CPAP casco a differenza di quelli che avevano utilizzato soltanto cannula nasale. I dati suggeriscono una trasmissione del virus alla superficie oculare dall'aria espirata dallo stesso paziente attraverso tali dispositivi facciali[130]
Profilassi e vaccini[modifica | modifica wikitesto]

Nel gennaio 2020, diverse organizzazioni e istituzioni hanno iniziato a lavorare sulla creazione di vaccini per il SARS-CoV-2 basato sul genoma pubblicato. Il 30 gennaio il programma quadro Orizzonte 2020 dell'UE ha pubblicato un invito a manifestare interesse.
Altrove, tre progetti sui vaccini sono supportati dalla Coalizione per le innovazioni nella preparazione alle epidemie (CEPI), compresi i progetti delle società biotecnologiche Moderna e Inovio Pharmaceuticals e un altro dall'Università del Queensland. Il National Institutes of Health (NIH) degli Stati Uniti sta collaborando con Moderna per creare un vaccino RNA corrispondente a una protuberanza della superficie del coronavirus e spera di iniziare la produzione entro maggio 2020. In Australia, l'Università del Queensland sta studiando il potenziale di un vaccino a pinza molecolare che modificherebbe geneticamente le proteine virali per farle imitare il coronavirus e stimolare una reazione immunitaria. Inovio Pharmaceuticals, che sviluppa vaccinazioni del DNA che non sono ancora state approvate per uso umano, ha un vaccino candidato pronto per i test preclinici e sta collaborando con un'azienda cinese al fine di accelerarne l'accettazione da parte delle autorità di regolamentazione in Cina.
In un progetto indipendente, la Public Health Agency del Canada ha concesso l'autorizzazione al Centro internazionale per i vaccini (VIDO-InterVac) dell'Università del Saskatchewan di iniziare a lavorare su un vaccino. VIDO-InterVac mira ad avviare la produzione e la sperimentazione animale nel marzo 2020 e la sperimentazione umana nel 2021.
Altre specie animali contagiate[modifica | modifica wikitesto]
Oltre agli esseri umani, sono state contagiate altre specie di mammiferi domestici e non, il primo un cagnolino volpino il 26 febbraio 2020 a Hong Kong; un pastore tedesco sempre ad Hong Kong; a Whan nel gennaio 2020 quindici gatti, poi esemplari positivi in Belgio, Francia,Russia, Stati Uniti, Italia, Germania; cinque tigri e tre leoni nello zoo del Bronx New York; in diversi altri zoo un puma, tre leopardi delle nevi, un gorilla, due ippopotami ; nei Paesi Bassi nella primavera 2020 l'epidemia si è diffusa massicciamente negli allevamenti di visoni che hanno portato alla chiusura delle aziende e soppressione degli animali; l'epidemia dei visoni è giunta anche in Danimarca e Spagna; nel 2021 nello Yowa l'epidemia si diffonde tra i cervi dalla coda bianca[131].
Note[modifica | modifica wikitesto]
- ^ Dopo la malattia anche il coronavirus ha un nome, Sars-CoV-2, in ANSA, 12 febbraio 2020.
- ^ a b Che cosa è il coronavirus, in Agenzia Giornalistica Italia, 7 marzo 2020. URL consultato il 18 luglio 2020.
- ^ (EN) Novel Coronavirus (2019-nCoV) Situation Report - 10 (PDF), su who.int, Organizzazione mondiale della sanità, 30 gennaio 2020. URL consultato il 18 luglio 2020.
- ^ L'OMS ha chiamato COVID-19 la sindrome causata dal nuovo coronavirus, in il Post, 11 febbraio 2020. URL consultato l'11 febbraio 2020 (archiviato l'11 febbraio 2020).
- ^ New-type coronavirus causes pneumonia in Wuhan: expert, su Xinhua, 9 gennaio 2020. URL consultato il 23 gennaio 2020 (archiviato dall'url originale il 9 gennaio 2020).
- ^ (EN) Listings of WHO's response to COVID-19, su who.int. URL consultato il 9 settembre 2021.
- ^ a b Coronavirus contagious even incubation stage, in https://amp.scmp.com/news/china/society/article/3047701/coronavirus-contagious-even-incubation-stage-chinas-health#.
- ^ Istituto Superiore di Sanità: Che cosa è R0 e perché è così importante, su iss.it.
- ^ ECDC sheet 2019-nCoV, in https://www.ecdc.europa.eu/sites/default/files/documents/Risk-assessment-pneumonia-Wuhan-China-26-Jan-2020_0.pdf.
- ^ WHO conference about 2019-CoV, in https://twitter.com/ungeneva/status/1222519769275883521?s=21.
- ^ Severe acute respiratory syndrome coronavirus 2 isolate SARS-CoV-2/human/USA/WA-UW-1238/2020, complete genome, 1º ott 2020. URL consultato il 21 mag 2022. Ospitato su NCBI Nucleotide.
- ^ (EN) Chan JF, Kok KH, Zhu Z, Chu H, To KK, Yuan S, Yuen KY, Genomic characterization of the 2019 novel human-pathogenic coronavirus isolated from a patient with atypical pneumonia after visiting Wuhan
- ^ (EN) Sarah Temmam, Khamsing Vongphayloth e Eduard Baquero, Bat coronaviruses related to SARS-CoV-2 and infectious for human cells, in Nature, vol. 604, n. 7905, 2022-04, pp. 330–336, DOI:10.1038/s41586-022-04532-4. URL consultato il 15 aprile 2022.
- ^ Matteo Pavan, Davide Bassani e Mattia Sturlese, Bat coronaviruses related to SARS-CoV-2: what about their 3CL proteases (MPro)?, in Journal of Enzyme Inhibition and Medicinal Chemistry, vol. 37, n. 1, 31 dicembre 2022, pp. 1077–1082, DOI:10.1080/14756366.2022.2062336. URL consultato il 15 aprile 2022.
- ^ Massimo Zito, Sintomi e probabile origine del coronavirus di Wuhan, su reccom.org, Reccom Magazine, 23 gennaio 2020. URL consultato il 23 gennaio 2020 (archiviato dall'url originale il 19 febbraio 2020).
- ^ (EN) Wei Ji, Wei Wang e Xiaofang Zhao, Homologous recombination within the spike glycoprotein of the newly identified coronavirus may boost cross-species transmission from snake to human, in Journal of Medical Virology, DOI:10.1002/jmv.25682. URL consultato il 23 gennaio 2020.
- ^ (EN) Guangxiang “George” Luo, Haitao Guo e Shou-Jiang Gao, Snakes could be the original source of the new coronavirus outbreak in China, su The Conversation, 22 gennaio 2020. URL consultato il 23 gennaio 2020.
- ^ a b Haitao Guo, Guangxiang "George" Luo e Shou-Jiang Gao, Snakes could be the source of the Wuhan coronavirus outbreak, su CNN, 23 gennaio 2020. URL consultato il 23 gennaio 2020.
- ^ a b Peng Zhou e al., A pneumonia outbreak associated with a new coronavirus of probable bat origin, in Nature, n. 579, 3 febbraio 2020, pp. 270-273, DOI:10.1038/s41586-020-2012-7.
- ^ a b c (EN) Coronavirus, su who.int. URL consultato il 16 gennaio 2020 (archiviato dall'url originale il 20 gennaio 2020).
- ^ Initial genome release of novel coronavirus, su Virological, 11 gennaio 2020. URL consultato il 12 gennaio 2020 (archiviato dall'url originale il 12 gennaio 2020).
- ^ Wuhan seafood market pneumonia virus isolate Wuhan-Hu-1, complete genome, 17 gennaio 2020.
- ^ Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, Qiu Y, Wang J, Liu Y, Wei Y, Sia J, You T, Zhang X, Zhang L, Epidemiological and clinical characteristics of 99 cases of 2019 novel coronavirus pneumonia in Wuhan, China: a descriptive study, in The Lancet, vol. 395, 15 febbraio 2020, pp. 507-513, DOI:10.1016/S0140-6736(20)30211-7, PMID 32007143, 10223. URL consultato il 9 marzo 2020 (archiviato dall'url originale il 31 gennaio 2020).
- ^ a b Wu C, Liu Y, Yang Y, Zhang P, Zhong W, Wang Y, Wang Q, Xu Y, Li M, Li X, Zheng M, Chen L, Li H, Analysis of therapeutic targets for SARS-CoV-2 and discovery of potential drugs by computational methods, in Acta Pharmaceutica Sinica B, febbraio 2020, DOI:10.1016/j.apsb.2020.02.008.
- ^ a b Wrapp D, Wang N, Corbett KS, Goldsmith JA, Hsieh CL, Abiona O, Graham BS, McLellan JS, Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation, in Science, vol. 367, n. 6483, febbraio 2020, pp. 1260-1263, Bibcode:2020Sci...367.1260W, DOI:10.1126/science.abb2507, PMID 32075877.
- ^ Mandelbaum RF, Scientists Create Atomic-Level Image of the New Coronavirus's Potential Achilles Heel, su Gizmodo, 19 febbraio 2020. URL consultato il 13 marzo 2020 (archiviato l'8 marzo 2020).
- ^ Xu X, Chen P, Wang J, Feng J, Zhou H, Li X, Zhong W, Hao P, Evolution of the novel coronavirus from the ongoing Wuhan outbreak and modeling of its spike protein for risk of human transmission, in Science China Life Sciences, vol. 63, n. 3, marzo 2020, pp. 457-460, DOI:10.1007/s11427-020-1637-5, PMID 32009228.
- ^ Letko M, Munster V, Functional assessment of cell entry and receptor usage for lineage B β-coronaviruses, including 2019-nCoV (preprint), in bioRxiv, gennaio 2020, DOI:10.1101/2020.01.22.915660.
- ^ Letko M, Marzi A, Munster V, Functional assessment of cell entry and receptor usage for SARS-CoV-2 and other lineage B betacoronaviruses, in Nature Microbiology, febbraio 2020, DOI:10.1038/s41564-020-0688-y, PMID 32094589.
- ^ ((El Sahly HM)), Genomic Characterization of the 2019 Novel Coronavirus, in The New England Journal of Medicine. URL consultato il 9 febbraio 2020.
- ^ Gralinski LE, Menachery VD, Return of the Coronavirus: 2019-nCoV, in Viruses, vol. 12, n. 2, gennaio 2020, p. 135, DOI:10.3390/v12020135, PMID 31991541.
- ^ Lu R, Zhao X, Li J, Niu P, Yang B, Wu H, Wang W, Song H, Huang B, Zhu N, Bi Y, Ma X, Zhan F, Wang L, Hu T, Zhou H, Hu Z, Zhou W, Zhao L, Chen J, Meng Y, Wang J, Lin Y, Yuan J, Xie Z, Ma J, Liu WJ, Wang D, Xu W, Holmes EC, Gao GF, Wu G, Chen W, Shi W, Tan W, Genomic characterisation and epidemiology of 2019 novel coronavirus: implications for virus origins and receptor binding, in The Lancet, vol. 395, n. 10224, febbraio 2020, pp. 565-574, DOI:10.1016/S0140-6736(20)30251-8, PMID 32007145.
- ^ a b (EN) Beata Turoňová, Mateusz Sikora e Christoph Schürmann, In situ structural analysis of SARS-CoV-2 spike reveals flexibility mediated by three hinges, in Science, 18 agosto 2020, DOI:10.1126/science.abd5223. URL consultato il 27 agosto 2020.
- ^ (EN) Yuan Yuan, Duanfang Cao e Yanfang Zhang, Cryo-EM structures of MERS-CoV and SARS-CoV spike glycoproteins reveal the dynamic receptor binding domains, in Nature Communications, vol. 8, n. 1, 10 aprile 2017, p. 15092, DOI:10.1038/ncomms15092. URL consultato il 14 settembre 2020.
- ^ Miao Gui, Wenfei Song e Haixia Zhou, Cryo-electron microscopy structures of the SARS-CoV spike glycoprotein reveal a prerequisite conformational state for receptor binding, in Cell Research, vol. 27, n. 1, 23 dicembre 2016, pp. 119-129, DOI:10.1038/cr.2016.152. URL consultato il 27 agosto 2020.
- ^ Alexandra C. Walls, Young-Jun Park e M. Alejandra Tortorici, Structure, Function, and Antigenicity of the SARS-CoV-2 Spike Glycoprotein, in Cell, vol. 181, n. 2, 2020-04, pp. 281–292.e6, DOI:10.1016/j.cell.2020.02.058. URL consultato il 27 agosto 2020.
- ^ Daniel Wrapp, Nianshuang Wang e Kizzmekia S. Corbett, Cryo-EM structure of the 2019-nCoV spike in the prefusion conformation, in Science, vol. 367, n. 6483, 19 febbraio 2020, pp. 1260-1263, DOI:10.1126/science.abb2507. URL consultato il 27 agosto 2020.
- ^ Jian Shang, Yushun Wan e Chuming Luo, Cell entry mechanisms of SARS-CoV-2, in Proceedings of the National Academy of Sciences of the United States of America, vol. 117, n. 21, 26 maggio 2020, pp. 11727-11734, DOI:10.1073/pnas.2003138117. URL consultato il 27 agosto 2020.
- ^ Berend Jan Bosch, Willem Bartelink e Peter J. M. Rottier, Cathepsin L Functionally Cleaves the Severe Acute Respiratory Syndrome Coronavirus Class I Fusion Protein Upstream of Rather than Adjacent to the Fusion Peptide, in Journal of Virology, vol. 82, n. 17, 2008-9, pp. 8887-8890, DOI:10.1128/JVI.00415-08. URL consultato il 26 novembre 2020.
- ^ Sandrine Belouzard, Victor C. Chu e Gary R. Whittaker, Activation of the SARS coronavirus spike protein via sequential proteolytic cleavage at two distinct sites, in Proceedings of the National Academy of Sciences of the United States of America, vol. 106, n. 14, 7 aprile 2009, pp. 5871-5876, DOI:10.1073/pnas.0809524106. URL consultato il 26 novembre 2020.
- ^ Dorothea Bestle, Miriam Ruth Heindl e Hannah Limburg, TMPRSS2 and furin are both essential for proteolytic activation of SARS-CoV-2 in human airway cells, in Life Science Alliance, vol. 3, n. 9, 23 luglio 2020, DOI:10.26508/lsa.202000786. URL consultato il 29 aprile 2021.
- ^ Ikenna G. Madu, Shoshannah L. Roth e Sandrine Belouzard, Characterization of a Highly Conserved Domain within the Severe Acute Respiratory Syndrome Coronavirus Spike Protein S2 Domain with Characteristics of a Viral Fusion Peptide, in Journal of Virology, vol. 83, n. 15, 2009-8, pp. 7411-7421, DOI:10.1128/JVI.00079-09. URL consultato il 26 novembre 2020.
- ^ Alexandra C. Walls, M. Alejandra Tortorici e Berend-Jan Bosch, Cryo-electron microscopy structure of a coronavirus spike glycoprotein trimer, in Nature, vol. 531, n. 7592, 2016, pp. 114-117, DOI:10.1038/nature16988. URL consultato il 26 novembre 2020.
- ^ a b (EN) Bette Korber, Will M. Fischer e Sandrasegaram Gnanakaran, Tracking Changes in SARS-CoV-2 Spike: Evidence that D614G Increases Infectivity of the COVID-19 Virus, in Cell, vol. 182, n. 4, 20 agosto 2020, pp. 812–827.e19, DOI:10.1016/j.cell.2020.06.043. URL consultato il 24 novembre 2020.
- ^ (EN) Sandra Isabel, Lucía Graña-Miraglia e Jahir M. Gutierrez, Evolutionary and structural analyses of SARS-CoV-2 D614G spike protein mutation now documented worldwide, in Scientific Reports, vol. 10, n. 1, 20 agosto 2020, p. 14031, DOI:10.1038/s41598-020-70827-z. URL consultato il 24 novembre 2020.
- ^ (EN) Bin Zhou, Tran Thi Nhu Thao e Donata Hoffmann, SARS-CoV-2 spike D614G change enhances replication and transmission, in Nature, 26 febbraio 2021, pp. 1-8, DOI:10.1038/s41586-021-03361-1. URL consultato il 4 marzo 2021.
- ^ (EN) Yixuan J. Hou, Shiho Chiba e Peter Halfmann, SARS-CoV-2 D614G variant exhibits efficient replication ex vivo and transmission in vivo, in Science, 12 novembre 2020, DOI:10.1126/science.abe8499. URL consultato il 24 novembre 2020.
- ^ Ministero della Salute, Che cosa sappiamo sulle varianti del SARS-CoV-2, su salute.gov.it. URL consultato il 29 aprile 2021.
- ^ a b c van Doremalen N, Bushmaker T, Morris DH, Holbrook MG, Gamble A, Williamson BN, Tamin A, Harcourt JL, Thornburg NJ, Gerber SI, Lloyd-Smith JO, de Wit E, Munster VJ, Aerosol and Surface Stability of SARS-CoV-2 as Compared with SARS-CoV-1, in The New England Journal of Medicine, marzo 2020, DOI:10.1056/NEJMc2004973, PMID 32182409.
- ^ (EN) John A. Lednicky, Michael Lauzardo e Z. Hugh Fan, Viable SARS-CoV-2 in the air of a hospital room with COVID-19 patients, in medRxiv, 4 agosto 2020, pp. 2020.08.03.20167395, DOI:10.1101/2020.08.03.20167395. URL consultato il 19 agosto 2020.
- ^ (EN) Luca Fiorillo, Gabriele Cervino e Marco Matarese, COVID-19 Surface Persistence: A Recent Data Summary and Its Importance for Medical and Dental Settings, in International Journal of Environmental Research and Public Health, vol. 17, n. 9, 30 aprile 2020, p. 3132, DOI:10.3390/ijerph17093132. URL consultato il 17 maggio 2020.
- ^ a b c Municipal Water and COVID-19, su cdc.gov. URL consultato il 23 marzo 2020.
- ^ Wu F, Zhang J, Xiao A, Gu X, Lee WL, Armas F, Kauffman K, Hanage W, Matus M, Ghaeli N, Endo N, Duvallet C, Poyet M, Moniz K, Washburne AD, Erickson TB, Chai PR, Thompson J, Alm EJ, SARS-CoV-2 Titers in Wastewater Are Higher than Expected from Clinically Confirmed Cases, in mSystems, vol. 5, n. 4, luglio 2020, DOI:10.1128/mSystems.00614-20, PMID 32694130.
- ^ Alberto Gómez-Carballa, Xabier Bello, Jacobo Pardo-Seco, Federico Martinón-Torres e Antonio Salas, Mapping genome variation of SARS-CoV-2 worldwide highlights the impact of COVID-19 super-spreaders, su Genome Research, 2 settembre 2020, ISSN 1088-9051. URL consultato il 30 aprile 2021.
- ^ (EN) Coronavirus variants and mutations: The science explained, in BBC News, 6 gennaio 2021. URL consultato il 2 febbraio 2021.
- ^ Kupferschmidt K, New coronavirus variants could cause more reinfections, require updated vaccines, in Science, American Association for the Advancement of Science, 15 gennaio 2021, DOI:10.1126/science.abg6028. URL consultato il 2 febbraio 2021.
- ^ Anna Zhukova, Luc Blassel, Frédéric Lemoine, Marie Morel, Jakub Voznica e Olivier Gascuel, Origin, evolution and global spread of SARS-CoV-2, in Comptes rendus biologies, Cellule MathDoc/CEDRAM, 24 novembre 2020, pp. 1-20, DOI:10.5802/crbiol.29, ISSN 1768-3238, PMID 33274614.
- ^ SARS-CoV-2 genomic sequencing for public health goals: Interim guidance, 8 January 2021, su WHO, 8 gennaio 2021. URL consultato il 1º maggio 2021.
- ^ (EN) Don't call it the 'British variant.' Use the correct name: B.1.1.7, su STAT, 9 febbraio 2021. URL consultato il 12 febbraio 2021.
- ^ (EN) Flanagan R, Why the WHO won't call it the 'U.K. variant', and you shouldn't either, su Coronavirus, 2 febbraio 2021. URL consultato il 12 febbraio 2021.
- ^ World Health Organization, Statement on the sixth meeting of the International Health Regulations (2005) Emergency Committee regarding the coronavirus disease (COVID-19) pandemic, su who.int, 15 gennaio 2021. URL consultato il 18 gennaio 2021.
- ^ Che cosa sappiamo della variante sudafricana di Sars-Cov-2, su Wired, 5 gennaio 2021. URL consultato il 12 gennaio 2021.
- ^ Drake JW, Charlesworth B, Charlesworth D, Crow JF, Rates of spontaneous mutation, in Genetics, vol. 148, n. 4, aprile 1998, pp. 1667-86, PMC 1460098, PMID 9560386.
- ^ (LT) auspice - Global, su Nextstrain. URL consultato il 22 dicembre 2020.
- ^ (LT) auspice - Italy, su Nextstrain. URL consultato il 22 dicembre 2020.
- ^ (EN) The six strains of SARS-CoV-2, su ScienceDaily. URL consultato il 22 dicembre 2020.
- ^ Un «nuovo studio» mette in dubbio le origini naturali del Coronavirus? Mancano ancora le prove, su open.online.
- ^ a b (EN) Jon Cohen, Wuhan seafood market may not be source of novel virus spreading globally, su ScienceMag American Association for the Advancement of Science. (AAAS), 26 gennaio 2020. URL consultato il 29 gennaio 2020 (archiviato il 27 gennaio 2020).
- ^ Covid, Wsj: 'Tre ricercatori di Wuhan ammalati nel novembre 2019' - Mondo, su Agenzia ANSA, 24 maggio 2021. URL consultato il 25 settembre 2021.
- ^ (EN) Coronavirus—Unknown Source, Unrecognized Spread, and Pandemic Potential | Think Global Health, su Council on Foreign Relations. URL consultato il 22 ottobre 2021.
- ^ Una virologa cinese afferma che il coronavirus è artificiale. Ma mancano le prove, su wired.it.
- ^ Zi-Wei Ye, Shuofeng Yuan e Kit-San Yuen, Zoonotic origins of human coronaviruses, in International Journal of Biological Sciences, vol. 16, n. 10, 2020, pp. 1686–1697, DOI:10.7150/ijbs.45472. URL consultato il 3 novembre 2022.
- ^ D. K. Lvov e S. V. Alkhovsky, [Source of the COVID-19 pandemic: ecology and genetics of coronaviruses (Betacoronavirus: Coronaviridae) SARS-CoV, SARS-CoV-2 (subgenus Sarbecovirus), and MERS-CoV (subgenus Merbecovirus).], in Voprosy Virusologii, vol. 65, n. 2, 2020, pp. 62–70, DOI:10.36233/0507-4088-2020-65-2-62-70. URL consultato il 3 novembre 2022.
- ^ (EN) Why many scientists say it’s unlikely that SARS-CoV-2 originated from a ‘lab leak’, su science.org. URL consultato il 3 novembre 2022.
- ^ a b (EN) Kristian G. Andersen, Andrew Rambaut, W. Ian Lipkin, Edward C. Holmes & Robert F. Garry, The proximal origin of SARS-CoV-2, Nature, 17 marzo 2020.
- ^ a b (EN) WHO-convened Global Study of the Origins of SARS-CoV-2, su who.int. URL consultato il 3 novembre 2022.
- ^ a b (EN) Edward C. Holmes, Stephen A. Goldstein e Angela L. Rasmussen, The origins of SARS-CoV-2: A critical review, in Cell, vol. 184, n. 19, 16 settembre 2021, pp. 4848–4856, DOI:10.1016/j.cell.2021.08.017. URL consultato il 3 novembre 2022.
- ^ a b (EN) Jonathan E. Pekar, Andrew Magee e Edyth Parker, The molecular epidemiology of multiple zoonotic origins of SARS-CoV-2, in Science, vol. 377, n. 6609, 26 agosto 2022, pp. 960–966, DOI:10.1126/science.abp8337. URL consultato il 16 ottobre 2022.
- ^ (EN) Annisa Chand, Live animal sales and SARS-CoV-2, in Nature Food, vol. 3, n. 9, 2022-09, pp. 675–675, DOI:10.1038/s43016-022-00606-8. URL consultato il 3 novembre 2022.
- ^ (EN) Michael Worobey, Dissecting the early COVID-19 cases in Wuhan, in Science, vol. 374, n. 6572, 3 dicembre 2021, pp. 1202–1204, DOI:10.1126/science.abm4454. URL consultato il 3 novembre 2022.
- ^ a b Giovanna Chioini, Una nuova inchiesta sull’origine del covid e le altre notizie sul virus, su Internazionale, 28 maggio 2021. URL consultato il 1º giugno 2021.
- ^ FABIO LOMBARDI, Fauci e il Covid creato in laboratorio cinese. "Non sono convinto sia un virus naturale", su Il Giorno, 1621938919026. URL consultato il 2 giugno 2021.
- ^ Covid-19, la Cina nega a Oms altre indagini sull’origine del virus, su Notizie.it, 13 agosto 2021. URL consultato il 23 settembre 2021.
- ^ Andersen KG, Rambaut A, Lipkin WI, Holmes EC, Garry RF, The proximal origin of SARS-CoV-2, in Nat. Med., vol. 26, n. 4, aprile 2020, pp. 450-452, DOI:10.1038/s41591-020-0820-9, PMC 7095063, PMID 32284615.
- ^ Wang H, Li X, Li T, Zhang S, Wang L, Wu X, Liu J, The genetic sequence, origin, and diagnosis of SARS-CoV-2, in Eur. J. Clin. Microbiol. Infect. Dis., vol. 39, n. 9, settembre 2020, pp. 1629-1635, DOI:10.1007/s10096-020-03899-4, PMC 7180649, PMID 32333222.
- ^ Dallavilla T, Bertelli M, Morresi A, Bushati V, Stuppia L, Beccari T, Chiurazzi P, Marceddu G, Bioinformatic analysis indicates that SARS-CoV-2 is unrelated to known artificial coronaviruses, in Eur Rev Med Pharmacol Sci, vol. 24, n. 8, aprile 2020, pp. 4558-4564, DOI:10.26355/eurrev_202004_21041, PMID 32373995.
- ^ Massimo Gaggi, L'origine del Covid e i nuovi indizi che tornano a puntare sulla fuga dal laboratorio di Wuhan, su Corriere della Sera, 11 gennaio 2022. URL consultato il 2 novembre 2022.
- ^ (EN) Michael Worobey, Joshua I. Levy e Lorena Malpica Serrano, The Huanan Seafood Wholesale Market in Wuhan was the early epicenter of the COVID-19 pandemic, in Science, vol. 377, n. 6609, 26 agosto 2022, pp. 951–959, DOI:10.1126/science.abp8715. URL consultato il 16 ottobre 2022.
- ^ "La storia è piena di incidenti in laboratorio. Ma non c'è la prova sulle origini del Covid" (di S. Renda), su L'HuffPost, 31 agosto 2021. URL consultato il 25 settembre 2021.
- ^ (EN) E.Sallard, J.Halloy, D.Casane, E.Decroly, J.van Helden, Tracing the origins of SARS-COV-2 in coronavirus phylogenies, su hal.archives-ouvertes.fr, 13 agosto 2020 (in press). URL consultato il 13 agosto 2020. Contiene una presentazione delle ipotesi contrapposte.
- ^ (FR) Le coronavirus, fabriqué à partir du virus du sida ? La thèse très contestée du professeur Montagnier, su Le Monde, 17 aprile 2020. URL consultato il 13 agosto 2020.
- ^ SARS-Cov-2 Identikit di un killer, su rai.it, RAI Ufficio Stampa. URL consultato il 18 settembre 2020.
- ^ Coronavirus, il Nobel per la Medicina Montagnier: "Il genoma lo conferma, creato in laboratorio e sfuggito", su liberoquotidiano.it.
- ^ Coronavirus, la comunità scientifica demolisce le tesi di Montagnier sul Covid-19 creato in laboratorio, su lastampa.it.
- ^ "Ho le prove che il Coronavirus è stato prodotto in laboratorio". Twitter le censura l'account, su huffingtonpost.it.
- ^ Li-Meng Yan, Shu Kang e Shanchang Hu, Unusual Features of the SARS-CoV-2 Genome Suggesting Sophisticated Laboratory Modification Rather Than Natural Evolution and Delineation of Its Probable Synthetic Route, Zenodo, 14 settembre 2020. URL consultato il 16 ottobre 2022.
- ^ Li-meng Yan e A. Cheok, Unusual Features of the SARS-CoV-2 Genome Suggesting Sophisticated Laboratory Modification as a Biological Robot, in Analyzing Current and Future Global Trends in Populism, 2022, DOI:10.4018/978-1-7998-4679-6.ch005. URL consultato il 7 ottobre 2022.
- ^ Johns Hopkins Center for Health Security: Kelsey Lane Warmbrod, MS, MPH; Rachel M. West, PhD; Nancy D. Connell, PhD; and Gigi Kwik Gronvall, PhD - In Response: Yan et al Preprint Examinations of the Origin of SARS-CoV-2 (PDF), su centerforhealthsecurity.org.
- ^ Amy Harris, New Peer Reviews: Yan Report’s Claims that SARS-CoV-2 Was Created in a Chinese Lab Are Misleading and Unethical, in Rapid Reviews COVID-19, 2 ott 2020. URL consultato il 21 mag 2022. Ospitato su rapidreviewscovid19.mitpress.mit.edu.
- ^ Scientists said claims about China creating the coronavirus were misleading. They went viral anyway.
- ^ (EN) Valentin Bruttel, Alex Washburne e Antonius VanDongen, Endonuclease fingerprint indicates a synthetic origin of SARS-CoV-2, 20 ottobre 2022, pp. 2022.10.18.512756, DOI:10.1101/2022.10.18.512756v1. URL consultato il 2 novembre 2022.
- ^ Realtime 2019-nCoV Map, su bnonews.com.
- ^ 2019nCoV situation - China, su nhc.gov.cn. URL consultato il 29 gennaio 2020 (archiviato dall'url originale il 29 gennaio 2020).
- ^ China National Health Center, su en.nhc.gov.cn. URL consultato il 2 febbraio 2020 (archiviato dall'url originale il 17 giugno 2021).
- ^ Erika Edwards, How does coronavirus spread?.
- ^ a b CDC, How 2019-nCoV Spreads, su cdc.gov. URL consultato il 1º febbraio 2020.
- ^ Tina Hesman Saey, How the new coronavirus stacks up against SARS and MERS, su sciencenews.org, 24 gennaio 2020. URL consultato il 25 gennaio 2020 (archiviato dall'url originale il 25 gennaio 2020).
- ^ a b Haitao Guo, Guangxiang "George" Luo, Shou-Jiang Gao, Snakes Could Be the Original Source of the New Coronavirus Outbreak in China, su Scientific American, 22 gennaio 2020. URL consultato il 24 gennaio 2020 (archiviato dall'url originale il 25 gennaio 2020).
- ^ a b Wei Ji, Wei Wang, Xiaofang Zhao, Junjie Zai e Xingguang Li, Homologous recombination within the spike glycoprotein of the newly identified coronavirus may boost cross‐species transmission from snake to human, in Journal of Medical Virology, 22 gennaio 2020, DOI:10.1002/jmv.25682. URL consultato il 22 gennaio 2020.
- ^ a b Ewen Callaway e David Cyranoski, Why snakes probably aren't spreading the new China virus, in Nature, 23 gennaio 2020, DOI:10.1038/d41586-020-00180-8. URL consultato il 23 gennaio 2020 (archiviato dall'url originale il 25 gennaio 2020).
- ^ Megan Multeni, No, the Wuhan Virus Is Not a 'Snake Flu', su Wired, 23 gennaio 2020. URL consultato il 24 gennaio 2020 (archiviato dall'url originale il 24 gennaio 2020).
- ^ Zheng-Li Shi, Peng Zhou, Xing-Lou Yang, Xian-Guang Wang, Ben Hu, Lei Zhang, Wei Zhang, Hao-Rui Si, Yan Zhu, Bei Li e Chao-Lin Huang, Discovery of a novel coronavirus associated with the recent pneumonia outbreak in humans and its potential bat origin, in bioRxiv, 23 gennaio 2020, pp. 2020.01.22.914952, DOI:10.1101/2020.01.22.914952.
- ^ (EN) Gianguglielmo Zehender, Alessia Lai, Annalisa Bergna, Luca Meroni, Agostino Riva, Claudia Balotta, Maciej Tarkowski, Arianna Gabrieli, Dario Bernacchia, Stefano Rusconi, Giuliano Rizzardini, Spinello Antinori e Massimo Galli, Genomic Characterisation And Phylogenetic Analysis Of Sars-Cov-2 In Italy, in Journal of medical virology, medRxIV, 20 marzo 2020, DOI:10.1101/2020.03.15.20032870.
- ^ Il virus Sars-Cov-2 era in Italia già da gennaio, su ANSA, 26 marzo 2020. URL consultato il 26 marzo 2020.
- ^ Wuhan pneumonia virus outbreak: What we know so far, su CNA. URL consultato il 21 gennaio 2020 (archiviato dall'url originale il 22 gennaio 2020).
- ^ a b Hui DS, I Azhar E, Madani TA, Ntoumi F, Kock R, Dar O, Ippolito G, Mchugh TD, Memish ZA, Drosten C, Zumla A, Petersen E, The continuing 2019-nCoV epidemic threat of novel coronaviruses to global health - The latest 2019 novel coronavirus outbreak in Wuhan, China, in International Journal of Infectious Diseases : IJID : Official Publication of the International Society for Infectious Diseases, vol. 91, gennaio 2020, pp. 264-266, DOI:10.1016/j.ijid.2020.01.009, PMID 31953166.
- ^ (EN) DOH monitors child from Wuhan, China who manifested flu-like symptoms, su Yahoo. URL consultato il 21 gennaio 2020 (archiviato dall'url originale il 22 gennaio 2020).
- ^ Comunicato Stampa n°17/2020 - Coronavirus, febbre e affanno sintomi iniziali più comuni per i deceduti positivi a Covid-19, su Istituto Superiore di Sanità, 7 marzo 2020. URL consultato il 20 marzo 2020.
- ^ (EN) Pan Lei, Mu Mi, Ren Hong Gang, Yang Pengcheng, Sun Yu, Wang Rungsheng, Yan Junhong, Li Pibao, Hu Baoguang, Hu Chao, Jin Yuan, Niu Xun, Ping Rongyu, Du Yingzhen, Li Tianzhi, Liu Chengxia, Xu Guogang, Hu Qinyong e Tu Lei, Clinical characteristics of COVID-19 patients with digestive symptoms in Hubei, China: a descriptive, cross-sectional, multicenter study (PDF), su The American Journal of Gastroenterology, 18 marzo 2020. URL consultato il 20 marzo 2020.
- ^ Sintomi Coronavirus, anche perdita gusto e olfatto "La notiamo in fase avanzata", su ilsussidiario.net.
- ^ Loss of sense of smell as marker of COVID-19 infection (PDF), su entuk.org. URL consultato il 1º aprile 2020 (archiviato dall'url originale il 28 marzo 2020).
- ^ (EN) Q&A on coronaviruses, su who.int. URL consultato il 27 gennaio 2020.
- ^ WHO Director-General's statement on the advice of the IHR Emergency Committee on Novel Coronavirus, su who.int.
- ^ (EN) Stefano Di Bella, Roberto Cesareo e Paolo De Cristofaro, Neck circumference as reliable predictor of mechanical ventilation support in adult inpatients with COVID‐19: A multicentric prospective evaluation, in Diabetes/Metabolism Research and Reviews, 14 giugno 2020, DOI:10.1002/dmrr.3354. URL consultato il 21 luglio 2020.
- ^ Andrew Joseph, New coronavirus can cause infections with no symptoms and sicken otherwise healthy people, studies show, in STAT, 24 gennaio 2020. URL consultato il 27 gennaio 2020.
- ^ (EN) Chaolin Huang, Yeming Wang, Xingwang Li, Lili Ren, Jianping Zhao, Yi Hu, Li Zhang, Guohui Fan, Jiuyang Xu, Xiaoying Gu e Zhenshun Cheng, Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China, in The Lancet, 24 gennaio 2020, pp. S0140673620301835, DOI:10.1016/S0140-6736(20)30183-5.
- ^ Chaolin Huang, Yeming Wang, Xingwang Li, Lili Ren, Jianping Zhao, Yi Hu, Li Zhang, Guohui Fan, Jiuyang Xu, Xiaoying Gu e Zhenshun Cheng, Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China, in The Lancet, vol. 0, 24 gennaio 2020, DOI:10.1016/S0140-6736(20)30183-5, ISSN 0140-6736, PMID 31986264.
- ^ Troisi Mario, Zannella Carla e Troisi Salvatore, Ocular Surface Infection by SARS-CoV-2 in COVID-19 Pneumonia Patients Admitted to Sub-Intensive Unit: Preliminary Results, in Microorganisms, vol. 10/2022, 2, 347.
- ^ David Quammen, Senza respiro, Sottocapitolo 65 pag.333, trad. Milena Zemira Ciccimarra, Milano, Adelphi, 2022, ISBN 978-88-459-3739-2
Voci correlate[modifica | modifica wikitesto]
- Coronavirus
- COVID-19
- Epidemia
- Epidemia di SARS del 2002-2004
- MERS
- MERS-CoV
- Pandemia
- Pandemia di COVID-19
- SARS
- SARS-CoV
- SARS-related coronavirus
- Varianti del SARS-CoV-2
- Virus trasmessi da pipistrelli
Altri progetti[modifica | modifica wikitesto]
 Wikiquote contiene citazioni di o su SARS-CoV-2
Wikiquote contiene citazioni di o su SARS-CoV-2 Wikimedia Commons contiene immagini o altri file su SARS-CoV-2
Wikimedia Commons contiene immagini o altri file su SARS-CoV-2 Wikispecies contiene informazioni su SARS-CoV-2
Wikispecies contiene informazioni su SARS-CoV-2
Collegamenti esterni[modifica | modifica wikitesto]
- Corona MAP - Servizio gratuito con la mappa di diffusione del virus per provincia Italiana e del resto del mondo. Aggiornato con dati da fonti ufficiali.
- FAQ - Infezione da coronavirus 2019-nCoV, su salute.gov.it, Ministero della Salute.
- (EN) 2019-nCoV Global Cases by Johns Hopkins CSSE, su gisanddata.maps.arcgis.com.ci
- Taxonomy browser (Severe acute respiratory syndrome coronavirus 2), su NCBI.
| Controllo di autorità | Thesaurus BNCF 68706 · GND (DE) 1206288906 · BNE (ES) XX6068537 (data) · BNF (FR) cb17874459p (data) |
|---|
