Sistema cubico

Il sistema cubico è uno dei sistemi utilizzati per la classificazione dei minerali sulla base del loro grado di simmetria. È uno dei più comuni e semplici schemi riscontrati nei cristalli e nei minerali.
Vi sono tre principali tipologie di sistema cubico: semplice, corpo-centrato (bcc) e faccia-centrato (fcc), cui si aggiungono diverse altre varianti. Da notare che sebbene la cella unitaria di questi cristalli sia presa per convenzione come un cubo, spesso la cella primitiva non lo è; questo perché nella maggior parte dei sistemi cubici è presente più di un atomo per singola unità.
Il sistema cubico è il sistema a più alto grado di simmetria: i cristalli dei minerali che appartengono a questo sistema sono caratterizzati dalla presenza di un centro di simmetria; inoltre, considerando il cristallo secondo i tre classici assi a,b,c della mineralogia la cella elementare del cristallo ha tre lati e tre angoli di misura uguale:
- a = b = c
- α = β = γ
| Reticolo di Bravais | Sistema cristallino | Cella convenzionale | VC/VP (*) | Generatori |
| Cubico P (semplice) | Cubico a=b=c α=β=γ=90° |
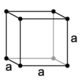
|
1 | a1 = a a2 = b a3 = c |
| Cubico I (a corpo centrato) | 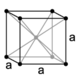
|
2 | a1 = a a2 = b a3 = (a+b+c)/2 | |
| Cubico F (a facce centrate) | 
|
4 | a1 = (a+b)/2 a2 = (a+c)/2 a3 = (b+c)/2 |
Strutture comuni in composti binari
[modifica | modifica wikitesto]Di seguito sono illustrate alcune strutture appartenenti al sistema cubico, comunemente osservate in composti ionici binari. È uso denominare le singole strutture col nome di un tipico composto che presenta quella struttura. Ad esempio, si usa dire che cloruro di litio e ossido di magnesio sono composti che cristallizzano nella struttura tipo cloruro di sodio.
Struttura tipo cloruro di sodio
[modifica | modifica wikitesto]
Nel cloruro di sodio (NaCl) ciascuno dei due tipi di atomo forma un reticolo cubico a facce centrate; i due reticoli sono interpenetrati in modo che ogni atomo di un tipo sia al centro di una cella unitaria del reticolo cubico a facce centrate degli altri atomi. Alternativamente, si può considerare che gli anioni Cl– più grandi (r = 181 pm) formino un reticolo a facce centrate, mentre i cationi Na+ più piccoli (r = 102 pm) occupano gli interstizi ottaedrici. In ogni caso sia Na+ che Cl– sono esacoordinati con geometria ottaedrica. In prima approssimazione si può prevedere che questa struttura si formi più facilmente quando il rapporto tra raggio del catione e raggio dell'anione è compreso tra 0,41 e 0,73.[1] I composti binari che cristallizzano con la struttura tipo NaCl sono più di 400. Alcuni esempi sono: alogenuri di sodio, litio, potassio e rubidio, ossidi e calcogenuri di metalli divalenti (MgO, CaO, SrO, MnO, CoO...), alogenuri d'argento (tranne AgI), leghe interstiziali.[2]
Struttura tipo cloruro di cesio
[modifica | modifica wikitesto]
Nel cloruro di cesio (CsCl) ciascuno dei due tipi di atomo forma un reticolo cubico semplice; i due reticoli sono interpenetrati in modo che ogni atomo di un tipo sia al centro di una cella unitaria del reticolo cubico semplice degli altri atomi. Alternativamente, si può considerare che gli anioni Cl– (r = 181 pm) formino un reticolo cubico semplice, con un catione Cs+ (r = 167 pm) al centro di ciascun interstizio cubico. In questo modo ogni ione è circondato da otto ioni di carica opposta con simmetria cubica. In prima approssimazione si può prevedere che questa struttura si formi più facilmente quando il rapporto tra raggio del catione e raggio dell'anione è maggiore di 0,73. La struttura tipo CsCl è molto meno comune di quella tipo NaCl; oltre a CsCl è adottata ad esempio da CsBr, CsI, TiCl, TiBr.[1]
Struttura tipo solfuro di zinco
[modifica | modifica wikitesto]
Questa struttura è detta anche tipo blenda di zinco (o sfalerite) dal nome del minerale dove ricorre questa struttura. Analogamente alla struttura tipo NaCl, anche nella struttura tipo ZnS ciascuno dei due tipi di atomo forma un reticolo cubico a facce centrate, ma i due reticoli sono interpenetrati in modo differente, ponendo gli ioni Zn2+ in modo da occupare metà degli interstizi tetraedrici. In questo modo ogni ione è circondato da quattro ioni di carica opposta con simmetria tetraedrica. Questo reticolo cristallino è analogo a quello del diamante, che si ottiene scambiando tutti gli atomi Zn e S con atomi di carbonio. In prima approssimazione si può prevedere che questa struttura si formi più facilmente quando il rapporto tra raggio del catione e raggio dell'anione è compreso tra 0,22 e 0,41. La struttura tipo ZnS è presente in molti composti binari. Alcuni esempi sono BN, CdS, CuCl, HgS.[2]
Struttura tipo fluorite
[modifica | modifica wikitesto]
Questo tipo di struttura prende il nome dal minerale fluorite, composto da fluoruro di calcio (CaF2). Questa struttura si può considerare composta da un reticolo cubico a facce centrate di cationi Ca2+, mentre gli anioni F– occupano tutti gli interstizi tetraedrici. In questo modo ogni catione Ca2+ è attorniato da otto anioni F– con simmetria cubica, e ogni anione F– è attorniato da quattro cationi Ca2+ con simmetria tetraedrica. BaCl2, SrF2, CeO2 e ZrO2 sono alcuni esempi di struttura tipo fluorite.[1][2]
Struttura tipo antifluorite
[modifica | modifica wikitesto]Questa struttura si ottiene dalla struttura tipo fluorite scambiando le posizioni di cationi e anioni. In questo modo il numero di cationi diventa il doppio di quello degli anioni, e quindi si hanno composti di stechiometria generale M2X. Nella struttura tipo antifluorite ogni anione è attorniato da otto cationi con simmetria cubica, e ogni catione è attorniato da quattro anioni con simmetria tetraedrica. K2O, Na2O e Na2S sono alcuni esempi di struttura tipo antifluorite.[2]
Note
[modifica | modifica wikitesto]- ^ a b c Housecroft e Sharpe 2008
- ^ a b c d Li et al. 2008
Bibliografia
[modifica | modifica wikitesto]- (EN) C. E. Housecroft e A. G. Sharpe, Inorganic chemistry, 3ª ed., Harlow (England), Pearson Education Limited, 2008, ISBN 978-0-13-175553-6.
- (EN) W.-K. Li, G.-D- Zhou, T. C. W. Mak, Advanced Structural Inorganic Chemistry, New York, Oxford University Press, 2008, ISBN 978–0–19–921694–9.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file sul sistema cubico
Wikimedia Commons contiene immagini o altri file sul sistema cubico
| Controllo di autorità | GND (DE) 4314776-8 |
|---|
